| |
| Med Sci (Paris). 33(3): 345–348. doi: 10.1051/medsci/20173303024.Un nouvel éLiXiR pour les cellules dendritiques plasmocytoïdes leucémiques ou dérégulées dans les pathologies inflammatoires Adam Ceroi,1 David Masson,2 Francine Garnache-Ottou,1 and Philippe Saas1* 1Université Bourgogne Franche-Comté, Inserm, EFS BFC, UMR1098, Interactions hôte-greffon-tumeur, LabEX LipSTIC, 1, boulevard A Fleming, 25020Besançon, France 2Université Bourgogne Franche-Comté, Inserm, U1231, Lipides Nutrition Cancer, LabEX LipSTIC, Dijon, France |
Les cellules dendritiques plasmocytoïdes (PDC) constituent une sous-population de cellules dendritiques [1] (→) caractérisées par leur capacité de production d’interféron de type I (IFN-I) après reconnaissance d’acides nucléiques bactériens ou viraux. L’activation de ces PDC entraîne également la production d’autres cytokines, dont le TNF-α (tumor necrosis factor alpha) ou l’interleukine-6 (IL-6), contribuant à la réponse inflammatoire [2]. Les PDC contribuent, par ailleurs, à l’activation des cellules de l’immunité adaptative (lymphocytes T et B) [2], un aspect qui ne sera pas abordé dans cette Nouvelle.
(→) Voir la Nouvelle de G. Breton, m/s n° 8-9, août-septembre 2015, page 725
|
Cellules dendritiques plasmocytoïdes, microparticules et pathologies auto-immunes Les PDC sont impliquées dans des pathologies auto-immunes telles que le psoriasis1,, le lupus érythémateux disséminé2, (LED) ou encore certaines vascularites3, [2, 3] (→).
(→) Voir la Nouvelle de V. Witko-Sarsat et S. Perruche, m/s n° 5, mai 2016, page 450
Dans le LED, l’activation des PDC résulte de la reconnaissance de complexes immuns (formés d’ADN du soi et d’auto-anticorps) par les TLR (Toll-like receptors)-7 et TLR-9, entraînant la production d’IFN-I. Cet effet est également observé après reconnaissance d’éléments provenant de la nécrose cellulaire ou d’un défaut de clairance des corps apoptotiques. Ces éléments peuvent être libérés par bourgeonnement de la membrane, conduisant à la formation de microparticules (MP). Ces MP sont des vésicules de taille comprise entre 0,1 et 1 µm composées de la membrane plasmique, des protéines membranaires associées et du contenu cytosolique de leur cellule d’origine (acides nucléiques et protéines). Elles expriment à leur surface des phosphatidylsérines (PtdSer) qui contribuent à leur capture par les cellules de l’organisme, leur permettant de participer à la communication intercellulaire par stimulation de cellules distantes. Dans différentes pathologies, l’origine et le nombre des MP circulantes sont significativement modifiés, d’où leur intérêt en tant que biomarqueur. C’est le cas pour les MP dérivées des cellules endothéliales (EMP) dont la concentration sanguine est plus élevée que la normale dans le psoriasis [4] et qui activent les PDC [5] (→).
(→) Voir la Nouvelle de F. Angelot et al., m/s n° 1, janvier 2010, page 31
À l’inverse, les MP dérivées de plaquettes (PMP) diminuent la réponse inflammatoire des PDC [5, 6]. Ceci démontre l’importance de l’origine des MP dans leur potentiel inflammatoire, faisant de celles-ci une cible thérapeutique potentielle pour limiter l’activation pathologique des PDC. Deux principales stratégies sont envisageables : diminuer/modifier la génération des MP ou augmenter leur élimination de l’organisme. La première approche est utilisée chez des patients souffrant de psoriasis par la neutralisation du TNF-α (un puissant inducteur de la production des EMP) résultant en une diminution significative du nombre des EMP circulantes et en un bénéfice clinique [4]. Le potentiel de la seconde approche est illustré par la régression du syndrome lupique ou de l’inflammation intestinale dans des modèles murins, suite à l’augmentation de la clairance de vésicules exposant les PtdSer (corps apoptotiques) par la surexpression des récepteurs des PtdSer (PtdSerR), Mertk (mer tyrosine kinase) ou Bai-1 (brain-specific angiogenesis inhibitor-1) [7, 8]. L’implication des MP dans ces effets reste cependant à démontrer. |
Cellules dendritiques plasmocytoïdes et leur contrepartie leucémique Les PDC sont à l’origine d’une forme de leucémie aiguë, appelée néoplasme dérivé des cellules dendritiques plasmocytoïdes ou BPDCN (blastic plasmacytoid dendritic cell neoplasm). Cette pathologie, classée comme un sous-type de leucémie aiguë myéloïde (LAM), est caractérisée par des infiltrats leucémiques au niveau de la peau, de la moelle osseuse, du sang et du système nerveux central. L’infiltration médullaire est responsable d’une pancytopénie4 sévère. Le pronostic de cette pathologie est très sombre [9]. Aujourd’hui, il n’existe pas de consensus sur la prise en charge des patients ; aucun protocole de chimiothérapie utilisé dans d’autres leucémies ou lymphomes ne paraît efficace. Les cellules leucémiques PDC (LPDC) sur-expriment CD123 (la chaîne α du récepteur de l’IL-3) qui est un facteur de leur survie [9]. Des approches thérapeutiques ciblant CD123 sont actuellement à l’étude [9]. D’autres visant à inhiber des voies de survie, comme celle du NF-κB (nuclear factor-kappa B), sont proposées [9] mais doivent être testées en clinique. |
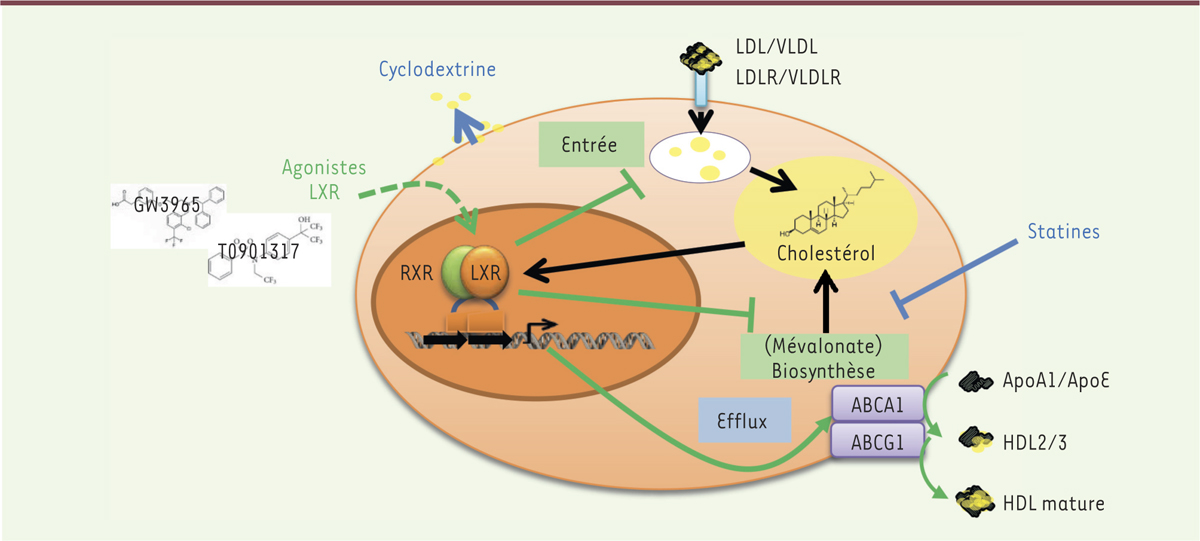
Les LXR (liver X receptors) sont des récepteurs nucléaires possédant à la fois la capacité de se lier sur des sites spécifiques de l’ADN et d’induire l’expression de gènes cibles (comme par exemple ABCA1 [ATP-binding cassette 1]) mais également celle d’interférer avec des facteurs de transcription induisant la sécrétion de cytokines inflammatoires, comme NF-κB, ou STAT5 (signal transducer and activator of transcription 5) [10]. Les agonistes naturels des LXR sont des dérivés oxydés du cholestérol, les oxystérols. L’accumulation de cholestérol intracellulaire entraîne l’augmentation du taux d’oxystérols qui, en activant les LXR, vont permettre de rétablir un équilibre par : (1) répression de la biosynthèse du cholestérol (inhibition de la voie du mévalonate) ; (2) diminution de la capture des lipoprotéines plasmatiques, via la dégradation des récepteurs des LDL (low density lipoproteins) et VLDL (very low density lipoproteins) ; et surtout (3) augmentation de l’efflux du cholestérol cellulaire par l’induction des transporteurs ABCA1 et ABCG1 (ATP-binding cassette A1/G1) (Figure 1).
 | Figure 1.
Récepteurs LXR (liver X receptors) et homéostasie du cholestérol intracellulaire. Le niveau de cholestérol intracellulaire est régulé à trois niveaux : (1) l’entrée par l’intermédiaire des récepteurs des lipoprotéines LDL ( low density lipoproteins), les LDLR, et des récepteurs des VLDL ( very low density lipoproteins), les VLDLR ; (2) la biosynthèse par la voie du mévalonate ; et (3) l’efflux du cholestérol par les transporteurs transmembranaires ABC ( ATP binding cassette), dont ABCA1 interagissant avec les apolipoprotéines A1 et E (respectivement ApoA1 et ApoE), et ABCG1 interagissant avec les pré-HDL ( high density lipoproteins) ou HDL2/3 pour produire les HDL matures. L’accumulation de cholestérol augmente la concentration de ses dérivés oxydés, les oxystérols, qui stimulent les récepteurs nucléaires LXR. Ces derniers initient alors la diminution du cholestérol intracellulaire par inhibition de la voie du mévalonate, l’inhibition de l’entrée du cholestérol, et l’augmentation de son efflux (flèches vertes). L’activation des récepteurs LXR par des agonistes synthétiques (GW3965 et T0901317, flèche verte en pointillé) aboutit aux mêmes effets (flèches vertes) et à une diminution du cholestérol cellulaire. D’autres agents peuvent appauvrir la cellule en cholestérol, comme les statines (qui inhibent la voie du mévalonate) ou la cyclodextrine qui solubilise le cholestérol des membranes cellulaires (flèches bleues). Les agents diminuant le cholestérol sont notés en bleus. RXR : retinoid X receptor (forme un dimère avec LXR). Figure modifiée et traduite de la référence [ 14]. |
Métabolisme du cholestérol et réponse inflammatoire La diminution du cholestérol intracellulaire est associée à la répression de la réponse inflammatoire dans de nombreuses cellules. Dans le macrophage, elle est associée à une inhibition des voies TLR-2 et TLR-4, suite à un blocage de NF-κB [ 11], et elle contribue à la régression des lésions d’athérosclérose dans un modèle murin. L’inhibition de la voie du mévalonate par les statines diminue la sécrétion d’IFN-I par les PDC dans le LED [ 12]. Métabolisme du cholestérol et carcinogenèse Le niveau de cholestérol intracellulaire est critique pour la survie et la prolifération de cellules malignes. Dans l’adénocarcinome canalaire pancréatique, l’internalisation des lipoprotéines circulantes enrichies en cholestérol (principalement les LDL) est accrue et son inhibition sensibilise les cellules tumorales aux chimiothérapies conventionnelles [ 13] ( →).
(→) Voir la Nouvelle de S. Vasseur et F. Guillaumond, m/s n° 8-9, août-septembre 2015, page 728
Une augmentation de l’internalisation des LDL et de la voie du mévalonate est également observée dans les leucémies aiguës lymphoïdes (LAL) et dans les LAM. Ces observations suggèrent qu’une inhibition de ces mécanismes, entraînant ainsi une baisse du taux de cholestérol, serait un moyen de potentialiser les traitements actuels. L’inhibition de la voie du mévalonate par les statines améliore en effet la survie des patients dans différents types de cancers. Bien qu’un effet similaire ait été rapporté pour les agonistes LXR dans des modèles expérimentaux, l’implication du métabolisme du cholestérol dans ces effets reste à démontrer. |
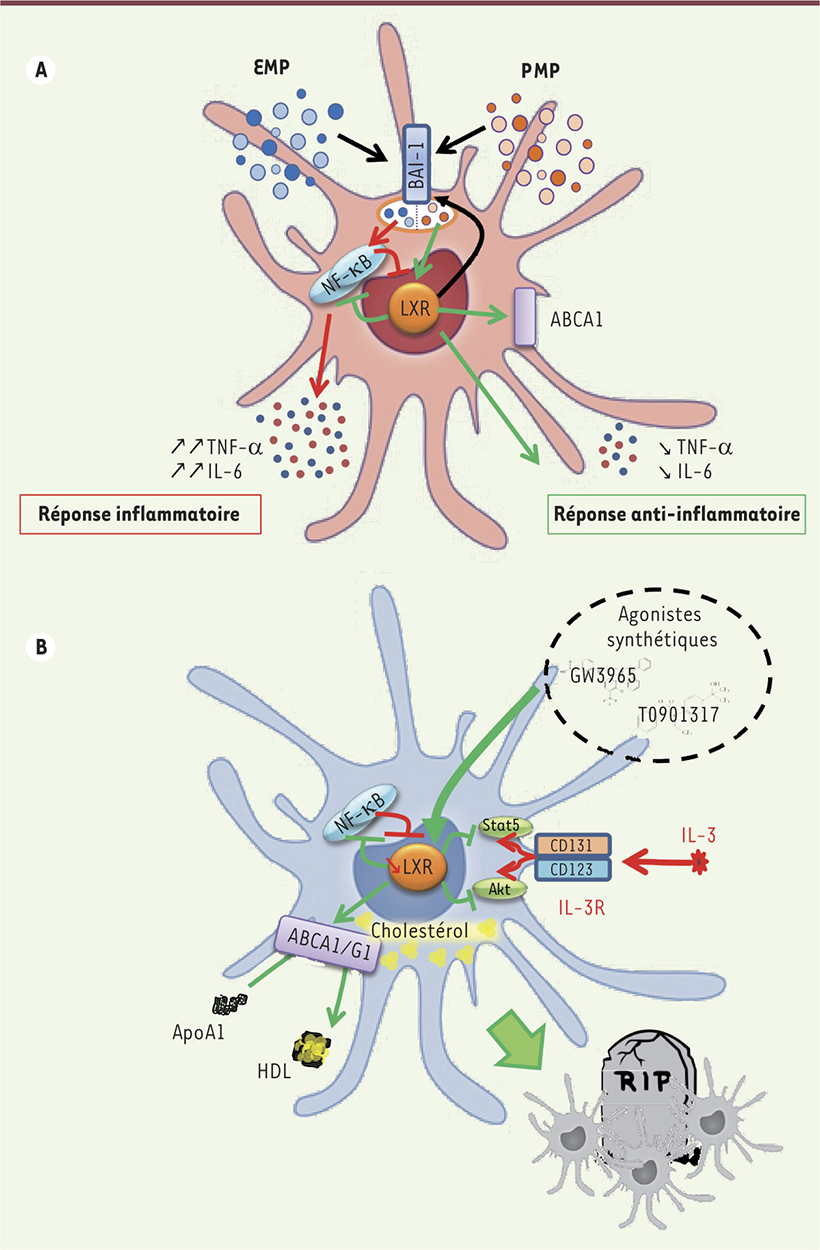
L’éLiXiR d’apaisement des PDC Les EMP stimulent la réponse inflammatoire des PDC [5, 6]. L’utilisation de l’augmentation de la clairance des EMP pour limiter leur effet apparaît donc comme une nouvelle voie thérapeutique prometteuse. Nous avons montré que la capture des MP par les PDC implique l’interaction des PtdSer présentes sur les MP avec leurs récepteurs. Cette capture est augmentée après activation de la voie LXR dans les PDC via l’augmentation du récepteur des PtdSer Bai-1. L’activation des LXR permet également d’inhiber la sécrétion de cytokines inflammatoires induites par les EMP grâce au blocage de NF-κB [6]. Par ailleurs, l’activation des LXR est critique pour le maintien de la réponse anti-inflammatoire des PDC après internalisation des PMP [6] (Figure 2A). L’effet thérapeutique de la voie LXR reste cependant à être confirmé en situations pathologiques.
 | Figure 2.
Effets de la stimulation de la voie LXR (liver X receptor) dans les cellules dendritiques plasmocytoïdes et leur dérivé leucémique. A. La voie LXR est fonctionnelle dans les cellules dendritiques plasmocytoïdes (PDC) : sa stimulation augmente l’expression du récepteur BAI-1 (brain-specific angiogenesis inhibitor 1) qui accroît l’internalisation des microparticules d’origine endothéliale (EMP) ou plaquettaire (PMP) par interaction avec les phosphatidylsérines exprimées à la surface des microparticules. L’internalisation des PMP active la voie LXR, augmentant l’expression d’ABCA1 (ATP binding cassette A1) et inhibant la voie NF-κB (nuclear factor-kappa B), aboutissant à un profil anti-inflammatoire impliquant une diminution de l’interleukine-6 (IL-6) et du TNF-α (tumor necrosis factor alpha) (flèches vertes). À l’inverse, les EMP vont activer la voie NF-κB, qui va bloquer l’activation de la voie LXR et induire la synthèse d’IL-6 et de TNF-α par les PDC (flèches rouges). La stimulation préalable de la voie LXR va inhiber cette activation de NF-κB permettant de prévenir l’effet inflammatoire des EMP. B. La voie LXR est fonctionnelle dans les cellules leucémiques PDC (LPDC), bien que l’expression des gènes cibles de LXR (ABCA1, ABCG1) soit diminuée dans ces cellules. La stimulation de LXR par des agonistes synthétiques (GW3965 ou T0901317) restaure le niveau d’expression de ces gènes et permet d’appauvrir les LPDC en cholestérol en stimulant l’efflux via les transporteurs ABCA1 et ABCG1. Cette stimulation de la voie LXR s’oppose aux signaux de survie de la LPDC que sont la voie NF-κB et celle de l’IL-3 (flèches rouges). En effet, la stimulation de la voie LXR inhibe la phosphorylation de STAT5 (signal transducer and activator of transcription 5) et Akt (protein kinase B) induite par l’IL-3 (les effets des agonistes de LXR sont représentés par les flèches vertes). Ceci aboutit à la mort par apoptose des LPDC. Le récepteur de l’IL-3 (IL-3R) associe une chaîne alpha (CD123) et la chaîne commune CD131. ApoA1 : apolipoprotéines A1 ; HDL : high density lipoproteins. |
|
L’éLiXiR de mort des cellules PDC leucémiques Dans les PDC, l’engagement de la voie NF-κB prévient l’activation des LXR [6]. La voie NF-κB est constitutivement activée dans les LPDC, contribuant à leur survie [9]. En nous appuyant sur ces deux observations, nous avons identifié, par l’analyse de la signature transcriptomique des LPDC, une perturbation récurrente de la voie LXR et du métabolisme du cholestérol, permettant de les distinguer d’autres leucémies (LAM, LAL-T [leucémie aiguë lymphoblastique à précurseurs T]). Ces données suggèrent qu’il existe (1) une altération des mécanismes d’efflux du cholestérol dans les LPDC, fondée sur la diminution d’expression des gènes ABCA1 et ABCG1, et (2) une augmentation de l’internalisation des lipoprotéines plasmatiques VLDL par les LPDC [14]. La stimulation de l’activité LXR dans les LPDC par des agonistes de synthèse augmente l’efflux du cholestérol (diminuant ainsi le cholestérol intracellulaire) et induit une diminution de la prolifération, puis l’apoptose des LPDC. Ces effets sont liés à l’inhibition de la voie NF-κB, ainsi que celle d’Akt/STAT5 qui est activée par le facteur de survie des LPDC, l’IL-3. Ces effets sont d’autant plus marqués que l’efflux du cholestérol des LPDC est accru par l’addition in vitro d’un accepteur du cholestérol, l’apolipoprotéine-A1 (ApoA1). L’effet anti-leucémique des agonistes LXR a été confirmé in vivo, dans un modèle murin de xénogreffe de cellules de BPDCN humaines, par un gain de survie associé à une prévention de la cytopénie et une diminution des infiltrats leucémiques spléniques et médullaires [14]. Enfin, nous avons confirmé que l’appauvrissement en cholestérol des LPDC (par traitement avec une statine) est critique pour l’induction de l’apoptose des cellules leucémiques in vitro. Ces résultats permettent d’envisager l’utilisation de molécules disponibles en clinique, inhibant NF-κB (bortezomib) et diminuant le cholestérol cellulaire (statine), dans l’attente de l’utilisation d’agonistes LXR. |
Conclusion et perspectives Depuis leur découverte, les LXR sont étudiés pour leur potentiel thérapeutique dans de nombreuses pathologies inflammatoires et malignes [10]. Bien que les agonistes LXR développés n’aient pas été approuvés pour leur utilisation clinique, de nouvelles molécules sont actuellement à l’étude [10]. En attendant, des molécules approuvées mimant les effets thérapeutiques des LXR et visant à promouvoir l’efflux du cholestérol (peptide mimant l’ApoA1 augmentant le taux de HDL) [15] (→) pourraient être testées. Ces résultats ouvrent la voie vers de nouvelles associations thérapeutiques encore non testées.
(→) Voir la Nouvelle de D. Masson et L. Yvan-Charvet, m/s n° 4, avril 2008, page 341
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les travaux présentés ici ont bénéficié d’une aide de l’État gérée par l’Agence Nationale de la Recherche au titre du programme « Investissements d’avenir » portant la référence ANR-11-LABX-0021-01.
|
Footnotes |
1.
Breton G. Origine et développement des cellules dendritiques humaines . Med Sci (Paris). 2015; ; 31 : :725.–727. 2.
Swiecki M, Colonna M The multifaceted biology of plasmacytoid dendritic cells . Nat Rev Immunol. 2015; ; 15 : :471.–485. 3.
Witko-Sarsat V, Perruche S. La protéinase 3: signal de danger et agent double dans les vascularites . Med Sci (Paris). 2016; ; 32 : :450.–452. 4.
Pelletier F, Garnache-Ottou F, Biichle S, et al. Effects of anti-TNF-alpha agents on circulating endothelial-derived and platelet-derived microparticles in psoriasis . Exp Dermatol. 2014; ; 23 : :924.–925. 5.
Angelot F, Seilles E, Saas P, Garnache-Ottou F. Les microparticules endothéliales : un signal d’alarme pour le système immunitaire ? Med Sci (Paris). 2010; ; 26 : :31.–33. 6.
Ceroi A, Delettre FA, Marotel C, et al. The anti-inflammatory effects of platelet-derived microparticles in human plasmacytoid dendritic cells involve liver X receptor activation . Haematologica. 2016; ; 101 : :e72.–e76. 7.
A-Gonzalez N, Bensinger SJ, Hong C, et al. Apoptotic cells promote their own clearance and immune tolerance through activation of the nuclear receptor LXR . Immunity. 2009; ; 31 : :245.–258. 8.
Lee CS, Penberthy KK, Wheeler KM, et al. Boosting apoptotic cell clearance by colonic epithelial cells attenuates inflammation in vivo . Immunity. 2016; ; 44 : :807.–820. 9.
Pagano L, Valentini CG, Grammatico S, Pulsoni A. Blastic plasmacytoid dendritic cell neoplasm: diagnostic criteria and therapeutical approaches . Br J Haematol. 2016; ; 174 : :188.–202. 10.
Hong C, Tontonoz P. Liver X receptors in lipid metabolism: opportunities for drug discovery . Nat Rev Drug Discov. 2014; ; 13 : :433.–444. 11.
Ito A, Hong C, Rong X, et al. LXRs link metabolism to inflammation through Abca1-dependent regulation of membrane composition and TLR signaling . eLife. 2015; ; 4 : :e08009.. 12.
Bu DX, Griffin G, Lichtman AH. Mechanisms for the anti-inflammatory effects of statins . Curr Opin Lipidol. 2011; ; 22 : :165.–170. 13.
Vasseur S, Guillaumond F. L’adénocarcinome pancréatique : une tumeur dépendante des lipoprotéines . Med Sci (Paris). 2015; ; 31 : :728.–730. 14.
Ceroi A, Masson D, Roggy A, et al. LXR agonist treatment of blastic plasmacytoid dendritic cell neoplasm restores cholesterol efflux and triggers apoptosis . Blood. 2016; ; 128 : :2694.–2707. 15.
Masson D, Yvan-Charvet L. L’augmentation du HDL-cholestérol : un traitement d’avenir dans le domaine de l’athérosclérose ? Med Sci (Paris). 2008; ; 24 : :341.–343. |