| |
| Med Sci (Paris). 33(3): 328–334. doi: 10.1051/medsci/20173303021.L’autophagie : le yin et le yang des cancers Carine Joffre,1,2,3* Mojgan Djavaheri-Mergny,4,5 Sophie Pattingre,6,7,8,9 and Sylvie Giuriato1,2,3,10 1Inserm, UMR1037 CRCT, Centre de recherches en cancérologie de Toulouse, 2, avenue Hubert Curien, CS 53717, F-31037Toulouse, France 2Université Toulouse III-Paul Sabatier, UMR1037 CRCT, F-31000Toulouse, France 3CNRS, ERL5294 CRCT, F-31000Toulouse, France 4Inserm U1218 ACTION, Institut Bergonié, BordeauxFrance 5Université de Bordeaux, BordeauxFrance 6IRCM, Institut de recherche en cancérologie de Montpellier, Montpellier, F-34298, France 7Inserm, U1194, Montpellier, F-34298, France 8Université de Montpellier, Montpellier, F-34090, France 9Institut régional du cancer de Montpellier, Montpellier, F-34298, France 10European Research Initiative on ALK-related malignancies (ERIA) |
Le cancer, maladie caractérisée par la prolifération anarchique de cellules anormales, est la première cause de mortalité en France devant les maladies cardiovasculaires. Même si le risque de décéder d’un cancer a diminué, l’incidence et le nombre de décès associés à cette maladie sont en augmentation. La modulation de l’autophagie apparaît, depuis déjà quelques années, comme une approche thérapeutique prometteuse dans la lutte contre le cancer [1]. L’autophagie, qui signifie littéralement « se manger soi-même », est un processus catabolique impliqué dans la dégradation du matériel cellulaire par la voie lysosomale. Ce mécanisme s’initie par la formation d’une structure multi-membranaire, le phagophore, qui englobe les constituants cellulaires (ou cargos) à dégrader avant de s’allonger pour former l’autophagosome. Le contenu cytosolique séquestré dans cette vésicule à double membrane est finalement dégradé après fusion avec le lysosome. Le déroulement de ce processus est assuré par différentes protéines, appelées ATG (autophagy-related gene) découvertes par les travaux fondateurs de l’équipe de Yoshinori Oshumi [2, 51] (→).
(→) Voir l’article Nobel de P. Codogno, m/s n° 12, décembre 2016, page 1127
La formation de l’autophagosome requiert principalement les complexes ULK1 (unc-51-like kinase 1) et PI3K class III-BECN1 (phosphoinositide 3-kinase-class III-beclin 1), ainsi que deux systèmes de conjugaison comprenant celui de ATG12 à ATG5 et celui de MAP1LC3 (ou LC3, microtubule associated protein 1 light chain 3) à la phosphatidyléthanolamine (PE). Ce dernier conjugué, appelé LC3-II, constitue un marqueur d’identification des autophagosomes. Lorsque l’autophagie est sélective, elle implique aussi des récepteurs autophagiques tels que p62/séquestosome, NBR1 (neighbour of BRCA1 [breast cancer 1]) ou OPTN (optineurin). Ils créent un lien physique entre le cargo et les protéines autophagiques ancrées dans la membrane autophagosomale, telle que la protéine LC3-II, et permettent ainsi l’adressage sélectif des cargos à dégrader vers l’autophagosome [3]. Ainsi, si l’autophagie constitue une réponse adaptative mise en place par la cellule en réponse aux stress environnementaux (comme la carence) ou intracellulaires, elle assure également un contrôle qualité du cytoplasme en dégradant sélectivement les organites endommagés et les protéines en quantités excessives. L’importance de l’autophagie dans l’oncogenèse a largement été documentée, mais son rôle précis dans l’initiation et la progression tumorale, dans l’apparition de métastases, ou dans les phénomènes de résistance aux chimiothérapies reste sujet à controverse et dépend du contexte cellulaire. En effet, en réponse à divers traitements, l’autophagie a été impliquée dans la résistance ou, au contraire, dans l’induction de la mort cellulaire. L’autophagie est donc à la fois le yin et le yang des cancers [4]. Dans cette revue, nous présenterons l’essentiel des connaissances actuelles sur le rôle de l’autophagie dans l’initiation et la progression tumorales (Figure 1), puis dans la réponse aux thérapies anti-cancéreuses (Figure 2).
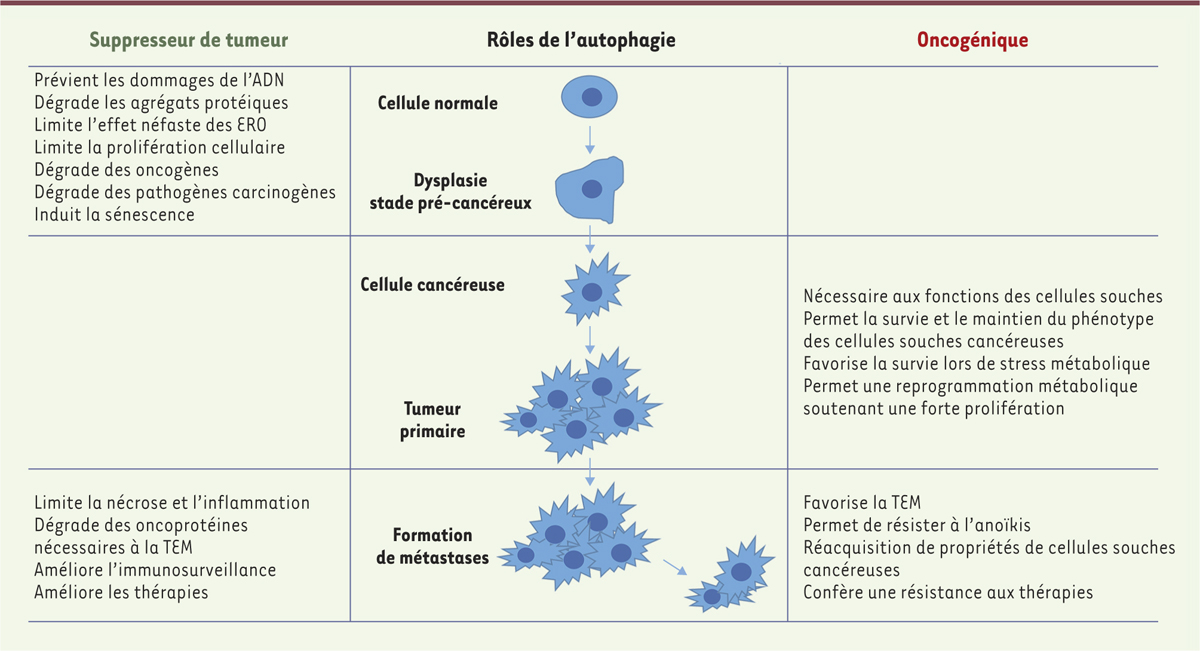
 | Figure 1.
Rôles de l’autophagie dans la progression tumorale : de la cellule normale à la formation des métastases. Les étapes clés de la progression tumorale, d’une cellule normale à une cellule métastatique, sont schématisées dans la partie centrale. Les mécanismes par lesquels l’autophagie joue un rôle oncosuppresseur ou oncogénique sont détaillés respectivement sur les parties gauche et droite. ERO : espèces réactives de l’oxygène ; TEM : transition épithélio-mésenchymateuse. |
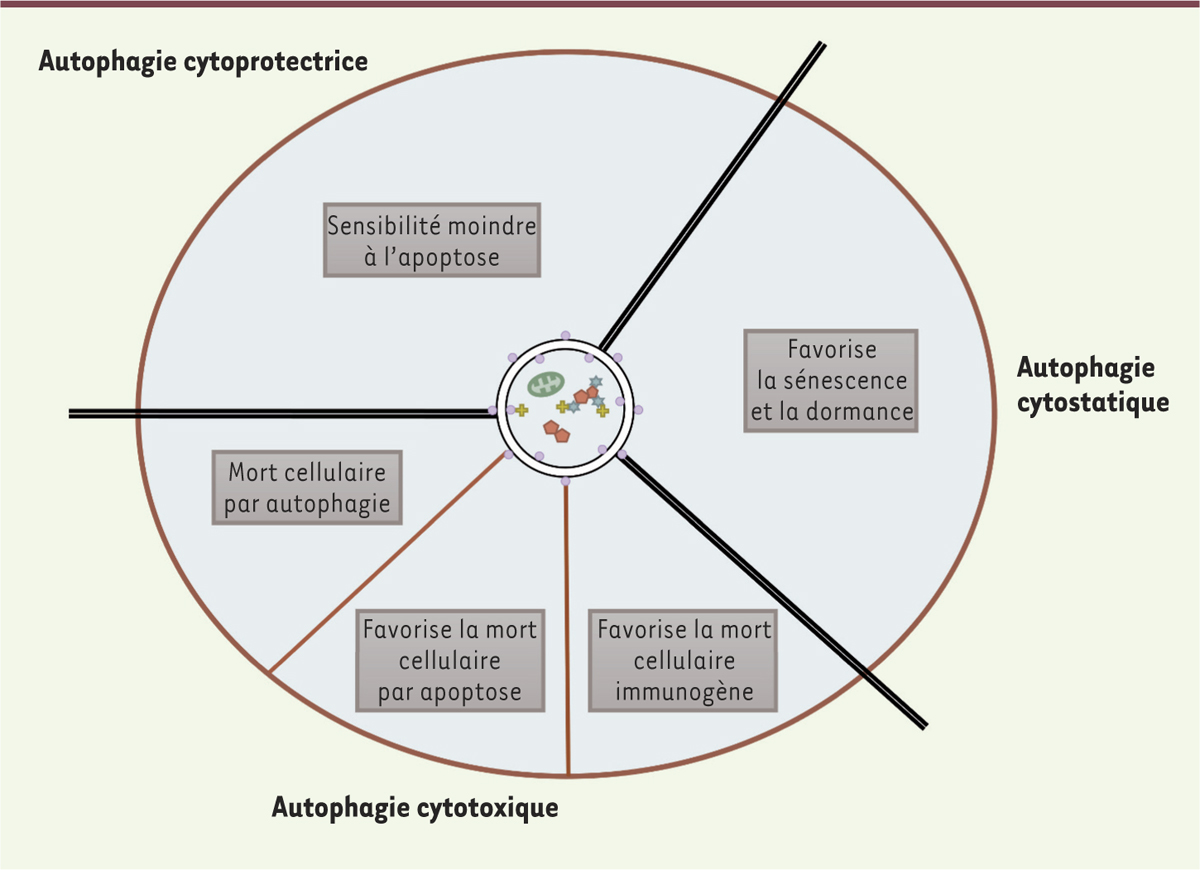
 | Figure 2.
Fonctions multiples de l’autophagie en réponse aux thérapies anti-cancéreuses. Trois fonctions essentielles de l’autophagie ont été décrites. Elles dépendent du contexte tumoral et des traitements administrés. Les mécanismes cellulaires qui sous-tendent ces fonctions sont indiqués. |
|
Autophagie et initiation tumorale Rôle oncosuppresseur de l’autophagie L’équipe de B. Levine a découvert, en 1999, le premier lien direct entre autophagie et initiation tumorale en identifiant le rôle suppresseur de tumeur de BECN1, un gène codant une protéine clé de l’autophagie, Beclin-1 [ 5]. Plusieurs types de cancers chez l’homme présentent en effet des délétions mono-alléliques de BECN1, ou de UVRAG ( ultraviolet irradiation resistance-associated gene), un gène dont le produit active la fonction autophagique de Beclin-1. L’invalidation de ces gènes chez la souris conduit au développement de tumeurs dans divers tissus [ 6]. Plusieurs études ont ensuite confirmé ce rôle oncosupresseur de l’autophagie. La susceptibilité à former des fibrosarcomes induits par des agents chimiques est par exemple augmentée chez des souris invalidées pour le gène Atg4c [ 7]. Des souris présentant une délétion mosaïque du gène Atg5 ou une délétion du gène Atg7 spécifiquement dans le foie développent des adénomes hépatiques, associés à l’accumulation de mitochondries endommagées, d’espèces réactives de l’oxygène (ERO, ou ROS en anglais) et de dommages à l’ADN [ 8]. Enfin, l’invalidation des gènes Atg7 ou Ulk1 dans les cellules souches hématopoïétiques induit la prolifération des cellules myéloïdes et la mort des souris par un syndrome myélodysplasique [ 9]. Mécanismes impliqués dans le rôle oncosuppresseur de l’autophagie Prévention des dommages de l’ADN, de l’inflammation et défense contre les pathogènes carcinogènes Le stress métabolique induit l’accumulation de mitochondries endommagées qui sont à l’origine d’une production excessive d’ERO, elle-même responsable de l’accumulation de dommages à l’ADN impliqués dans le développement tumoral [ 10]. En dégradant les mitochondries endommagées, l’autophagie protège donc de la transformation cellulaire en limitant les dommages à l’ADN. Les ERO induisent également un processus inflammatoire en déclenchant la sécrétion de médiateurs qui favorisent la progression tumorale. L’autophagie prévient cette inflammation, non seulement en dégradant les mitochondries endommagées, mais également des protéines spécifiques impliquées dans les réponses inflammatoires [ 10]. De plus, inhiber l’autophagie augmente la susceptibilité des cellules à être infectées par des pathogènes connus pour favoriser la transformation maligne, suggérant un rôle de défense cellulaire contre les virus et les bactéries carcinogènes [ 11]. Dégradation sélective de la protéine proto-oncogénique p62 L’autophagie empêche également l’oncogenèse en limitant l’accumulation excessive de p62, un récepteur autophagique impliqué dans l’autophagie sélective. Son accumulation, notamment observée dans les cellules déficientes en autophagie, engendre en effet des réponses oncogéniques causées par l’activation de mTOR ( mammalian target of rapamycin) et de facteurs de transcription tels que NF-κB ( nuclear factor kappa B) et NFE2L2/NRF2 ( nuclear factor, erythroid 2-like 2) [ 12]. Des mutations du gène de p62/SQSTM1 (sequestosome 1) ont par ailleurs été observées dans différents cancers chez l’homme [ 12]. Induction de la sénescence La sénescence induite par des oncogènes, ou OIS ( oncogene-induced senescence), qui consiste en un arrêt irréversible du cycle cellulaire, constitue un mécanisme anti-tumoral. L’entrée en sénescence induite par l’oncogène H-RAS stimule l’autophagie, et l’inhibition de l’autophagie par l’invalidation spécifique de gènes ATG freine l’établissement du phénotype sénescent et la sécrétion des protéines associées à ce processus [ 13]. Frein à la prolifération cellulaire Des expériences réalisées sur des souris haplo-insuffisantes pour Becn1 ont initialement révélé un rôle inhibiteur de l’autophagie sur la prolifération cellulaire [ 14]. L’autophagie a également été décrite comme une barrière à la prolifération des cellules cancéreuses en intervenant dans la dégradation de protéines clés de la division cellulaire telles que la lamine B1 [ 15]. Ces différents exemples illustrent qu’une déficience du processus d’autophagie peut conduire à une accélération de l’initiation de la tumorigenèse. Il a cependant été également documenté qu’un défaut d’autophagie peut parfois déclencher un processus de protection anti-tumoral. Cela a été observé par exemple dans les cellules épithéliales intestinales et dans un modèle murin de cancer du pancréas dans lequel la déficience en autophagie prévient respectivement l’initiation tumorale [16] (→) et le développement d’adénocarcinomes [17, 52] (→).
(→) Voir la Nouvelle de J. Lévy et B. Romagnolo, m/s n° 4, avril 2016, page 339
(→) Voir la Synthèse de J.L. Iovanna, page 335 de ce numéro
|
Autophagie et progression tumorale Rôle de l’autophagie dans le métabolisme D’importants senseurs nutritionnels et énergétiques, comme les protéines mTOR et AMPK ( adenosine monophosphate-activated protein kinase), sont au centre de la régulation de l’autophagie [ 18]. Tout comme dans les cellules normales, l’autophagie permet la survie des cellules cancéreuses soumises à un stress métabolique. Il a ainsi été montré, dans une étude princeps, que l’autophagie était stimulée au centre de la tumeur dans des zones subissant un important stress métabolique, et ce avant que l’angiogenèse ne se mette en place [ 19]. Suite à la transformation cellulaire par des oncogènes ou à la perte d’expression ou de fonction de suppresseurs de tumeurs, des modifications métaboliques appelées « effet Warburg » se produisent dans les cellules cancéreuses, conduisant à une augmentation de la glycolyse aérobie au détriment de la respiration mitochondriale. L’autophagie, alors stimulée, est indispensable à la transformation cellulaire et à cette reprogrammation métabolique caractéristique des cellules cancéreuses [20]. Certaines tumeurs à fort pouvoir prolifératif, comme celles induites par les oncogènes RAS et B-RAF, sont ainsi considérées comme « addictes » à l’autophagie. Les hauts niveaux d’autophagie observés dans ces tumeurs permettent en effet le maintien d’un niveau métabolique élevé, requis pour maintenir la prolifération importante de ces cellules. L’induction d’autophagie dans les CAF (cancer associated fibroblasts), des cellules du microenvironnement tumoral, produit l’énergie indispensable à la croissance des cellules cancéreuses adjacentes. Dans ce modèle, les cellules cancéreuses secrètent du peroxyde d’hydrogène qui déclenche un stress oxydatif dans les CAF, induisant l’autophagie et la production de composés à haut pouvoir énergétique tels que les cétones ou le lactate [21]. Cette fonction de l’autophagie a été baptisée « effet Warburg inverse ». Rôle de l’autophagie dans la dissémination métastatique La formation des métastases repose sur plusieurs étapes incluant la dégradation de la matrice extracellulaire, la transition épithélio-mésenchymateuse (ou TEM), le détachement de la cellule tumorale de la tumeur primaire et, enfin, son installation dans un autre site tissulaire après une transition mésenchymato-épithéliale (ou TME). Le rôle décrit de l’autophagie dans la dissémination métastatique est complexe et ambivalent. Rôle pro-métastatique Certaines études suggèrent que l’autophagie favoriserait l’invasion et la migration des cellules tumorales en permettant la TEM, notamment dans les cholangiocarcinomes (tumeur épithéliale des voies biliaires) et le cancer du poumon [ 22, 23], et qu’elle constituerait, dans ce contexte, un marqueur de mauvais pronostic. Il a également été proposé qu’après la TEM, l’autophagie protège les cellules cancéreuses métastatiques de l’anoïkis, un processus de mort cellulaire induit par le détachement des cellules de leur support matriciel. Inhiber l’autophagie par l’extinction de Beclin-1 ou ATG5 réduit ainsi les métastases pulmonaires dans le cas de carcinomes hépatocellulaires [24]. En accord avec ces travaux, une étude par localisation immunohistochimique de la protéine MAP1LC3, réalisée sur des échantillons cliniques et dans un modèle murin de métastases pulmonaires [25], montre que l’autophagie est plus élevée dans les métastases que dans la tumeur primaire. Rôle anti-métastatique L’autophagie pourrait, à l’inverse, empêcher l’apparition de métastases en dégradant l’inflammasome et les mitochondries endommagées, conduisant ainsi à une diminution de la nécrose et de l’inflammation [ 26]. Elle a aussi été impliquée dans la dégradation de SNAIL et SLUG, deux acteurs essentiels de la TEM, conduisant à l’inhibition de l’invasion dans les glioblastomes et dans un modèle murin de cancer hépatique [ 27]. Enfin, dans les cancers gastriques, l’autophagie empêche le processus d’invasion en inhibant la TEM par un mécanisme dépendant de la voie ROS-NF-κB-HIF-1α ( hypoxia-inducible factor 1-alpha) [ 28]. Rôle de l’autophagie dans le phénotype « cellules souches cancéreuses » Les cellules cancéreuses en cours de dissémination qui ne trouvent pas de site d’attachement peuvent entrer en dormance, un mécanisme permettant à la cellule tumorale de survivre parfois pendant des années. Ces cellules dormantes qui détournent l’autophagie à leur avantage sont appelées cellules souches cancéreuses. L’induction de l’autophagie par la protéine ARH1 ( ras homolog member 1) augmente en effet la dormance des cellules in vivo [ 29]. Dans un modèle murin d’adénocarcinome pancréatique, si l’inhibition de l’expression du mutant oncogénique KRAS(G12D) aboutit à la régression de la tumeur, elle s’accompagne de la survie d’une sous-population de cellules tumorales entrées en dormance de façon dépendante de l’autophagie, ce qui favorisera ultérieurement la résurgence de la tumeur [ 30]. Les cellules souches cancéreuses ont des niveaux d’autophagie plus élevés que les cellules cancéreuses « non-souches » [31, 32]. L’inhibition pharmacologique ou génétique (extinction de l’expression d’un gène ATG) de l’autophagie empêche ainsi le maintien d’un phénotype « cellule souche cancéreuse » [32]. |
Autophagie et thérapies anti-cancéreuses De très nombreux travaux rapportent l’induction d’un processus d’autophagie en réponse à diverses thérapies anti-cancéreuses. Cette autophagie peut revêtir essentiellement trois fonctions différentes qualifiées de « cytoprotectrice », de « cytostatique » ou de « cytotoxique » pour la cellule tumorale (Figure 2) [33]. Autophagie cytoprotectrice Lorsqu’un traitement induit l’autophagie et que son inhibition rend la thérapie plus efficace, on parle d’autophagie cytoprotectrice. Cette fonction de l’autophagie a été très largement décrite en réponse à des chimiothérapies, des radiothérapies, ou à des traitements ciblés. C’est le cas, par exemple, en réponse au traitement des cellules de leucémie myéloïde chronique exprimant la protéine de fusion BCR-ABL 1 par l’Imatinib, une molécule inhibitrice de tyrosine kinases [ 34], ou dans celui d’un traitement par le Crizotinib, utilisé pour inhiber l’oncogène NPM-ALK (résultant de la fusion entre les gènes codant pour la nucléophosmine et pour ALK [ anaplastic lymphoma kinase]) dans les lymphomes anaplasiques à grandes cellules [ 35]. Ces deux molécules induisent un flux autophagique cytoprotecteur dont l’inhibition potentialise l’apoptose induite par le traitement. L’autophagie peut réduire la sensibilité des cellules tumorales à l’apoptose via, entre autres, la dégradation sélective de médiateurs du processus apoptotique (comme les mitochondries et les protéines pro-apoptotiques) et la reprogrammation métabolique. Autophagie cytostatique Lorsqu’un traitement anti-cancéreux inhibe la prolifération et induit une autophagie qui augmente la sensibilité au traitement, sans impacter la mort ou la survie des cellules tumorales, on parle d’une autophagie cytostatique. Ce type d’autophagie a été mis en évidence dans des cancers du poumon et du sein, traités respectivement par une combinaison de radiothérapie et de vitamine D [ 33] et par l’Ivermectin, un anti-parasitaire qui cible la voie de signalisation WNT [ 36]. Cette fonction cytostatique de l’autophagie a aussi été associée à la sénescence, à la dormance, et à la récurrence tumorale après thérapie [ 37] (Figure 2). Ces données sont en adéquation avec le constat que les cellules tumorales souches, ou résistantes aux traitements, présentent très souvent un niveau d’autophagie plus élevé que les tumeurs sensibles. L’inhibition de l’autophagie induite par les traitements, dans les cellules souches cancéreuses, pourrait ainsi empêcher la résistance et la résurgence tumorale. Autophagie cytotoxique Lorsqu’un traitement anti-cancéreux induit l’autophagie mais promeut la mort des cellules tumorales, et que l’inhibition de cette autophagie réduit l’efficacité thérapeutique, il s’agit d’une autophagie cytotoxique, qui repose essentiellement sur trois mécanismes (Figure 2). La mort par autophagie, aussi appelée mort cellulaire de type II Trois critères la définissent [ 38] : (1) elle est indépendante de l’apoptose, (2) elle s’accompagne d’une augmentation du flux autophagique, et (3) l’inhibition de l’autophagie permet sa prévention. De nombreuses études décrivent cette mort cellulaire par autophagie en réponse aux traitements chimio-thérapeutiques. Stimuler l’autophagie peut ainsi améliorer l’efficacité de certaines thérapies ciblées [ 1]. Récemment, l’oncovirothérapie, qui peut impliquer, entre autre, la mort par autophagie des cellules tumorales infectées par un virus oncolytique, a été proposée comme une stratégie thérapeutique anti-cancéreuse prometteuse [ 39]. L’autophagie, acteur de la mort cellulaire par apoptose Plusieurs études permettent d’étayer le rôle de l’autophagie comme acteur de la mort cellulaire par apoptose. Les membranes des autophagosomes représentent un support permettant l’assemblage de complexes de signalisation qui sont nécessaires à la mort par apoptose [ 40]. L’autophagie est d’autre part impliquée dans la dégradation sélective de régulateurs négatifs de l’apoptose [ 41]. Enfin, activée de façon concomitante à l’apoptose, l’autophagie participe à la mort cellulaire dans des cellules de sarcome d’Ewing 2, traitées par le 2-méthoxyestradiol, un inhibiteur de l’assemblage des microtubules [ 42]. L’activation de la mort immunogène L’autophagie peut également augmenter l’efficacité anti-tumorale de certains traitements en activant la mort immunogène 3. La suppression de l’autophagie inhibe l’émission des signaux de danger impliqués dans ce type de mort (libération d’ATP et exposition de calréticuline à la surface des cellules) par les cellules tumorales mourantes [ 43]. L’induction de l’autophagie permet également le recrutement des lymphocytes T cytotoxiques et l’inhibition de cellules T régulatrices au niveau de la tumeur, augmentant la lyse des cellules tumorales [ 44]. Cependant, d’autres études indiquent qu’en activant l’autophagie, les cellules cancéreuses peuvent résister à la réponse immune anti-tumorale [ 45]. Notons que dans cette interrelation entre autophagie et « mort cellulaire immunogène », la vaccination thérapeutique à base d’autophagosomes, utilisés in vitro comme « transporteurs » d’antigènes tumoraux et de molécules immuno-stimulatrices permettant la présentation antigénique croisée par les cellules dendritiques, semble constituer une approche prometteuse pour stimuler l’immunité T anti-tumorale chez le patient [ 46]. La dégradation d’oncogènes L’autophagie permet la régression de tumeurs en dégradant des oncogènes de fusion nécessaires à la survie des cellules tumorales. C’est le cas de PML/RARα 4 [ 47], et de BCR-ABL qui sont exprimés respectivement dans les leucémies aiguës promyélocytaires et les leucémies myéloïdes chroniques, après traitement au trioxyde arsenic [ 48]. |
L’autophagie joue un rôle majeur dans le processus oncogénique et revêt des propriétés pro- ou anti-tumorales en fonction du type de cancer, du stade de développement, ainsi que des mutations associées à la maladie. Selon le contexte, inhiber ou stimuler l’autophagie pourrait donc constituer une approche thérapeutique d’intérêt. Venant complexifier ce tableau, il s’avère que, selon la nature des traitements, les cellules tumorales sont capables de basculer d’une fonction de l’autophagie à une autre (par exemple de cytoprotectrice vers cytostatique), opérant ainsi un « switch autophagique » [33]. Les cellules tumorales sont capables également d’activer d’autres formes d’autophagie, telle que la CMA (chaperone-mediated autophagy) [49]. Il apparaît donc essentiel de suivre dans le temps et de caractériser la fonction et le type d’autophagie induite par un traitement afin d’utiliser à bon escient des inhibiteurs ou des activateurs du processus. L’autophagie étant nécessaire au bon fonctionnement des cellules et des tissus sains, il est important de mesurer l’impact de sa modulation sur la tumeur, mais aussi sur l’organisme. Chez la souris, inhiber l’autophagie réduit le développement de tumeurs du poumon préexistantes, avant l’apparition d’un effet qui soit détectable sur les cellules et tissus sains, confortant l’idée qu’inhiber l’autophagie pourrait constituer une option thérapeutique crédible [4]. Cette modulation thérapeutique de l’autophagie exige donc une connaissance approfondie des mécanismes moléculaires contrôlant ce processus, afin de permettre le développement d’essais cliniques pertinents et la mise en évidence de nouvelles molécules spécifiques. Plus d’une cinquantaine d’essais cliniques sont déjà en cours [50]. Certains d’entre eux permettront d’établir si des protéines de l’autophagie (comme MAP1LC3, Beclin-1, p62/SQSTM1) pourraient servir de marqueurs pronostiques. À l’heure actuelle, le seul inhibiteur de l’autophagie utilisable en clinique est la chloroquine, utilisée contre le paludisme. Ce médicament n’est malheureusement pas spécifique du processus. De plus, même si cette molécule ne présente que très peu de toxicité en association avec les autres traitements anti-cancéreux, sa capacité à moduler l’autophagie au sein de la tumeur reste faible, ce qui explique probablement en grande partie les résultats décevants obtenus sur la survie globale des patients. La mise au point d’inhibiteurs spécifiques de l’autophagie, ayant une meilleure biodisponibilité, représente donc un enjeu de taille pour l’industrie pharmaceutique. Plusieurs de ces inhibiteurs qui, contrairement à la chloroquine, ciblent préférentiellement les étapes précoces de la formation des autophagosomes, sont en essais précliniques et ouvrent déjà de nouvelles perspectives. Une étude récente illustre d’autre part l’effet bénéfique de l’association de chimiothérapies avec des inducteurs de l’autophagie dans certains contextes. L’induction de l’autophagie par des molécules mimant une restriction calorique augmente, par exemple, l’efficacité des chimiothérapies en améliorant l’immunosurveillance anti-cancéreuse [44]. L’utilisation d’inducteurs de l’autophagie ouvre la voie au développement de nouveaux médicaments et à la mise en place de nouvelles perspectives de combinaisons thérapeutiques. L’autophagie représente donc un levier majeur sur lequel s’appuyer pour lutter contre le cancer. Les traitements ne peuvent toutefois pas être stéréotypés. Ils devront être finement adaptés dans le cadre d’une médecine personnalisée. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les auteurs remercient le Dr Patrice Codogno (Hôpital Necker Enfants Malades, Paris, France), le Dr Stéphane Manenti et le Dr Julie Frentzel (CRCT, Toulouse, France) pour leur relecture du manuscrit. Ce travail a été soutenu financièrement par l’Inserm, la Fondation ARC pour la recherche sur le cancer ainsi que des fonds de l’Union Européenne Horizon 2020, programme d’innovation Marie Skłodowska-Curie n° 675712 (SG), le Conseil Régional d’Aquitaine, INCa-DGOS-Inserm 6046 (MDM), le cancéropole GSO et la Ligue nationale contre le cancer (CJ).
|
Footnotes |
1.
Rebecca VW, Amaravadi RK. Emerging strategies to effectively target autophagy in cancer . Oncogene. 2016; ; 35 : :1.–11. 2.
Mizushima N, Yoshimori T, Ohsumi Y. The role of Atg proteins in autophagosome formation . Annu Rev Cell Dev Biol. 2011; ; 27 : :107.–132. 3.
Komatsu M, Ichimura Y. Selective autophagy regulates various cellular functions . Genes Cells. 2010; ; 15 : :923.–933. 4.
White E. The role for autophagy in cancer . J Clin Invest. 2015; ; 125 : :42.–46. 5.
Liang XH, Jackson S, Seaman M, et al. Induction of autophagy and inhibition of tumorigenesis by beclin 1 . Nature. 1999; ; 402 : :672.–676. 6.
Yue Z, Jin S, Yang C, et al. Beclin 1, an autophagy gene essential for early embryonic development, is a haploinsufficient tumor suppressor . Proc Natl Acad Sci USA. 2003; ; 100 : :15077.–15082. 7.
Marino G, Salvador-Montoliu N, Fueyo A, et al. Tissue-specific autophagy alterations and increased tumorigenesis in mice deficient in Atg4C/autophagin-3 . J Biol Chem. 2007; ; 282 : :18573.–18583. 8.
Takamura A, Komatsu M, Hara T, et al. Autophagy-deficient mice develop multiple liver tumors . Genes Dev. 2011; ; 25 : :795.–800. 9.
Mortensen M, Soilleux EJ, Djordjevic G, et al. The autophagy protein Atg7 is essential for hematopoietic stem cell maintenance . J Exp Med. 2011; ; 208 : :455.–467. 10.
Green DR, Galluzzi L, Kroemer G. Mitochondria and the autophagy-inflammation-cell death axis in organismal aging . Science. 2011; ; 333 : :1109.–1112. 11.
Levine B, Mizushima N, Virgin HW. Autophagy in immunity and inflammation . Nature. 2011; ; 469 : :323.–335. 12.
Puissant A, Fenouille N, Auberger P. When autophagy meets cancer through p62/SQSTM1 . Am J Cancer Res. 2012; ; 2 : :397.–413. 13.
Gewirtz DA. Autophagy and senescence in cancer therapy . J Cell Physiol. 2014; ; 229 : :6.–9. 14.
Qu X, Yu J, Bhagat G, et al. Promotion of tumorigenesis by heterozygous disruption of the beclin 1 autophagy gene . J Clin Invest. 2003; ; 112 : :1809.–1820. 15.
Ivanov A, Pawlikowski J, Manoharan I, et al. Lysosome-mediated processing of chromatin in senescence . J Cell Biol. 2013; ; 202 : :129.–143. 16.
Lévy J, Romagnolo B. Rôles antitumoraux de l’inhibition de l’autophagie dans le cancer colorectal . Med Sci (Paris). 2016; ; 32 : :339.–342. 17.
Lévy J, Cacheux W, Bara MA, et al. Intestinal inhibition of Atg7 prevents tumour initiation through a microbiome-influenced immune response and suppresses tumour growth . Nat Cell Biol. 2015; ; 17 : :1062.–1073. 18.
Lorin S, Hamaï A, Mehrpour M, et al. Autophagy regulation and its role in cancer . Semin Cancer Biol. 2013; ; 23 : :361.–379. 19.
Degenhardt K, Mathew R, Beaudoin B, et al. Autophagy promotes tumor cell survival and restricts necrosis, inflammation, and tumorigenesis . Cancer Cell. 2006; ; 10 : :51.–64. 20.
Guo JY, Chen HY, Mathew R, et al. Activated Ras requires autophagy to maintain oxidative metabolism and tumorigenesis . Genes Dev. 2011; ; 25 : :460.–470. 21.
Pavlides S, Vera I, Gandara R, et al. Warburg meets autophagy: cancer-associated fibroblasts accelerate tumor growth and metastasis via oxidative stress, mitophagy, and aerobic glycolysis . Antioxid Redox Signal. 2012; ; 16 : :1264.–1284. 22.
Nitta T, Sato Y, Ren XS, et al. Autophagy may promote carcinoma cell invasion and correlate with poor prognosis in cholangiocarcinoma . Int J Clin Exp Pathol. 2014; ; 7 : :4913.–4921. 23.
Kim YH, Baek SH, Kim EK, et al. Uncoordinated 51-like kinase 2 signaling pathway regulates epithelial-mesenchymal transition in A549 lung cancer cells . FEBS Lett. 2016; ; 590 : :1365.–1374. 24.
Peng YF, Shi YH, Ding ZB, et al. Autophagy inhibition suppresses pulmonary metastasis of HCC in mice via impairing anoikis resistance and colonization of HCC cells . Autophagy. 2013; ; 9 : :2056.–2068. 25.
Peng YF, Shi YH, Shen YH, et al. Promoting colonization in metastatic HCC cells by modulation of autophagy . PLoS One. 2013; ; 8 : :e74407.. 26.
Zitvogel L, Kepp O, Galluzzi L, et al. Inflammasomes in carcinogenesis and anticancer immune responses . Nat Immunol. 2012; ; 13 : :343.–351. 27.
Grassi G, Di Caprio G, Santangelo L, et al. Autophagy regulates hepatocyte identity and epithelial-to-mesenchymal and mesenchymal-to-epithelial transitions promoting Snail degradation . Cell Death Dis. 2015; ; 6 : :e1880.. 28.
Qin W, Li C, Zheng W, et al. Inhibition of autophagy promotes metastasis and glycolysis by inducing ROS in gastric cancer cells . Oncotarget. 2015; ; 6 : :39839.–39854. 29.
Washington MN, Suh G, Orozco AF, et al. ARHI (DIRAS3)-mediated autophagy-associated cell death enhances chemosensitivity to cisplatin in ovarian cancer cell lines and xenografts . Cell Death Dis. 2015; ; 6 : :e1836.. 30.
Viale A, Pettazzoni P, Lyssiotis CA, et al. Oncogene ablation-resistant pancreatic cancer cells depend on mitochondrial function . Nature. 2014; ; 514 : :628.–632. 31.
Gong C, Bauvy C, Tonelli G, et al. Beclin 1 and autophagy are required for the tumorigenicity of breast cancer stem-like/progenitor cells . Oncogene. 2013; ; 32 : :2261.–2272. 32.
Wolf J, Dewi DL, Fredebohm J, et al. A mammosphere formation RNAi screen reveals that ATG4A promotes a breast cancer stem-like phenotype . Breast Cancer Res. 2013; ; 15 : :R109.. 33.
Gewirtz DA. An autophagic switch in the response of tumor cells to radiation and chemotherapy . Biochem Pharmacol. 2014; ; 90 : :208.–211. 34.
Bellodi C, Lidonnici MR, Hamilton A, et al. Targeting autophagy potentiates tyrosine kinase inhibitor-induced cell death in Philadelphia chromosome-positive cells, including primary CML stem cells . J Clin Invest. 2009; ; 119 : :1109.–1123. 35.
Mitou G, Frentzel J, Desquesnes A, et al. Targeting autophagy enhances the anti-tumoral action of crizotinib in ALK-positive anaplastic large cell lymphoma . Oncotarget. 2015; ; 6 : :30149.–30164. 36.
Wang K, Gao W, Dou Q, et al. Ivermectin induces PAK1-mediated cytostatic autophagy in breast cancer . Autophagy. 2016; ; 12 : :2498.–2499. 37.
Gewirtz DA. Autophagy, senescence and tumor dormancy in cancer therapy . Autophagy. 2009; ; 5 : :1232.–1234. 38.
Shen HM, Codogno P. Autophagic cell death: Loch Ness monster or endangered species? Autophagy. 2011; ; 7 : :457.–465. 39.
Meng S, Xu J, Wu Y, et al. Targeting autophagy to enhance oncolytic virus-based cancer therapy . Expert Opin Biol Ther. 2013; ; 13 : :863.–873. 40.
Young MM, Takahashi Y, Khan O, et al. Autophagosomal membrane serves as platform for intracellular death-inducing signaling complex (iDISC)-mediated caspase-8 activation and apoptosis . J Biol Chem. 2012; ; 287 : :12455.–12468. 41.
Gump JM, Staskiewicz L, Morgan MJ, et al. Autophagy variation within a cell population determines cell fate through selective degradation of Fap-1 . Nat Cell Biol. 2014; ; 16 : :47.–54. 42.
Lorin S, Borges A, Ribeiro Dos Santos L, et al. c-Jun NH2-terminal kinase activation is essential for DRAM-dependent induction of autophagy and apoptosis in 2-methoxyestradiol-treated Ewing sarcoma cells . Cancer Res. 2009; ; 69 : :6924.–6931. 43.
Michaud M, Martins I, Sukkurwala AQ, et al. Autophagy-dependent anticancer immune responses induced by chemotherapeutic agents in mice . Science. 2011; ; 334 : :1573.–1577. 44.
Pietrocola F, Pol J, Vacchelli E, et al. Caloric restriction mimetics enhance anticancer immunosurveillance . Cancer Cell. 2016; ; 30 : :147.–160. 45.
Janji B, Viry E, Moussay E, et al. The multifaceted role of autophagy in tumor evasion from immune surveillance . Oncotarget. 2016; ; 7 : :17591.–17607. 46.
Page DB, Hulett TW, Hilton TL, et al. Glimpse into the future: harnessing autophagy to promote anti-tumor immunity with the DRibbles vaccine . J Immunother Cancer. 2016; ; 4 : :1.–5. 47.
Isakson P, Bjoras M, Boe SO, et al. Autophagy contributes to therapy-induced degradation of the PML/RARA oncoprotein . Blood. 2010; ; 116 : :2324.–2331. 48.
Goussetis DJ, Gounaris E, Wu EJ, et al. Autophagic degradation of the BCR-ABL oncoprotein and generation of antileukemic responses by arsenic trioxide . Blood. 2012; ; 120 : :3555.–3562. 49.
Kon M, Kiffin R, Koga H, et al. Chaperone-mediated autophagy is required for tumor growth . Sci Transl Med. 2011; ; 3 : :1.. 50.
Jiang P, Mizushima N. Autophagy and human diseases . Cell Res. 2014; ; 24 : :69.–79. 51.
Codogno P. L’auto-digestion est invitée à la table de l’Institut Karolinska. Prix Nobel de Médecine 2016 Yoshinori Ohsumi . Med Sci (Paris). 2016; ; 32 : :1127.–1129. 52.
Iovanna JL. L’autophagie contribue à l’initiation du cancer pancréatique . Med Sci (Paris). 2017; ; 33 : :335.–339. |