| |
| Med Sci (Paris). 33(3): 290–296. doi: 10.1051/medsci/20173303016.L’autophagie, l’homéostasie intestinale et ses pathologies Coralie Trentesaux,1,2,3 Marie Fraudeau,1,2,3 and Béatrice Romagnolo1,2,3* 1Inserm, U1016, Institut Cochin, département développement, reproduction et cancer, équipe oncogenèse des épithéliums digestifs, 24, rue du faubourg Saint-Jacques, 75014Paris, France 2Cnrs, UMR8104, Paris, France 3Université Paris Descartes, Sorbonne Paris Cité, France |
L’épithélium intestinal dont la fonction principale est d’assurer la digestion et l’absorption des nutriments doit se préserver contre les diverses menaces infectieuses et non infectieuses liées à l’ingestion. Différents stratagèmes lui permettent de se protéger et d’assurer son homéostasie. Le processus, incessant, d’autorenouvellement de son intégrité permet d’éviter l’accumulation de stress et de mutations [1]. L’épithélium assure également une fonction de barrière physique et chimique essentielle pour lutter contre les agressions de l’environnement. Les cellules épithéliales sécrétrices jouent un rôle fondamental dans cette fonction de protection grâce à la couche de mucus, fabriquée par les cellules caliciformes (goblet cells, en anglais), et aux molécules antimicrobiennes synthétisées notamment par les cellules de Paneth dans l’intestin grêle. De nombreuses cellules immunitaires résidentes de la muqueuse intestinale sondent les différents antigènes auxquels l’organisme est exposé et dirigent une réponse immunitaire adaptée : l’organisme tolère en effet les antigènes présentés par les microbes commensaux ; une réponse inflammatoire locale est en revanche induite contre les pathogènes afin d’empêcher une éventuelle infection systémique. Le maintien de cette homéostasie intestinale est assuré par un grand nombre de mécanismes cellulaires parmi lesquels la participation de l’autophagie apparaît de plus en plus évidente. Dans cette revue, nous avons choisi de détailler les fonctions essentielles de ce processus dans l’homéostasie intestinale, en particulier ses rôles spécifiques au sein des cellules épithéliales, afin de mieux comprendre son implication dans les pathologies inflammatoires et tumorales. |
L’autophagie, un senseur de perturbations environnementales Au-delà des fonctions connues de l’autophagie basale qui permettent la dégradation des agrégats protéiques et des organites altérés, plusieurs études réalisées au cours de cette dernière décennie ont mis en évidence des rôles qui s’avèrent spécifiques des types cellulaires. Stimulée en condition de stress, l’autophagie joue un rôle fondamental dans la cellule épithéliale intestinale. Elle participe à la défense antimicrobienne et à la composition de la flore. Elle permet également le maintien du métabolisme, en cas de rupture d’apport énergétique. L’autophagie, un mécanisme de défense contre l’infection bactérienne Régulation de la fonction sécrétrice des cellules épithéliales impliquées dans la défense antimicrobienne L’épithélium constitue une barrière physique et chimique essentielle permettant de se défendre contre les agressions potentielles de l’environnement. La couche de mucus représente une barrière physique. Son épaisseur varie le long du tube digestif. Elle est maximale dans l’iléon et le côlon où elle permet la rétention de molécules antimicrobiennes, comme les défensines et les IgA sécrétées, limitant ainsi la présence de bactéries au contact immédiat de l’épithélium. Les cellules de Paneth, situées à la base des cryptes intestinales au niveau de l’intestin grêle contribuent à la production de telles défensines. Elles contiennent des granules de sécrétion renfermant des peptides antimicrobiens et des enzymes comme le lysosyme, les α-défensines (cryptdines), l’angiogénine-4 et RegIIIg ( regenerating islet-derived protein 3 gamma). Bien que certains peptides antimicrobiens soient libérés de façon constitutive, la détection par les cellules de signaux d’origine bactérienne stimule également leur sécrétion. Les cellules de Paneth permettent ainsi de contrôler et limiter la colonisation de l’épithélium par la flore commensale et le protègent des pathogènes [ 2]. Plusieurs études ont révélé que les acteurs moléculaires de l’autophagie étaient impliqués dans les fonctions sécrétrices des cellules caliciformes et des cellules de Paneth (Figure 1). En effet, l’inactivation de gènes d’autophagie comme Atg5 ( autophagy-related gene 5), Atg7, Atg16L1, Atg4b ou l’expression d’un allèle hypomorphe 1 d’ Atg16L1 ( Atg16L1HM), chez la souris, conduit à une désorganisation des granules de sécrétion des cellules de Paneth et à un sévère défaut d’exocytose des peptides antimicrobiens [ 3]. Une expression de TNFα ( tumor necrosis factor alpha), de leptine, d’adiponectine et une activation de la signalisation PPAR ( peroxisome proliferator-activated receptor) sont de plus retrouvées dans les cellules de Paneth isolées des souris exprimant l’allèle Atg16L1HM (souris ATG16L1 HM) [ 4]. Toutefois, il est important de noter que les défauts observés dans les cellules de Paneth déficientes en autophagie semblent dépendre de plusieurs facteurs. En particulier, les souris ATG16L1 HM élevées en animalerie exempte d’organismes pathogènes spécifiques, présentent des cellules de Paneth avec une morphologie normale. Leurs défauts de sécrétion peuvent cependant être rétablis par une infection virale chronique, par une souche de norovirus (MNVCR6, murine norovirus strain CR6) [ 5].
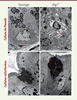 | Figure 1.
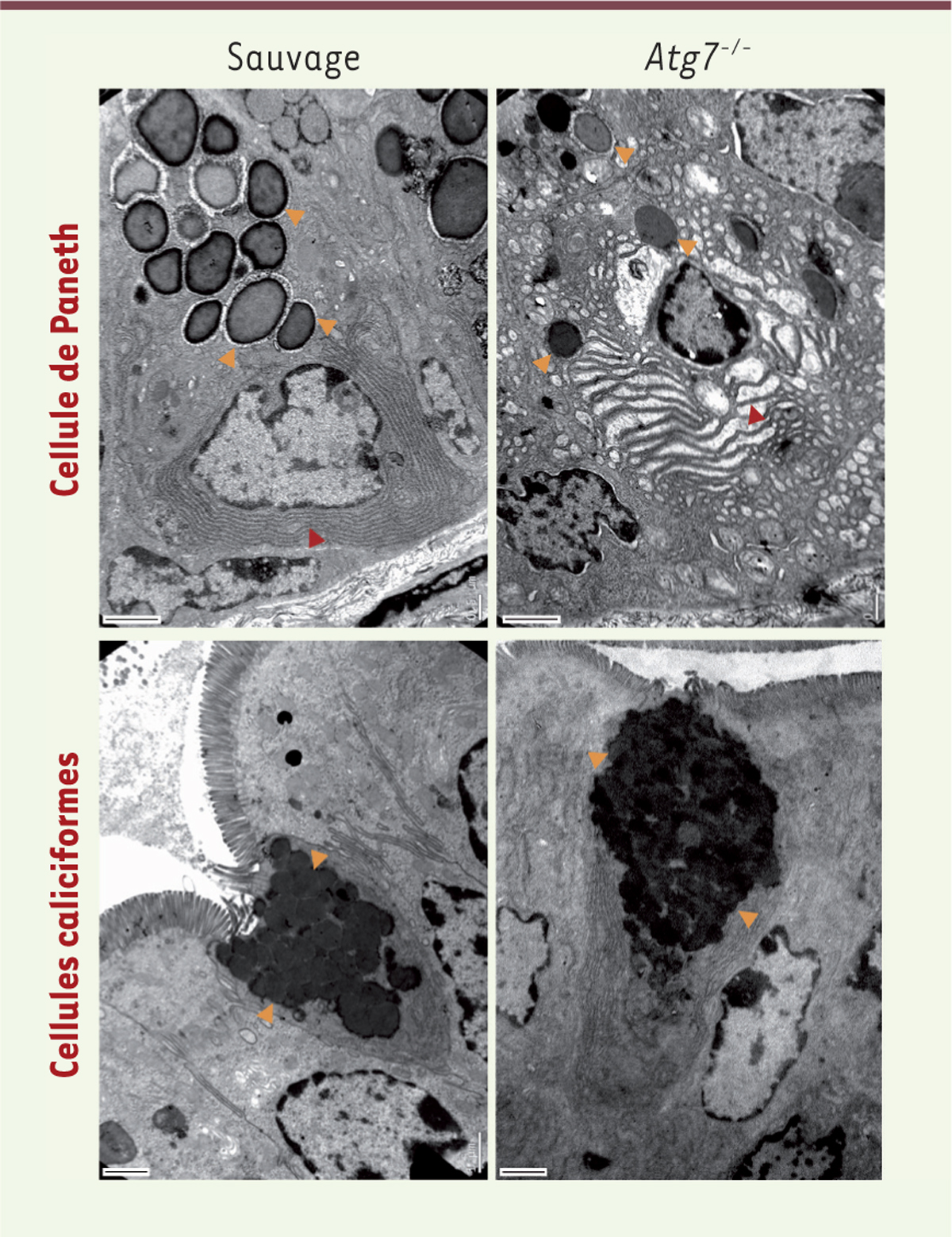
Effets de la perte de gènes de l’autophagie dans la fonction des cellules épithéliales sécrétrices. La sécrétion d’une couche de mucus par les cellules caliciformes et de molécules antimicrobiennes par les cellules de Paneth est essentielle pour le maintien de l’homéostasie intestinale. Ces images de microscopie électronique en transmission montrent les défauts liés à la sécrétion dans ces deux lignages épithéliaux après invalidation chez la souris du gène Atg7. On note en particulier une diminution du nombre de granules de sécrétion matures et un stress du réticulum endoplasmique dans les cellules de Paneth, ainsi que l’accumulation de granules non sécrétés dans les cellules caliciformes. Des phénotypes semblables sont retrouvés dans les modèles murins invalidés pour d’autres gènes de l’autophagie (Atg16L1, Atg5, Atg4b). Échelle : 1 µm. Les granules de sécrétion (cellules de Paneth) et les vésicules contenant le mucus (cellules caliciformes) sont indiqués par des flèches jaunes (). Le réticulum endoplasmique des cellules de Paneth est indiqué par des flèches rouges (). |
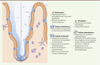 | Figure 2.
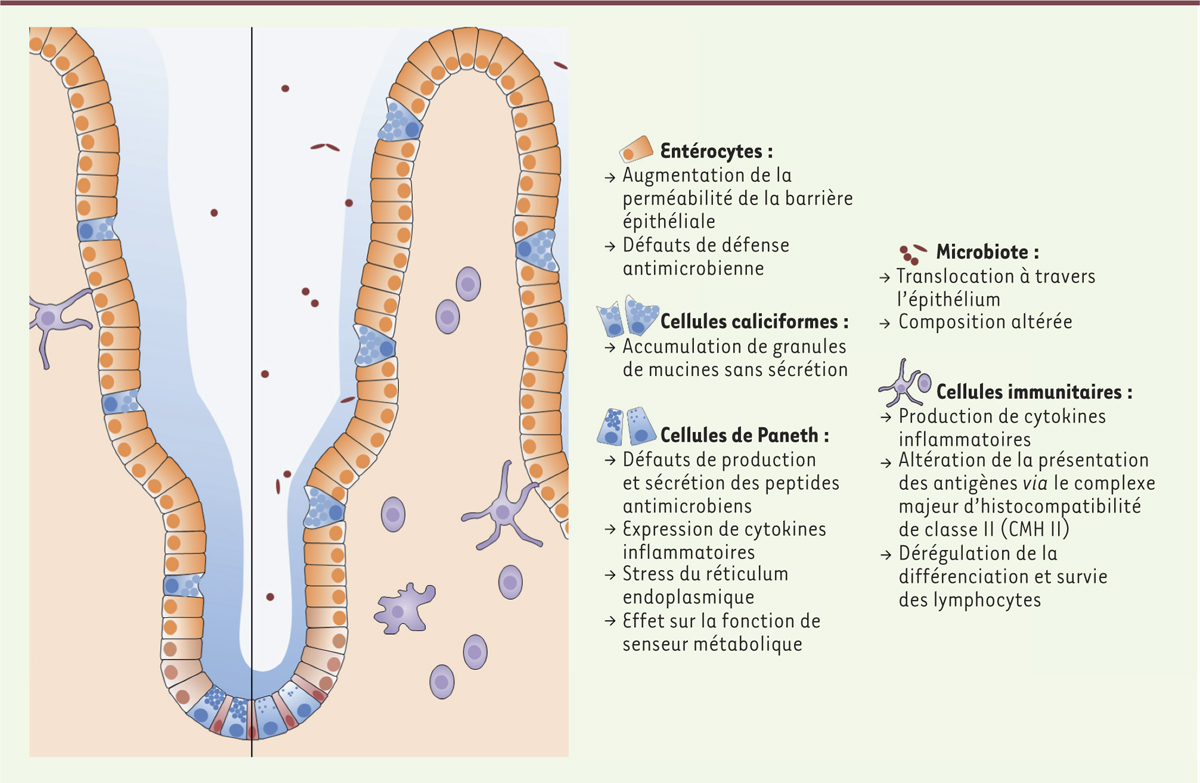
Conséquences de l’inhibition de l’autophagie dans l’épithélium intestinal. Un blocage de l’autophagie entraîne de nombreuses perturbations de l’homéostasie intestinale. Dans l’épithélium, on retrouve notamment des défauts dans les cellules caliciformes et les cellules de Paneth conduisant à une altération de la couche de mucus, un défaut de sécrétion de peptides antimicrobiens et une augmentation de la perméabilité de la barrière épithéliale. Associées à ces anomalies, on observe une translocation bactérienne à travers l’épithélium et une altération de la composition de la flore. Des défauts d’autophagie affectent également la fonction des cellules immunitaires avec plusieurs conséquences pro-inflammatoires. |
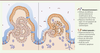 | Figure 3.
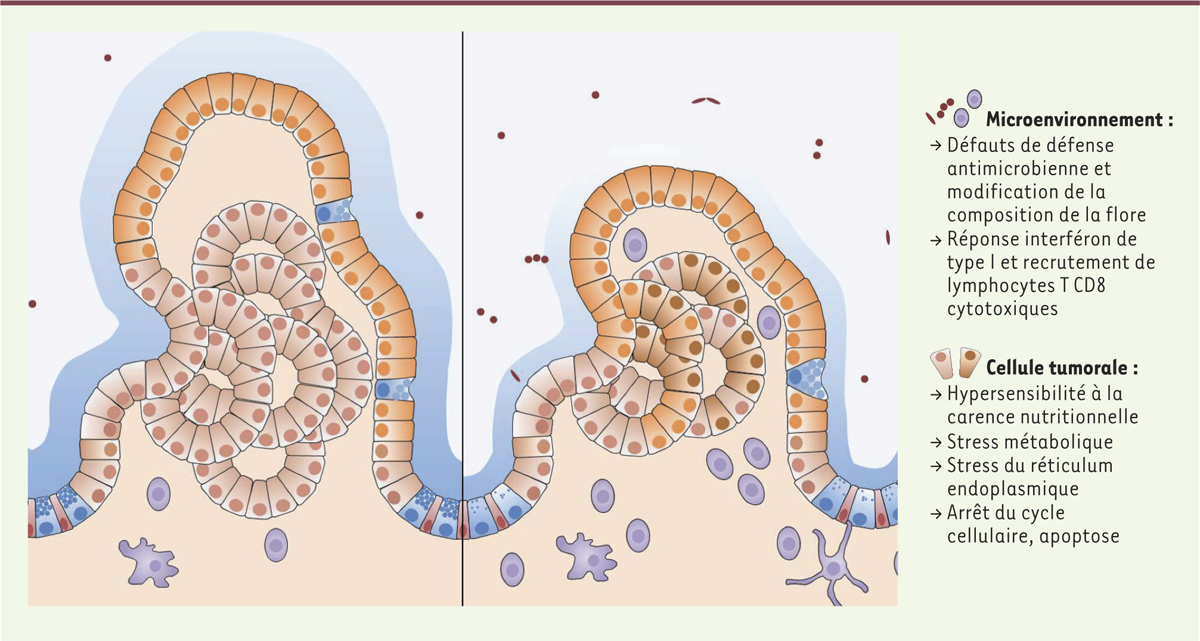
Effets anti-tumoraux de l’inhibition de l’autophagie dans l’épithélium intestinal. Chez la souris, l’inhibition de l’autophagie empêche l’initiation tumorale via ses effets sur la flore intestinale et sur le microenvironnement immunitaire. Elle bloque la progression tumorale en induisant plusieurs stress menant à l’arrêt du cycle cellulaire et à l’apoptose des cellules tumorales. |
Contrairement aux cellules de Paneth, les granules de sécrétion des cellules caliciformes ne présentent pas de différences morphologiques majeures lorsque l’autophagie est inhibée. Ces cellules accumulent cependant leurs granules de mucines et présentent des défauts de sécrétion (Figure 1). De telles altérations ont été observées dans des modèles de souris invalidées pour différents gènes Atg (Atg5, Atg16L1, Atg7), soulignant ainsi l’implication de la machinerie autophagique dans le processus de sécrétion via une interaction directe avec les endosomes [6–9]. Ces différentes études mettent donc en évidence l’importance de l’autophagie dans les fonctions de la barrière épithéliale intestinale. Elles montrent aussi le rôle fondamental qu’exerce l’exocytose des peptides antimicrobiens et des mucines dans le maintien de l’homéostasie intestinale. Elles permettent d’envisager les mécanismes à l’origine des pathologies qui affectent les patients atteints de la maladie de Crohn qui présentent des polymorphismes touchant les gènes de l’autophagie. Autophagie, stress du réticulum endoplasmique et cellules de Paneth Au-delà des défauts de sécrétion des cellules de Paneth, l’inhibition de l’autophagie dans ces cellules conduit à un stress du réticulum endoplasmique responsable de l’accumulation de protéines mal repliées non matures. La signalisation UPR ( unfolded protein response) est alors activée afin de réduire la synthèse globale des protéines, d’induire celle des protéines chaperonnes impliquées dans le repliement des autres protéines, et d’augmenter l’activité protéosomale. Toutefois, si ce processus adaptatif échoue, un mécanisme d’apoptose est alors déclenché. L’implication de l’autophagie dans la réponse au stress du réticulum a été démontrée chez les souris déficientes pour le gène XBP1 ( X-Box binding protein 1) spécifiquement dans les cellules de Paneth, qui deviennent incapables d’activer la réponse UPR [ 10]. La délétion du gène XBP1 conduit à une activation du processus autophagique et à des anomalies des cellules de Paneth à l’origine d’une iléite (inflammation de l’iléon). L’invalidation additionnelle d’un gène de l’autophagie ( Atg7 ou Atg16L1), chez les souris XBP1-/-, conduit à une inflammation très sévère. Dans les cellules de Paneth, l’autophagie agit donc conjointement avec la réponse UPR, pour réguler l’homéostasie intestinale. Implication de l’autophagie dans la composition de la flore intestinale et le contrôle de l’inflammation La dérégulation de l’autophagie dans l’épithélium intestinal, à l’origine de la perte de capacité de production des défenses antimicrobiennes innées, conduit à des modifications de la flore intestinale. Deux études indépendantes, dont la nôtre, ont en effet récemment démontré que, chez la souris, l’invalidation d’ Atg7 dans l’épithélium intestinal résultait en une altération de la composition de la flore intestinale (dysbiose), avec une plus forte prévalence du phylum Firmicutes et particulièrement de la classe des Clostridiales [ 9, 11], et un recrutement de différentes populations immunitaires [ 11]. Elle confère également une hyper-sensibilité à la colite induite par le dextran sulfate de sodium (DSS) 2, [ 9] qui est consécutive à la modification de la flore intestinale. Chez l’homme, l’iléon inflammé de patients atteints de la maladie de Crohn et porteurs du polymorphisme T300A du gène Atg16L1, présente également une dysbiose qui est marquée par une augmentation des Enterobacteriaceae, des Bacteroidaceae et des Fusobacteriaceae [ 12]. La xénophagie L’effet protecteur de l’autophagie vis-à-vis du microbiote intestinal est également renforcé par sa capacité à dégrader les bactéries présentes dans les cellules épithéliales intestinales et les macrophages. Ce processus sélectif de l’autophagie, appelé xénophagie, permet de cibler des bactéries intracellulaires, localisées dans le cytosol ou dans des vacuoles, et de limiter leur croissance. Dans la majorité des cas, des vésicules séquestrent les bactéries qui sont ensuite éliminées lors de la fusion avec les lysosomes. La dégradation des pathogènes permet ainsi de délivrer les antigènes microbiens aux molécules du complexe majeur d’histocompatibilité (CMH) de classe I et de classe II portées par les cellules présentatrices d’antigènes. L’autophagie participe ainsi directement à l’activation et au développement de la réponse lymphocytaire (lymphocytes de type Th[ helper]1, Th2, Th17 et lymphocytes T cytotoxiques) permettant l’élimination des micro-organismes pathogènes. Une induction rapide de l’autophagie dans l’épithélium se produit lors d’infections de souris axéniques 3 ou « conventionnelles » par des bactéries invasives pathogènes comme Salmonella Tiphimurium, Shigella flexneri ou des souches d’ Escherichia coli particulières retrouvées associées à la maladie de Crohn, les AIEC ( adherent-invasive Escherichia coli), mais également par des souches commensales comme Enterococcus faecalis [ 13– 16]. Ces mêmes infections ne suscitent pas de réponse autophagique chez les souris dont les cellules épithéliales sont déficientes pour les gènes Atg5, Atg16L1 ou Atg7. Ajoutées aux défauts de sécrétion des cellules de Paneth et des cellules caliciformes, ces anomalies permettent la dissémination bactérienne et une infection systémique. Rôle de l’autophagie dans la régulation métabolique La carence nutritionnelle représente un stress majeur à l’origine de l’activation de l’autophagie par sa capacité d’inhiber mTORC1 ( mammalian target of rapamycin complex 1), d’activer l’AMPK ( AMP-activated protein kinase) et de déacétyler des gènes clés de l’autophagie ( Atg5, Atg7 et Atg8), grâce à SIRT1 ( Sirtuin 1). Des données expérimentales et des observations cliniques ont clairement démontré l’influence des nutriments et de leur disponibilité sur l’homéostasie intestinale. Au-delà de leur rôle dans l’immunité innée, les cellules de Paneth agissent comme senseur nutritionnel capable de stimuler la prolifération des cellules souches à la suite de l’inhibition de mTORC1 [ 17, 18]. Ainsi, la restriction calorique stimule la prolifération des cellules souches intestinales en affectant leur niche [ 17, 18]. Les cellules de Paneth interviennent également dans le maintien des cellules souches : elles sont ainsi nécessaires à la prolifération et la genèse d’organoïdes en culture à partir de cellules souches intestinales isolées [ 19, 20]. Notons également que la survie d’organoïdes issus de cellules souches sauvages et de cellules de Paneth déficientes en autophagie est altérée, confortant l’implication de l’autophagie dans la niche des cellules souches [ 7]. Étant donné l’importance de l’autophagie dans les processus de sécrétion des cellules de Paneth et de sa régulation par mTORC1, il apparaît fondamental d’étudier son implication directe au cours de la régénération cellulaire associée à la restriction calorique. La déplétion en acides aminés représente un autre contexte métabolique connu pour stimuler l’autophagie [21]. En effet, des travaux récents suggèrent l’implication de l’autophagie dans le contrôle de l’inflammation et de l’intégrité de l’épithélium intestinal dans le contexte de la carence en acides aminés [22]. Ainsi, l’invalidation du gène GCN2 (general controlled non-repressed 2), codant une kinase sensible au déficit en acides aminés, dans les cellules épithéliales, conduit à une inflammation très sévère caractérisée par une augmentation des lymphocytes T CD4+ produisant de l’IL(interleukine)-17 (une réponse immunitaire souvent associée aux colites), ainsi qu’une perte cryptique dans le côlon, après administration de DSS. Un lien entre effets de GCN2 sur l’homéostasie intestinale et autophagie a été suggéré. En effet, les souris invalidées pour les gènes Atg16L1, Atg5 ou Atg7 présentent également une sensibilité accrue au traitement par le DSS et révèlent des phénotypes qui sont similaires à ceux des souris GCN2-/-. Ces résultats renforcent donc la notion d’un rôle clé de l’autophagie dans le contrôle de l’homéostasie intestinale selon la disponibilité en acides aminés. Plusieurs études suggèrent que la restriction calorique et l’activation de l’autophagie pourraient contribuer à l’allongement de la vie de nombreuses espèces animales [23, 24]. Chez le nématode Caenorhabditis elegans, les vers invalidés pour le gène eat-2, prédisposés à manger moins, vivent plus longtemps [25]. Ce gain de longévité des vers mutants serait le résultat d’une activation de l’autophagie dans l’intestin et d’une préservation de la perméabilité intestinale, qui s’altère au cours du vieillissement. D’autres données obtenues chez C. elegans et chez la drosophile suggèrent également que le maintien de l’homéostasie intestinale serait un gage de longévité. L’augmentation de la perméabilité intestinale pourrait donc participer au vieillissement en affectant le métabolisme, la réponse inflammatoire et le microbiote [26–28]. Ces résultats ouvrent ainsi de nouvelles pistes intéressantes à explorer chez les mammifères afin de mieux comprendre les effets de l’autophagie intestinale sur la longévité. |
Autophagie et pathologies intestinales Au vu des fonctions essentielles assurées par l’autophagie, il n’est pas surprenant qu’une dérégulation de ce processus contribue à des pathologies intestinales, en particulier, inflammatoires et tumorales. Autophagie et prédisposition à la maladie de Crohn La maladie de Crohn (MC) est une maladie inflammatoire complexe reposant sur des facteurs génétiques et environnementaux responsables d’un déséquilibre entre microbiote, épithélium intestinal et système immunitaire. Elle se caractérise en particulier par une augmentation de la perméabilité épithéliale, une dysbiose, un défaut de sécrétion de peptides antimicrobiens et de mucus, un stress du réticulum endoplasmique, une augmentation de la production de cytokines pro-inflammatoires (IL-1β, IL-6, IFNg [interféron gamma], TNFα, etc.) et une réponse immunitaire de type Th17. Plusieurs gènes de susceptibilité ont été décrits pour la maladie de Crohn : ATG16L1 et IRGM ( immunity-related GTPase M), qui participent au processus autophagique ; NOD2 ( nucleotide-binding oligomerization domain 2), un récepteur de type NLR ( Nod-like receptor) de l’immunité innée qui est également impliqué dans la régulation de l’autophagie. Un polymorphisme du gène ATG16L1 a été associé à la maladie [ 29] : le variant T300A du gène ( ATG16L1
T300A) favorise en effet le clivage de la protéine par les caspases-3 et -7, conduisant à une diminution de son expression [ 7, 30]. Dans les modèles murins exprimant l’allèle ATG16L1
T300A, un défaut des cellules de Paneth, de xénophagie et une sécrétion accrue de la cytokine pro-inflammatoire IL-1β par les macrophages sont observés [ 7]. D’autres modifications responsables d’une perte de régulation de l’autophagie et entraînant un défaut de xénophagie [ 31] sont retrouvées chez les patients atteints de maladie de Crohn : une délétion en amont du gène IRGM et plusieurs polymorphismes non codants. Les polymorphismes du gène NOD2 ont été les premiers à avoir été associés à la maladie. Ils restent à ce jour les facteurs de risques les plus significatifs [ 32]. NOD2 code un récepteur intracellulaire qui reconnaît le muramyl-dipeptide (MDP) présent à la surface de certaines bactéries. La détection du MDP par NOD2 induit une activation de la voie NFκB ( nuclear factor kappa B) à l’origine d’une réponse immunitaire inflammatoire. Un « ménage à trois » faisant intervenir des interactions fonctionnelles entre NOD2, ATG16L1 et IRGM a été décrit pour la prise en charge intracellulaire des pathogènes et l’activation par le MDP illustrant le rôle de l’autophagie dans ce processus [ 33– 35]. Via l’autophagie, NOD2 pourrait ainsi jouer un rôle essentiel dans le maintien de l’équilibre de la flore intestinale. Des études d’association ont également permis d’identifier d’autres polymorphismes associés à la maladie de Crohn dans des gènes d’autophagie, ULK1 ( Unc-51-like autophagy-activating kinase 1), NDP52 ( nuclear domain 10 protein 52), ainsi que dans des gènes pouvant affecter LRRK2 ( leucine-rich repeat kinase 2) et PTPN2 ( protein tyrosine phosphatase, non-receptor type 2). Toutefois, les conséquences fonctionnelles de ces polymorphismes dans la pathologie restent à démontrer. Bien que l’autophagie apparaisse à l’interface des différentes fonctions biologiques altérées dans la maladie de Crohn, les polymorphismes des gènes impliqués dans l’autophagie sont des facteurs de risques et n’ont actuellement pas de lien causal direct [29]. Des modèles murins exprimant les variants des gènes IRGM ou ATG16L1 sont plus sensibles aux effets du DSS [4, 7, 36] ; ils ne développent cependant pas d’inflammation intestinale spontanée. Autophagie et cancer colorectal L’autophagie est apparue récemment comme un facteur favorisant le développement du cancer colorectal (CRC). Une augmentation de l’expression de plusieurs marqueurs de l’autophagie (GABARAP [ gamma-aminobutyric acid receptor-associated protein], ULK1, LC3, Atg5, Atg7 ou Beclin-1) fréquemment retrouvée dans des lignées et dans des tissus humains isolés de CRC, est généralement associée à un mauvais pronostic. L’autophagie limiterait également l’action de certaines chimiothérapies [ 11, 37– 41]. Lors d’une carence nutritionnelle, mimant les contraintes liées aux défauts de vascularisation des tumeurs, l’activation de l’autophagie permet la survie des cellules coliques cancéreuses. Deux études récentes ont renforcé cette notion dans des modèles murins de cancérogenèse colique. L’altération de l’autophagie, induite par la délétion conditionnelle du gène Atg7 dans les cellules épithéliales intestinales, affecte en effet la progression tumorale induite par la perte du gène suppresseur de tumeur APC ( adenomatous polyposis coli) [ 11]. L’inhibition de l’autophagie, dans les cellules tumorales intestinales, est responsable d’un arrêt du cycle cellulaire, ce qui illustre l’addiction des cellules tumorales au processus d’autophagie, comme cela a été décrit pour les cancers mammaires, du poumon et du pancréas [ 42– 44]. Les cellules tumorales intestinales n’exprimant pas le gène Atg7 présentent une diminution d’expression des enzymes de la glycolyse, une activation de p53, et du senseur énergétique universel AMPK. Des données similaires ont été obtenues dans un modèle murin invalidé pour le gène Atg5 dans les cellules épithéliales intestinales, et traité par le DSS et un agent carcinogène (AOM, azoxyméthane) [ 45]. Les cellules tumorales déficientes en autophagie présentent un stress du réticulum endoplasmique qui active la signalisation UPR qui est probablement inefficace, ce qui contribue à la mort des cellules cancéreuses. Il est donc vraisemblable que le rôle suppresseur de tumeur, ayant pour origine l’inhibition de l’autophagie dans l’intestin, illustre, là encore, l’implication fondamentale de l’autophagie dans le contrôle du métabolisme tumoral. L’autophagie permet aux cellules cancéreuses de s’adapter aux différentes situations de stress, de répondre aux nécessités énergétiques et en biomasse, pour permettre l’augmentation de leur division. La perte du gène Atg7 dans la cellule épithéliale intestinale conduit à des modifications de la flore intestinale. L’utilisation d’une antibiothérapie suggère que ces modifications pourraient être responsables de la réponse immunitaire antitumorale. Les mécanismes restent cependant à définir. Ces données sont à relier à celles montrant que les patients homozygotes pour le variant ATG16L1T300A
présentent une activation de la signalisation interféron de type I et une meilleure survie [46]. L’autophagie apparaît donc être un partenaire à part entière dans le développement tumoral intestinal en agissant non seulement sur la cellule cancéreuse en contrôlant son métabolisme, mais également en intervenant sur le microenvironnement immunitaire et bactérien, deux alliés fondamentaux pour lutter contre le cancer. |
Cinquante ans après la découverte de l’autophagie qui faisait suite à l’identification des lysosomes par Christian de Duve, la caractérisation des phénomènes biologiques qui lui sont associés permettent de mieux comprendre l’homéostasie intestinale, le développement tumoral et les maladies inflammatoires chroniques de l’intestin. Les données collectées ont ainsi permis d’illustrer l’importance de l’autophagie dans l’homéostasie de l’épithélium intestinal. Ce processus lui permet en effet de s’adapter aux nombreuses situations de stress auxquelles seul l’intestin est exposé, qu’elles soient intrinsèques, de par sa régénération incessante, ou liées à son microenvironnement. La dérégulation de l’autophagie a des effets qui sont spécifiques à certains types cellulaires présents au sein de cet épithélium. En particulier, des défauts touchant les cellules de Paneth ont été largement décrits. La sensibilité particulière de ces cellules pourrait être liée à leur longue durée de vie (environ 40 jours, les autres cellules épithéliales différenciées sont renouvelées tous les 3 à 4 jours), à leur production protéique élevée, ou à un rôle, non conventionnel, des protéines de l’autophagie spécifiques aux fonctions uniques de ces cellules. L’inhibition de l’autophagie dans des modèles murins génétiquement modifiés suggère qu’une altération du processus, chez les patients à risque de développer des CRC, pourrait représenter une nouvelle stratégie thérapeutique. La mise en place d’une réponse immunitaire antitumorale, qui serait possible après inhibition de l’autophagie, pourrait accroître l’efficacité des traitements d’immunothérapie. Compte tenu de l’implication des cellules de Paneth dans la niche des cellules souches et du lien entre autophagie et cancer, il semble important, à présent, de déterminer si l’autophagie participe directement à la survie ou à l’activité des cellules souches intestinales. Son implication dans la maladie de Crohn apparaît plus complexe. L’identification d’autres facteurs génétiques ou environnementaux agissant de concert avec les polymorphismes déjà décrits pour leur rôle dans l’inflammation chronique est une étape fondamentale pour le développement de nouvelles cibles thérapeutiques et pour la prédiction des risques face à la maladie. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Barker N. Adult intestinal stem cells: critical drivers of epithelial homeostasis and regeneration . Nat Rev Mol Cell Biol. 2014; ; 15 : :19.–33. 2.
Vaishnava S, Behrendt CL, Ismail AS, et al. Paneth cells directly sense gut commensals and maintain homeostasis at the intestinal host-microbial interface . Proc Natl Acad Sci USA. 2008; ; 105 : :20858.–20863. 3.
Stappenbeck TS The role of autophagy in Paneth cell differentiation and secretion . Mucosal Immunol. 2010; ; 3 : :8.–10. 4.
Cadwell K, Liu JY, Brown SL, et al. A key role for autophagy and the autophagy gene Atg16l1 in mouse and human intestinal Paneth cells . Nature. 2008; ; 456 : :259.–263. 5.
Cadwell K, Patel KK, Maloney NS, et al. Virus-plus-susceptibility gene interaction determines Crohn’s disease gene Atg16L1 phenotypes in intestine . Cell. 2010; ; 141 : :1135.–1145. 6.
Patel KK, Miyoshi H, Beatty WL, et al. Autophagy proteins control goblet cell function by potentiating reactive oxygen species production . EMBO J. 2013; ; 32 : :3130.–3144. 7.
Lassen KG, Kuballa P, Conway KL, et al. Atg16L1 T300A variant decreases selective autophagy resulting in altered cytokine signaling and decreased antibacterial defense . Proc Natl Acad Sci USA. 2014; ; 111 : :7741.–7746. 8.
Levy J, Romagnolo B Autophagy, microbiota and intestinal oncogenesis . Oncotarget. 2015; ; 6 : :34067.–34068. 9.
Tsuboi K, Nishitani M, Takakura A, et al. Autophagy protects against colitis by the maintenance of normal gut microflora and secretion of mucus . J Biol Chem. 2015; ; 290 : :20511.–20526. 10.
Adolph TE, Tomczak MF, Niederreiter L, et al. Paneth cells as a site of origin for intestinal inflammation . Nature. 2013; ; 503 : :272.–276. 11.
Levy J, Cacheux W, Bara MA, et al. Intestinal inhibition of Atg7 prevents tumour initiation through a microbiome-influenced immune response and suppresses tumour growth . Nat Cell Biol. 2015; ; 17 : :1062.–1073. 12.
Sadaghian Sadabad M, Regeling A, de Goffau MC, et al. The ATG16L1-T300A allele impairs clearance of pathosymbionts in the inflamed ileal mucosa of Crohn’s disease patients . Gut. 2015; ; 64 : :1546.–1552. 13.
Benjamin JL, Sumpter R, Jr., Levine B, Hooper LV Intestinal epithelial autophagy is essential for host defense against invasive bacteria . Cell Host Microbe. 2013; ; 13 : :723.–734. 14.
Chang SY, Lee SN, Yang JY, et al. Autophagy controls an intrinsic host defense to bacteria by promoting epithelial cell survival: a murine model . PLoS One. 2013; ; 8 : :e81095.. 15.
Conway KL, Kuballa P, Song JH, et al. Atg16l1 is required for autophagy in intestinal epithelial cells and protection of mice from Salmonella infection . Gastroenterology. 2013; ; 145 : :1347.–1357. 16.
Mimouna S, Bazin M, Mograbi B, et al. HIF1A regulates xenophagic degradation of adherent and invasive Escherichia coli (AIEC) . Autophagy. 2014; ; 10 : :2333.–2345. 17.
Yilmaz OH, Katajisto P, Lamming DW, et al. mTORC1 in the Paneth cell niche couples intestinal stem-cell function to calorie intake . Nature. 2012; ; 486 : :490.–495. 18.
Igarashi M, Guarente L mTORC1 and SIRT1 cooperate to foster expansion of gut adult stem cells during calorie restriction . Cell. 2016; ; 166 : :436.–450. 19.
Durand A, Donahue B, Peignon G, et al. Functional intestinal stem cells after Paneth cell ablation induced by the loss of transcription factor Math1 (Atoh1) . Proc Natl Acad Sci USA. 2012; ; 109 : :8965.–8970. 20.
Sato T, van Es JH, Snippert HJ, et al. Paneth cells constitute the niche for Lgr5 stem cells in intestinal crypts . Nature. 2011; ; 469 : :415.–418. 21.
Galluzzi L, Pietrocola F, Levine B, Kroemer G Metabolic control of autophagy . Cell. 2014; ; 159 : :1263.–1276. 22.
Ravindran R, Loebbermann J, Nakaya HI, et al. The amino acid sensor GCN2 controls gut inflammation by inhibiting inflammasome activation . Nature. 2016; ; 531 : :523.–527. 23.
Fontana L, Partridge L Promoting health and longevity through diet: from model organisms to humans . Cell. 2015; ; 161 : :106.–118. 24.
Madeo F, Zimmermann A, Maiuri MC, Kroemer G Essential role for autophagy in life span extension . J Clin Invest. 2015; ; 125 : :85.–93. 25.
Gelino S, Chang JT, Kumsta C, et al. Intestinal autophagy improves healthspan and longevity in C. elegans during dietary restriction . PLoS Genet. 2016; ; 12 : :e1006135.. 26.
Rera M, Clark RI, Walker DW Intestinal barrier dysfunction links metabolic and inflammatory markers of aging to death in Drosophila . Proc Natl Acad Sci USA. 2012; ; 109 : :21528.–21533. 27.
Guo L, Karpac J, Tran SL, Jasper H PGRP-SC2 promotes gut immune homeostasis to limit commensal dysbiosis and extend lifespan . Cell. 2014; ; 156 : :109.–122. 28.
Clark RI, Salazar A, Yamada R, et al. Distinct shifts in microbiota composition during Drosophila aging impair intestinal function and drive mortality . Cell Rep. 2015; ; 12 : :1656.–1667. 29.
Rioux JD, Xavier RJ, Taylor KD, et al. Genome-wide association study identifies new susceptibility loci for Crohn disease and implicates autophagy in disease pathogenesis . Nat Genet. 2007; ; 39 : :596.–604. 30.
Murthy A, Li Y, Peng I, et al. A Crohn’s disease variant in Atg16l1 enhances its degradation by caspase 3 . Nature. 2014; ; 506 : :456.–462. 31.
Brest P, Lapaquette P, Souidi M, et al. A synonymous variant in IRGM alters a binding site for miR-196 and causes deregulation of IRGM-dependent xenophagy in Crohn’s disease . Nat Genet. 2011; ; 43 : :242.–245. 32.
Hampe J, Cuthbert A, Croucher PJ, et al. Association between insertion mutation in NOD2 gene and Crohn’s disease in German and British populations . Lancet. 2001; ; 357 : :1925.–1928. 33.
Travassos LH, Carneiro LA, Ramjeet M, et al. Nod1 and Nod2 direct autophagy by recruiting ATG16L1 to the plasma membrane at the site of bacterial entry . Nat Immunol. 2010; ; 11 : :55.–62. 34.
Cooney R, Baker J, Brain O, et al. NOD2 stimulation induces autophagy in dendritic cells influencing bacterial handling and antigen presentation . Nat Med. 2010; ; 16 : :90.–97. 35.
Chauhan S, Mandell MA, Deretic V IRGM governs the core autophagy machinery to conduct antimicrobial defense . Mol Cell. 2015; ; 58 : :507.–521. 36.
Liu B, Gulati AS, Cantillana V, et al. Irgm1-deficient mice exhibit Paneth cell abnormalities and increased susceptibility to acute intestinal inflammation . Am J Physiol Gastrointest Liver Physiol. 2013; ; 305 : :G573.–G584. 37.
Miao Y, Zhang Y, Chen Y, et al. GABARAP is overexpressed in colorectal carcinoma and correlates with shortened patient survival . Hepatogastroenterology. 2010; ; 57 : :257.–261. 38.
Zou Y, Chen Z, He X, et al. High expression levels of unc-51-like kinase 1 as a predictor of poor prognosis in colorectal cancer . Oncol Lett. 2015; ; 10 : :1583.–1588. 39.
Schmitz KJ, Ademi C, Bertram S, et al. Prognostic relevance of autophagy-related markers LC3, p62/sequestosome 1, Beclin-1 and ULK1 in colorectal cancer patients with respect to KRAS mutational status . World J Surg Oncol. 2016; ; 14 : :189.. 40.
Guo GF, Jiang WQ, Zhang B, et al. Autophagy-related proteins Beclin-1 and LC3 predict cetuximab efficacy in advanced colorectal cancer . World J Gastroenterol. 2011; ; 17 : :4779.–4786. 41.
Park JM, Huang S, Wu TT, et al. Prognostic impact of Beclin 1, p62/sequestosome 1 and LC3 protein expression in colon carcinomas from patients receiving 5-fluorouracil as adjuvant chemotherapy . Cancer Biol Ther. 2013; ; 14 : :100.–107. 42.
Guo JY, Chen HY, Mathew R, et al. Activated Ras requires autophagy to maintain oxidative metabolism and tumorigenesis . Genes Dev. 2011; ; 25 : :460.–470. 43.
Rao S, Tortola L, Perlot T, et al. A dual role for autophagy in a murine model of lung cancer . Nat Commun. 2014; ; 5 : :3056.. 44.
Rosenfeldt MT, O’Prey J, Morton JP, et al. p53 status determines the role of autophagy in pancreatic tumour development . Nature. 2013; ; 504 : :296.–300. 45.
Sakitani K, Hirata Y, Hikiba Y, et al. Inhibition of autophagy exerts anti-colon cancer effects via apoptosis induced by p53 activation and ER stress . BMC Cancer. 2015; ; 15 : :795.. 46.
Grimm WA, Messer JS, Murphy SF, et al. The Thr300Ala variant in ATG16L1 is associated with improved survival in human colorectal cancer and enhanced production of type I interferon . Gut. 2015; ; 65 : :456.–464. |