1.
Global; , regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death. , 1980–2015 : a systematic analysis for the global burden of disease study 2015 . Lancet. 2016; ; 388 : :1459.–1544.
2.
Codogno P, Meijer AJ. Autophagy and signaling : their role in cell survival and cell death . Cell Death Differ. 2005; ; 12 ((suppl 2)) : :1509.–1518.
3.
Taneike M, Yamaguchi O, Nakai A, et al. Inhibition of autophagy in the heart induces age-related cardiomyopathy . Autophagy. 2010; ; 6 : :600.–606.
4.
Zhou J, Freeman TA, Ahmad F, et al. GSK-3alpha is a central regulator of age-related pathologies in mice . J Clin Invest. 2013; ; 123 : :1821.–1832.
5.
Inuzuka Y, Okuda J, Kawashima T, et al. Suppression of phosphoinositide 3-kinase prevents cardiac aging in mice . Circulation. 2009; ; 120 : :1695.–1703.
6.
Dutta D, Calvani R, Bernabei R, et al. Contribution of impaired mitochondrial autophagy to cardiac aging : mechanisms and therapeutic opportunities . Circ Res. 2012; ; 110 : :1125.–1138.
7.
Kubli DA, Quinsay MN, Gustafsson AB. Parkin deficiency results in accumulation of abnormal mitochondria in aging myocytes . Commun Integr Biol. 2013; ; 6 : :e24511..
8.
Hoshino A, Mita Y, Okawa Y, et al. Cytosolic p53 inhibits Parkin-mediated mitophagy and promotes mitochondrial dysfunction in the mouse heart . Nat Commun. 2013; ; 4 : :2308..
9.
Lin S, Wang Y, Zhang X, et al. HSP27 alleviates cardiac aging in mice via a mechanism involving antioxidation and mitophagy activation . Oxid Med Cell Longev. 2016; ; 2016 : :2586706..
10.
Zhang H, Bosch-Marce M, Shimoda LA, et al. Mitochondrial autophagy is an HIF-1-dependent adaptive metabolic response to hypoxia . J Biol Chem. 2008; ; 283 : :10892.–10903.
11.
Matsui Y, Takagi H, Qu X, et al. Distinct roles of autophagy in the heart during ischemia and reperfusion: roles of AMP-activated protein kinase and Beclin 1 in mediating autophagy . Circ Res. 2007; ; 100 : :914.–922.
12.
Kanamori H, Takemura G, Goto K, et al. Autophagy limits acute myocardial infarction induced by permanent coronary artery occlusion . Am J Physiol Heart Circ Physiol. 2011; ; 300 : :H2261.–H2271.
13.
Valentim L, Laurence KM, Townsend PA, et al. Urocortin inhibits Beclin1-mediated autophagic cell death in cardiac myocytes exposed to ischaemia/reperfusion injury . J Mol Cell Cardiol. 2006; ; 40 : :846.–852.
14.
Yan L, Vatner DE, Kim SJ, et al. Autophagy in chronically ischemic myocardium . Proc Natl Acad Sci USA. 2005; ; 102 : :13807.–13812.
15.
Yan WJ, Dong HL, Xiong LZ. The protective roles of autophagy in ischemic preconditioning . Acta Pharmacol Sin. 2013; ; 34 : :636.–643.
16.
Ma X, Liu H, Foyil SR, et al. Impaired autophagosome clearance contributes to cardiomyocyte death in ischemia/reperfusion injury . Circulation. 2012; ; 125 : :3170.–3181.
17.
Ma X, Liu H, Foyil SR, et al. Autophagy is impaired in cardiac ischemia-reperfusion injury . Autophagy. 2012; ; 8 : :1394.–1396.
18.
Kostin S, Pool L, Elsasser A, et al. Myocytes die by multiple mechanisms in failing human hearts . Circ Res. 2003; ; 92 : :715.–724.
19.
Zhu H, Tannous P, Johnstone JL, et al. Cardiac autophagy is a maladaptive response to hemodynamic stress . J Clin Invest. 2007; ; 117 : :1782.–1793.
20.
Marino G, Pietrocola F, Eisenberg T, et al. Regulation of autophagy by cytosolic acetyl-coenzyme A . Mol Cell. 2014; ; 53 : :710.–725.
21.
Cao DJ, Wang ZV, Battiprolu PK, et al. Histone deacetylase (HDAC) inhibitors attenuate cardiac hypertrophy by suppressing autophagy . Proc Natl Acad Sci USA. 2011; ; 108 : :4123.–4128.
22.
Nakai A, Yamaguchi O, Takeda T, et al. The role of autophagy in cardiomyocytes in the basal state and in response to hemodynamic stress . Nat Med. 2007; ; 13 : :619.–624.
23.
Bhuiyan MS, Pattison JS, Osinska H, et al. Enhanced autophagy ameliorates cardiac proteinopathy . J Clin Invest. 2013; ; 123 : :5284.–5297.
24.
Kuzman JA, O’Connell TD, Gerdes AM. Rapamycin prevents thyroid hormone-induced cardiac hypertrophy . Endocrinology. 2007; ; 148 : :3477.–3484.
25.
Bishu K, Ogut O, Kushwaha S, et al. Anti-remodeling effects of rapamycin in experimental heart failure : dose response and interaction with angiotensin receptor blockade . PLoS One. 2013; ; 8 : :e81325..
26.
Li Y, Chen C, Yao F, et al. AMPK inhibits cardiac hypertrophy by promoting autophagy via mTORC1 . Arch Biochem Biophys. 2014; ; 558 : :79.–86.
27.
Wang X, Robbins J. Proteasomal and lysosomal protein degradation and heart disease . J Mol Cell Cardiol. 2014; ; 71 : :16.–24.
28.
Tanaka Y, Guhde G, Suter A, et al. Accumulation of autophagic vacuoles and cardiomyopathy in LAMP-2-deficient mice . Nature. 2000; ; 406 : :902.–906.
29.
Hashem SI, Perry CN, Bauer M, et al. Brief report : oxidative stress mediates cardiomyocyte apoptosis in a human model of Danon disease and heart failure . Stem Cells. 2015; ; 33 : :2343.–2350.
30.
Xie Z, Lau K, Eby B, et al. Improvement of cardiac functions by chronic metformin treatment is associated with enhanced cardiac autophagy in diabetic OVE26 mice . Diabetes. 2011; ; 60 : :1770.–1778.
31.
Xu X, Kobayashi S, Chen K, et al. Diminished autophagy limits cardiac injury in mouse models of type 1 diabetes . J Biol Chem. 2013; ; 288 : :18077.–18092.
32.
Guo R, Zhang Y, Turdi S, Ren J. Adiponectin knockout accentuates high fat diet-induced obesity and cardiac dysfunction : role of autophagy . Biochim Biophys Acta. 2013; ; 1832 : :1136.–1148.
33.
Mellor KM, Bell JR, Young MJ, et al. Myocardial autophagy activation and suppressed survival signaling is associated with insulin resistance in fructose-fed mice . J Mol Cell Cardiol. 2011; ; 50 : :1035.–1043.
34.
Russo SB, Baicu CF, Van Laer A, et al. Ceramide synthase 5 mediates lipid-induced autophagy and hypertrophy in cardiomyocytes . J Clin Invest. 2012; ; 122 : :3919.–3930.
35.
Xu X, Hua Y, Nair S, et al. Akt2 knockout preserves cardiac function in high-fat diet-induced obesity by rescuing cardiac autophagosome maturation . J Mol Cell Biol. 2013; ; 5 : :61.–63.
36.
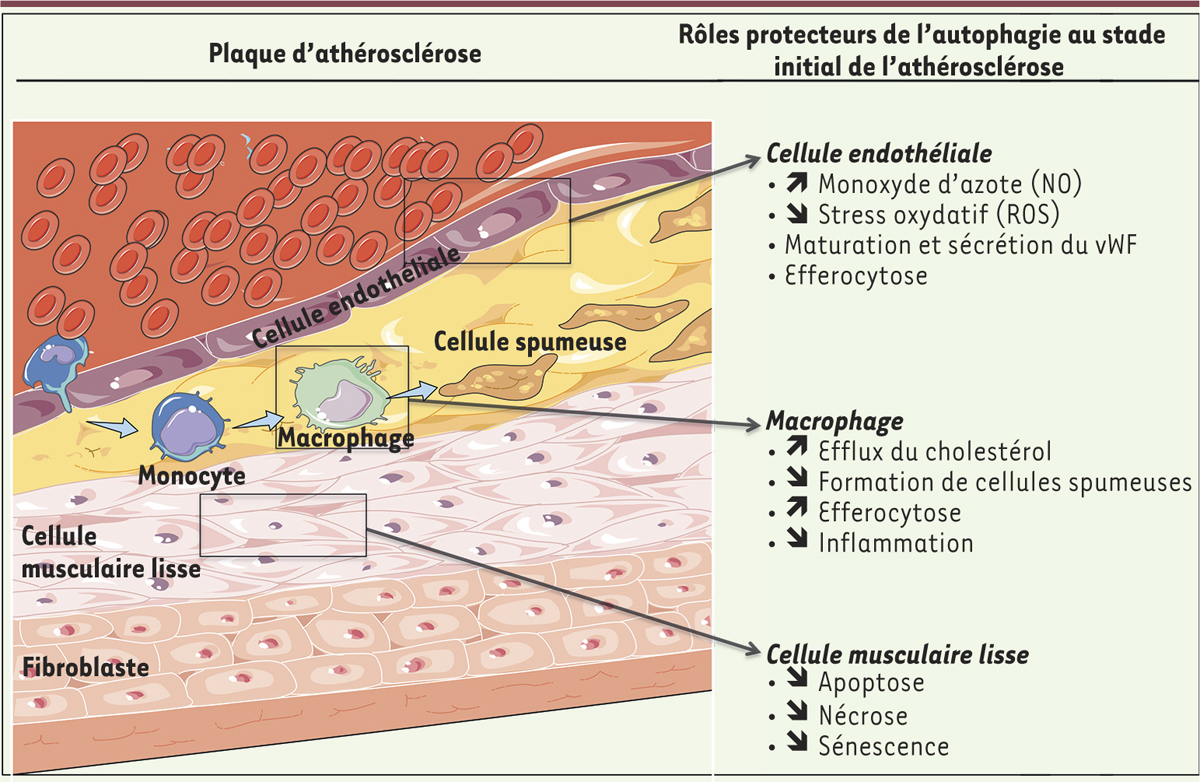
Martinet W, De Meyer GR. Autophagy in atherosclerosis: a cell survival and death phenomenon with therapeutic potential . Circ Res. 2009; ; 104 : :304.–317.
37.
Muller C, Salvayre R, Negre-Salvayre A, Vindis C. Oxidized LDLs trigger endoplasmic reticulum stress and autophagy : prevention by HDLs . Autophagy. 2011; ; 7 : :541.–543.
38.
Jia G, Cheng G, Gangahar DM, Agrawal DK. Insulin-like growth factor-1 and TNF-alpha regulate autophagy through c-jun N-terminal kinase and Akt pathways in human atherosclerotic vascular smooth cells . Immunol Cell Biol. 2006; ; 84 : :448.–454.
39.
He C, Zhu H, Zhang W, et al. 7-Ketocholesterol induces autophagy in vascular smooth muscle cells through Nox4 and Atg4B . Am J Pathol. 2013; ; 183 : :626.–637.
40.
Ouimet M, Franklin V, Mak E, et al. Autophagy regulates cholesterol efflux from macrophage foam cells via lysosomal acid lipase . Cell Metab. 2011; ; 13 : :655.–667.
41.
Wang X, Li L, Niu X, et al. mTOR enhances foam cell formation by suppressing the autophagy pathway . DNA Cell Biol. 2014; ; 33 : :198.–204.
42.
Le Guezennec X, Brichkina A, Huang YF, et al. Wip1-dependent regulation of autophagy, obesity, and atherosclerosis . Cell Metab. 2012; ; 16 : :68.–80.
43.
Liao X, Sluimer JC, Wang Y, et al. Macrophage autophagy plays a protective role in advanced atherosclerosis . Cell Metab. 2012; ; 15 : :545.–553.
44.
Razani B, Feng C, Coleman T, et al. Autophagy links inflammasomes to atherosclerotic progression . Cell Metab. 2012; ; 15 : :534.–544.
45.
Xu K, Yang Y, Yan M, et al. Autophagy plays a protective role in free cholesterol overload-induced death of smooth muscle cells . J Lipid Res. 2010; ; 51 : :2581.–2590.
46.
Grootaert MO, da Costa Martins PA, Bitsch N, et al. Defective autophagy in vascular smooth muscle cells accelerates senescence and promotes neointima formation and atherogenesis . Autophagy. 2015; ; 11 : :2014.–2032.
47.
LaRocca TJ, Henson GD, Thorburn A, et al. Translational evidence that impaired autophagy contributes to arterial ageing . J Physiol. 2012; ; 590 : :3305.–3316.
48.
Torisu T, Torisu K, Lee IH, et al. Autophagy regulates endothelial cell processing, maturation and secretion of von Willebrand factor . Nat Med. 2013; ; 19 : :1281.–1287.
49.
Torisu K, Singh KK, Torisu T, et al. Intact endothelial autophagy is required to maintain vascular lipid homeostasis . Aging Cell. 2016; ; 15 : :187.–191.
50.
Jeffery TK, Morrell NW. Molecular and cellular basis of pulmonary vascular remodeling in pulmonary hypertension . Prog Cardiovasc Dis. 2002; ; 45 : :173.–202.
51.
Lee SJ, Smith A, Guo L, et al. Autophagic protein LC3B confers resistance against hypoxia-induced pulmonary hypertension . Am J Respir Crit Care Med. 2011; ; 183 : :649.–658.
52.
Long L, Yang X, Southwood M, et al. Chloroquine prevents progression of experimental pulmonary hypertension via inhibition of autophagy and lysosomal bone morphogenetic protein type II receptor degradation . Circ Res. 2013; ; 112 : :1159.–1170.
53.
Zheng YH, Tian C, Meng Y, et al. Osteopontin stimulates autophagy via integrin/CD44 and p38 MAPK signaling pathways in vascular smooth muscle cells . J Cell Physiol. 2012; ; 227 : :127.–135.
54.
Rouer M, Xu BH, Xuan HJ, et al. Rapamycin limits the growth of established experimental abdominal aortic aneurysms . Eur J Vasc Endovasc Surg. 2014; ; 47 : :493.–500.
55.
Ramadan A, Wheatcroft MD, Quan A, et al. Effects of long-term chloroquine administration on the natural history of aortic aneurysms in mice . Can J Physiol Pharmacol. 2015; ; 93 : :641.–648.
56.
La Morel E. formation de l’autophagosome : un nouveau défi pour le biologiste cellulaire . Med Sci (Paris). 2017; ; 33 : :217.–220.
57.
Vigié P, Camougrand N. Mitophagie et contrôle qualité des mitochondries . Med Sci (Paris). 2017; ; 33 : :231.–237.