| |
| Med Sci (Paris). 33(3): 226–229. doi: 10.1051/medsci/20173303007.L’autophagie, acteur clé de la leucémogenèse et cible thérapeutique dans les hémopathies malignes Arnaud Jacquel,1 Frédéric Luciano,1 Alexandre Puissant,1 Guillaume Robert,1 and Patrick Auberger1* 1Inserm U1065 (C3M), Université Nice Côte d’Azur, Hôpital de l’Archet, bâtiment Archimed, 151 route de St-Antoine de Ginèstière, 06204Nice, France |
Autophagie et homéostasie des cellules souches hématopoïétiques Les progrès récents dans l’identification du statut mutationnel des hémopathies malignes ont permis la mise en évidence de nouvelles altérations des voies métaboliques et de signalisation impliquées dans la leucémogenèse. Dans ce contexte, l’autophagie est devenue un domaine d’investigation majeur pour son rôle dans la progression et la résistance des leucémies aux thérapies anticancéreuses [15] (→).
(→) Voir la Synthèse de C. Joffre et al., page 328 de ce numéro
L’autophagie est un mécanisme adaptatif de recyclage de macromolécules ou d’organelles endommagées dans des conditions de stress cellulaire. Elle est impliquée dans des processus physiologiques tels que l’homéostasie et la différenciation des cellules souches hématopoïétiques (CSH) et la balance survie/mort cellulaire, fonctions intimement liées à la tumorigenèse. Dans des conditions de stress, ou lors d’une chimiothérapie, l’autophagie induit la nucléation de novo d’une vésicule, le phagophore dont les extrémités se joignent pour former un autophagosome, organite délimité par une double membrane séquestrant les constituants cytoplasmiques à dégrader. L’autophagosome fusionne ensuite avec un lysosome qui délivre les hydrolases nécessaires à la dégradation du contenu de l’autolysosome ainsi généré (Figure 1). La biogenèse de l’autophagosome dépend de la mise en place de complexes protéiques composés de protéines ATG (autophagy related) qui se lient successivement et transitoirement à la membrane de l’autophagosome. La biogenèse du phagophore nécessite notamment la sérine/thréonine kinase ULK1 (Unc-51-like autophagy-activating kinase 1) et les protéines ATG13, FIP200 (FAK family kinase-interacting protein of 200 kDa) et ATG101. La nucléation du phagophore requiert le complexe ATG6/Beclin-1/ATG14L/VPS34 ou PI3KCIII(class III phosphoinositide 3-kinase)/VPS15. L’élongation et la fermeture de l’autophagosome requièrent pour leur part deux systèmes de conjugaison ATG5-ATG12 et ATG8/MAP1LC3 (microtubule-associated proteins 1A/1B light chain 3) (Figure 1). En plus de son rôle dans le recyclage de macromolécules, l’autophagie participe à des fonctions physiologiques cruciales telles que l’homéostasie des CSH, la différenciation, la mort, la survie, le cycle cellulaire et le contrôle de la qualité des macromolécules et des organelles intracellulaires, pour ne citer que quelques exemples. Cette pléiade de fonctions rend très certainement compte du rôle clé de ce processus dans la leucémogenèse et dans la résistance des leucémies aux chimiothérapies.
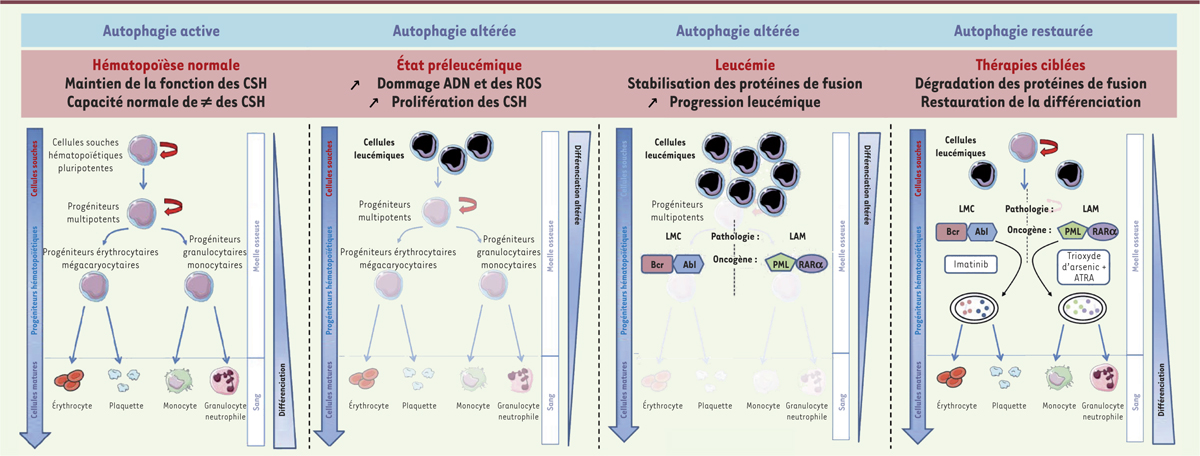
 | Figure 1.
Des altérations de l’autophagie peuvent favoriser la leucémogenèse. Une autophagie fonctionnelle est requise pour la différenciation physiologique des CSH et la production des différents lignages hématopoïétlques. Des déficits du processus autophaglque sont à l’origine d’une accumulation des espèces réactives de l’oxygène (ROS) et de dommages à l’ADN, propices à la transition des CSH d’un état normal à un état pré-leucémique. Dans un second temps, l’accumulation de mutations, l’actlvatlon de différentes voles de survie et la stabilisation de protéines de fusion contribuent à la progression leucémique. Dans le cas de la leucémie promyélocytalre et de la leucémie myéloïde chronique, les traitements ciblés vont activer I’autophagie qui participe à la dégradation des protéines de fusion, conduisant à une restauration de la différenciation myéloïde. CSH : cellule souche hématopoïétlque ; CSL : cellule souche leucémique ; PM : progénlteurs myéloïdes ; PEM : progénlteurs érythro-mégacaryocytalres ; PMG : progénlteurs myélo-granulocytalres ; LMC : leucémie myéloïde chronique ; PML : leucémie promyélocytalre ; LAM : leucémie aiguë myéloïde ; RARα : retinoic acid receptor alpha ; ATRA : acide tout-trans rétinoïque ; Abl : Abelson murine leukemia viral oncogene homolog 1 ; Bcr : breakpoint cluster region protein. |
|
Autophagie et leucémogenèse L’autophagie est requise pour le maintien des CSH murines. La délétion de FIP200, d’ATG7 ou d’ATG5 altère le potentiel de survie et la transplantabilité des CSH. Les cellules Lin-Sca1+-Kit issues de souris dont le gène ATG7 a été invalidé conditionnellement (Vav-ATG7−/−) présentent un avantage prolifératif, responsable d’un phénotype pré-leucémique [1]. Par ailleurs, la perte d’hétérozygotie d’ATG5 favorise la progression tumorale dans un modèle murin de leucémie aiguë myéloïde (LAM) dépendant de la protéine de fusion MLL-ENL1 [2]. Ces observations attestent que l’inhibition de l’autophagie participe à la leucémogenèse. La dégradation par autophagie de NOTCH-IC, la forme active intracellulaire libre de NOTCH, pourrait rendre compte au moins en partie des défauts de fonctionnalité des CSH [3]. Ainsi, les cellules de moelle osseuse des souris Vav-ATG7-/- présentent des taux accrus de NOTCH-IC et l’altération de Notch, dans un contexte de déficience en autophagie, restaure la capacité de différenciation des CSH [4]. Ces résultats montrent que l’activation de l’autophagie module des voies de signalisation impliquées dans la prolifération et la différenciation des CSH et que des altérations de ce processus sont susceptibles de faire basculer les CSH d’un statut normal à un statut pré-leucémique. De fait, le profil d’expression de certains gènes ATG se retrouve modulé dans les blastes de patients atteints de LAM et représente un marqueur prédictif de survie globale. Ainsi, l’expression de WIPI-1 (WD repeat domain phosphoinositide-interacting protein 1), un gène impliqué dans la nucléation du phagophore, est réduite dans les blastes d’une cohorte de patients atteints de LAM par rapport à des donneurs sains. Par ailleurs, de nombreux gènes clés de l’autophagie sont localisés au sein de régions communément délétées dans les LAM. Ainsi, l’expression d’ATG12 est diminuée chez les patients atteints de LAM de novo. L’expression de GABARAPL1 et 2 (GABA[type A] receptor-associated protein 1/2) et de MAP1LC3B est réduite dans les blastes de LAM par rapport à la même population myéloïde issue de donneurs sains, ainsi que dans ceux de patients porteurs des translocations AML1 (acute myelogenous leukemia 1)-ETO (ou RUNX1T1 [RUNX1 translocation partner 1]) et PML (promyelocytic leukemia)-RARA (récepteur alpha de l’acide rétinoïque). A contrario, bien que l’inhibition de l’autophagie accélère le développement des LAM, la délétion d’ATG7 ou d’ATG4B altère la viabilité des cellules souches de leucémie myéloïde chronique (LMC) [5, 6]. De plus, l’expression de 5 gènes, ATG4A, ATG4B, ATG4C, ATG5, et BECLIN-1, est augmentée dans ces cellules par rapport aux cellules souches normales, confirmant un rôle différent de l’autophagie entre les LAM et la LMC. Ce paradoxe apparent pourrait trouver son explication dans l’origine de la cellule souche affectée, le moteur de la transformation oncogénique, et le stade de la leucémie (initiation ou progression). |
Autophagie et dégradation de protéines de fusion associées aux leucémies Une autre spécificité de l’autophagie est la dégradation des protéines codées par des translocations spécifiques des leucémies [7, 8]. L’inhibition de l’autophagie permettrait ainsi la stabilisation de ces protéines de fusion oncogéniques. L’acide rétinoïque (ATRA), seul ou en combinaison avec le trioxide d’arsenic (ATO), restaure la différenciation des cellules de leucémie promyélocytaire (LAM3) porteuses de la translocation PML-RARA [8]. La rémission complète des LAM3 nécessite la dégradation totale de PML-RARA, un processus dépendant de l’autophagie. Un mécanisme identique sous-tend la dégradation de BCR-ABL, sous l’action de l’ATO, dans la LMC. En effet, dans ce contexte, la protéine de fusion BCR-ABL est prise en charge par P62SQSTM1 (séquestosome-1), ce qui favorise sa dégradation par autophagie. Une forme constitutivement active de FLT3 (fms-like tyrosine kinase 3), FLT3-ITD (présentant une duplication en tandem interne dans son domaine juxta-membranaire) retrouvée dans 30 % des LAM est également degradée par autophagie en réponse au bortezomib (Btz), un inhibiteur du protéasome [9]. Finalement, certaines protéines impliquées dans la leucémogenèse sont également catabolisées par une forme très sélective d’autophagie, l’autophagie relayée par les chaperonnes (ou CMA). C’est le cas notamment de la protéine MLLT11 (myeloid/lymphoid or mixed-lineage leukemia ; translocated to, 11 ; ou AF1Q), impliquée dans la translocation t(1 ; 11) dans les LAM [10]. |
Ciblage de l’autophagie dans les hémopathies malignes Dès lors que l’autophagie favorise la leucémogenèse et la résistance aux traitements, il est rapidement apparu que son ciblage pouvait représenter une option thérapeutique pertinente dans certaines hémopathies malignes. Nous aborderons, à titre d’exemple, les hémopathies myéloïdes et les hémopathies B. Les hémopathies myéloïdes Le traitement conventionnel des LAM est la combinaison anthracyclines/cytarabine. La cytarabine induit une autophagie cytoprotectrice dans les blastes de LAM sans altérer les leucocytes normaux. L’hydroxychloroquine, un inhibiteur de l’autophagie, induit la mort de lignées cellulaires résistantes à la cytarabine sans affecter les lignées sensibles, confirmant que l’activation de l’autophagie est un des mécanismes de résistance à cette drogue. En conséquence, l’inhibition de l’autophagie, par la bafilomycine A1 (BafA1) ou par la chloroquine, augmente la cytotoxicité de la cytarabine dans les cellules de LAM [ 11]. S100A8, un membre de la famille des protéines S100 liant le calcium, joue un rôle important dans la résistance aux drogues reposant sur l’autophagie dans les LAM. S100A8 est surexprimée dans les lignées leucémiques résistantes. En interagissant avec Beclin-1, elle favorise la formation du complexe Beclin-1/VPS34, activant ainsi l’autophagie. L’inhibition de S100A8 bloque l’autophagie et augmente la sensibilité des cellules leucémiques à l’arsenic trioxide (ATO) [ 12]. Finalement, le blocage de la voie Hedgehog 2 déclenche l’autophagie dans les cellules de LMC. L’inhibition combinée de l’autophagie et de la voie Hedgehog favorise ainsi la mort des cellules de LMC sensibles ou résistantes à l’imatinib [ 13]. Les hémopathies B Le bortezomib, inhibiteur du protéasome, est très efficace pour éliminer les cellules de leucémies aiguës lymphoblastiques B (LAL-B) et accroît leur sensibilité aux chimiothérapies conventionnelles. Il favorise la formation du complexe Beclin-1/VPS34, ce qui contribue à activer l’autophagie. À l’inverse, l’inhibition de l’autophagie augmente fortement son effet anti-leucémique dans les LAL-B. Dans le myélome multiple (MM), il induit l’accumulation d’agrégats protéiques ; le stress du réticulum endoplasmique qui s’en suit, active l’UPR ( unfolded protein response) et l’autophagie, comme mécanismes compensatoires, afin de restaurer l’homéostasie protéique. Un criblage à grande échelle a établi que la metformine, un agent anti-diabétique, inhibe l’autophagie induite par le bortezomib et augmente l’effet anti-myélome de ce médicament, confirmant la pertinence thérapeutique de cibler simultanément les voies du protéasome et de l’autophagie dans le MM [ 14]. |
En dépit du rôle versatile de l’autophagie dans la tumorigenèse, son inhibition s’avère de plus en plus une option thérapeutique pertinente afin d’améliorer l’efficacité des protocoles anti-leucémiques. La chloroquine et l’hydroxychloroquine sont actuellement testées dans une quarantaine d’essais cliniques dans les tumeurs solides et hématopoïétiques. Plusieurs études cliniques évaluent actuellement l’effet de l’hydroxychloroquine en association avec la mitoxantrone et l’étoposide, dans les LAM (NCT02631252), avec l’imatinib, dans la LMC (NCT01227135), et avec le bortezomib, dans le MM (NCT00568880). Les effets de la chloroquine et de l’hydroxychloroquine étant probablement beaucoup plus larges que la simple inhibition de l’autophagie, les futurs essais cliniques devront intégrer des inhibiteurs plus sélectifs de l’autophagie afin de confirmer le bénéfice du ciblage de ce processus pour le traitement des hémopathies malignes. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Liu Fm, Lee JYm, Wei H. et al. FIP200 is required for the cell-autonomous maintenance of fetal hematopoietic stem cells . Blood. 2010; ; 116 : :4806.–4814. 2.
Mortensen Mm, Soilleux EJm, Djordjevic G. et al. The autophagy protein Atg7 is essential for hematopoietic stem cell maintenance . J Exp Med. 2011; ; 208 : :455.–467. 3.
Cao Ym, Cai Jm, Zhang S. et al. Autophagy sustains hematopoiesis through targeting notch . Stem Cells Dev. 2015; ; 24 : :2660.–2673. 4.
Brigger Dm, Proikas-Cezanne Tm, Tschan MP. et al. WIPI-dependent autophagy during neutrophil differentiation of NB4 acute promyelocytic leukemia cells . Cell Death Dis. 2014; ; 5 : :e1315.. 5.
Karvela Mm, Baquero Pm, Kuntz EM. et al. ATG7 regulates energy metabolism, differentiation and survival of Philadelphia-chromosome-positive cells . Autophagy. 2016; ; 12 : :936.–948. 6.
Rothe Km, Lin Hm, Lin KB. et al. The core autophagy protein ATG4B is a potential biomarker and therapeutic target in CML stem/progenitor cells . Blood. 2014; ; 123 : :3622.–3634. 7.
Isakson Pm, Bjoras Mm, Boe SOm, Simonsen A. Autophagy contributes to therapy-induced degradation of the PML/RARA oncoprotein . Blood. 2010; ; 116 : :2324.–2331. 8.
Goussetis DJm, Gounaris Em, Wu EJ. et al. Autophagic degradation of the BCR-ABL oncoprotein and generation of antileukemic responses by arsenic trioxide . Blood. 2012; ; 120 : :3555.–3562. 9.
Larrue Cm, Saland Em, Boutzen H. et al. Proteasome inhibitors induce FLT3-ITD degradation through autophagy in AML cells . Blood. 2016; ; 127 : :882.–892. 10.
Li Pm, Ji Mm, Lu F. et al. Degradation of AF1Q by chaperone-mediated autophagy . Exp Cell Res. 2014; ; 327 : :48.–56. 11.
Palmeira dos Santos Cm, Pereira GJm, Barbosa CM. et al. Comparative study of autophagy inhibition by 3MA and CQ on Cytarabine induced death of leukaemia cells . J Cancer Res Clin Oncol. 2014; ; 140 : :909.–920. 12.
Yang Mm, Zeng Pm, Kang R. et al. S100A8 contributes to drug resistance by promoting autophagy in leukemia cells . PLoS One. 2014; ; 9 : :e97242.. 13.
Zeng Xm, Zhao Hm, Li Y. et al. Targeting Hedgehog signaling pathway and autophagy overcomes drug resistance of BCR-ABL-positive chronic myeloid leukemia . Autophagy. 2015; ; 11 : :355.–372. 14.
Jagannathan Sm, Abdel-Malek MAm, Malek E. et al. Pharmacologic screens reveal metformin that suppresses GRP78-dependent autophagy to enhance the anti-myeloma effect of bortezomib . Leukemia. 2015; ; 29 : :2184.–2191. 15.
Joffre Cm, Djavaheri-Mergny Mm, Pattingre Sm, Giuriato S. L’autophagie : le yin et le yang des cancers . Med Sci (Paris). 2017; ; 33 : :328.–334. |