| |
| Med Sci (Paris). 33(3): 221–224. doi: 10.1051/medsci/20173303005.L’autophagie, un processus clé dans l’homéostasie osseuse Olivier Camuzard,1 Sabine Santucci-Darmanin,1 Georges F. Carle,1 and Valérie Pierrefite-Carle1* 1UMR E-4320 TIRO-MATOs CEA/DRF/BIAM, Université Nice Sophia Antipolis, faculté de médecine, 28, avenue de Valombrose, 06107Nice Cedex, France |
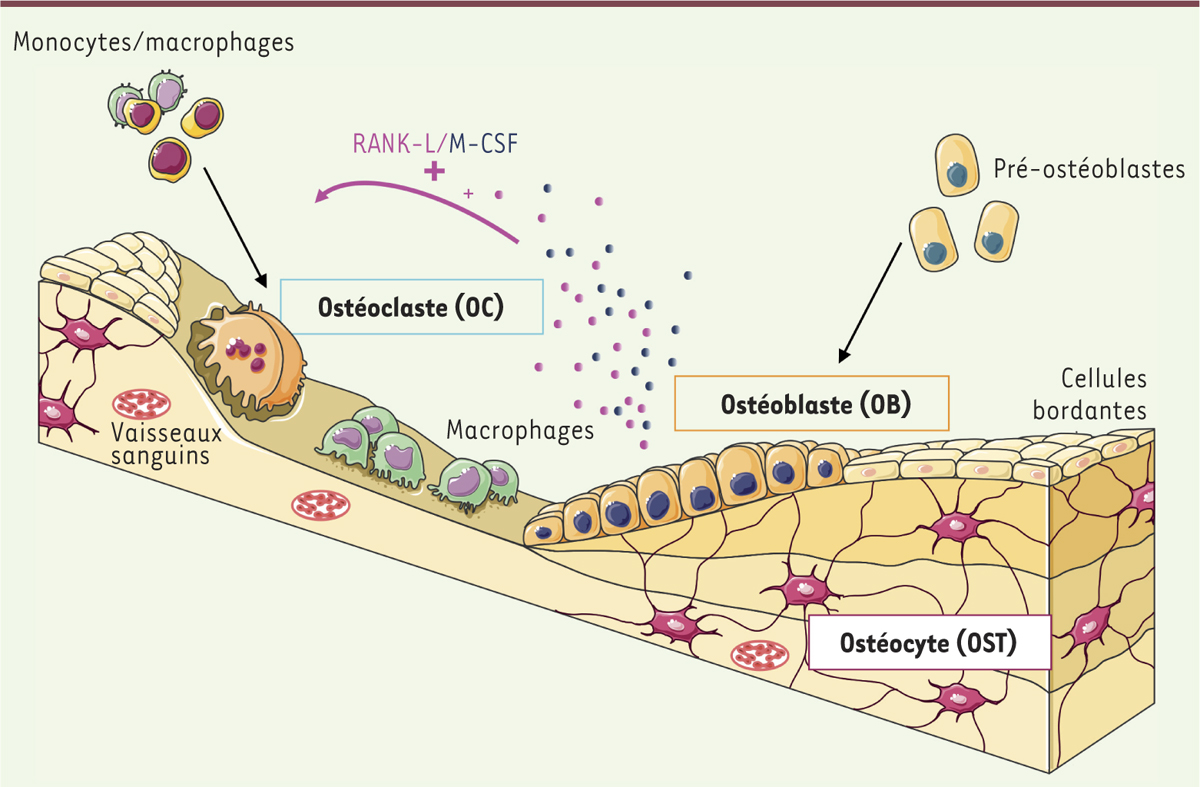
Le tissu osseux est en perpétuel renouvellement. Le remodelage de l’os est réalisé grâce à plusieurs types de cellules : les ostéoclastes (OC), impliqués dans la résorption de la matrice osseuse, les ostéoblastes (OB) en charge de la production de cette matrice, et les ostéocytes (OST) qui sont actuellement considérés comme les chefs d’orchestre du processus de remodelage [1] (Figure 1). En condition normale, il existe un équilibre entre l’activité de résorption des OC et l’activité de formation des OB. Toute modification de cet équilibre conduit à une pathologie.
 | Figure 1.
Le remodelage osseux. L’os est un tissu vascularisé en perpétuelle régénération grâce à l’action des ostéoclastes (OC), chargés de la résorption, et des ostéoblastes (OB), chargés de la formation de la matrice osseuse. Ces actions sont sous le contrôle des ostéocytes (OST), issus de la différenciation terminale des OB, qui sont organisés en réseau dans la matrice minéralisée et qui coordonnent le remodelage. L’os est un tissu de stockage qui est la principale source de minéraux de l’organisme. Les OB et les OST produisent les cytokines RANK-L (receptor activator of NFkB ligand) et M-CSF (macrophage colony-stimulating factor) qui sont nécessaires pour la différenciation ostéoclastique. Après résorption par les OC et « nettoyage » par des macrophages, une nouvelle matrice osseuse sera formée par les OB. Les OB pourront ensuite être éliminés par apoptose, se mettre au repos sous la forme de cellules bordantes, ou devenir des OST, emmurés dans la matrice (adapté de Servier Medical Art).
|
La macroautophagie (autophagie) est un processus catabolique majeur dans les cellules eucaryotes, qui permet la dégradation et le recyclage des macromolécules et des organites endommagées [2]. Un lien a été récemment décrit entre l’autophagie et certains processus de sécrétion, les vésicules autophagiques pouvant être détournées de leur voie de dégradation vers une voie de sécrétion [3]. Le rôle de l’autophagie dans l’os n’a été que récemment exploré. De façon intéressante, plusieurs inducteurs d’autophagie comme la rapamycine, le resvératrol, le lithium et la spermidine présentent des effets bénéfiques sur le tissu osseux [4]. Inversement, certains composés anaboliques osseux comme la vitamine D ou les biphosphonates ont récemment été décrits pour être également inducteurs d’autophagie dans différents types cellulaires [4]. |
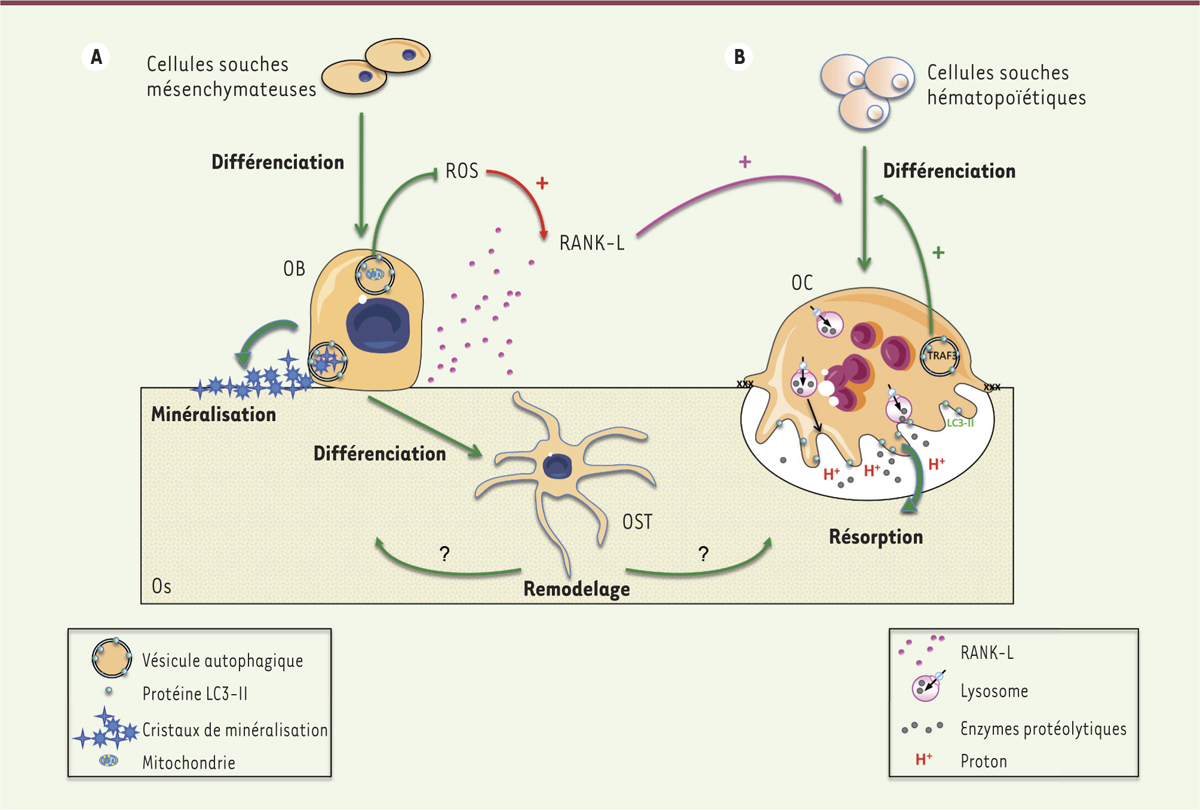
Autophagie dans les ostéoblastes et les ostéocytes Les ostéoblastes sont d’origine mésenchymateuse. Ils ont pour fonction de synthétiser et de minéraliser la matrice osseuse. Les ostéocytes dérivent, eux, des ostéoblastes. Ils sont emmurés dans la matrice osseuse et pilotent l’ensemble du processus de remodelage. Ces cellules, qui vivent plusieurs années chez l’homme, sont les plus abondantes du tissu osseux. Elles communiquent entre elles dans la matrice osseuse via des prolongements au sein d’un réseau appelé « réseau lacuno-canaliculaire ». Les premières études in vitro portant sur le rôle de l’autophagie dans les cellules osseuses, ont mis en évidence une induction de ce processus lors de la différenciation et de la minéralisation par les ostéoblastes [5, 6]. Notre équipe a ainsi montré la présence, dans ces cellules, de vésicules autophagiques, contenant des structures cristallines en forme d’aiguilles constituées d’hydroxyapatite, dont le contenu est libéré dans le milieu extracellulaire. La minéralisation intracellulaire, qui est décrite comme l’un des processus de la minéralisation osseuse, apparaît donc reposer sur l’autophagie, les vésicules autophagiques servant de « véhicules » pour la sécrétion des cristaux de minéralisation [6] (Figure 2A).
 | Figure 2.
Rôle de l’autophagie dans l’homéostasie osseuse. A. Rôle de l’autophagie dans les ostéoblastes (OB) et les ostéocytes (OST). L’autophagie est impliquée dans la différenciation des OB ainsi que dans le processus de minéralisation de la matrice, les vésicules autophagiques servant de « véhicules » pour sécréter les cristaux de minéralisation. L’autophagie, via l’élimination des mitochondries endommagées, limite également la production de radicaux libres oxygénés (ROS, reactive oxygen species) qui stimulent la synthèse de RANK-L (receptor activator of NFkB ligand) et favorisent l’ostéoclastogenèse. L’autophagie joue aussi un rôle dans la différenciation des OB en OST, en particulier dans la formation du réseau lacuno-canaliculaire. Enfin, dans les OST, elle participe au maintien d’un remodelage efficace. B. Rôle de l’autophagie dans les ostéoclastes (OC). L’autophagie, via la dégradation de TRAF3 (TNF receptor associated factor 3), stimule la différenciation des OC. Les protéines de l’autophagie ATG5, ATG7, ATG4B et LC3 (microtubule-associated protein 1A/1B-light chain 3) sont nécessaires pour la différenciation et l’activité de résorption des OC, avec en particulier la relocalisation de la protéine LC3-II sur la bordure en brosse, qui est nécessaire pour une résorption efficace. |
Ces observations ont été confirmées in vivo dans différents modèles murins. Ainsi, la délétion du gène de l’autophagie FIP200 (FAK family kinase-interacting protein of 200 kDa) dans les progéniteurs ostéoblastiques de souris induit un phénotype ostéopénique, une réduction de la formation osseuse et du volume d’os trabéculaire [5]. Ce phénotype s’accompagne d’une diminution du nombre d’ostéoblastes, le nombre d’ostéoclastes n’étant pas modifié, suggèrant que la délétion de FIP200 compromet la différenciation terminale des ostéoblastes. Parallèlement, la délétion du gène de l’autophagie Atg5 (autophagy-related gene 5), dans les ostéoblastes, induit une diminution de la minéralisation osseuse et du volume d’os trabéculaire associée à une réduction significative du rapport OB/OC chez des souris âgées de 9 mois. Chez ces animaux, le défaut d’autophagie dans les ostéoblastes altère le dialogue avec les ostéoclastes, favorisant leur formation via une augmentation du stress oxydatif et de la production de la cytokine RANK-L (receptor activator of NF-kB ligand) [6]. De même, la délétion du gène Atg7 dans les progéniteurs ostéoblastiques se traduit par un phénotype similaire, associé à un nombre réduit d’ostéoblastes et d’ostéoclastes, ainsi qu’un changement morphologique du réseau lacuno-canaliculaire des ostéocytes [7]. De par leur longévité et leur localisation au sein de la matrice osseuse, les ostéocytes présentent un fort niveau basal d’autophagie, celle-ci étant stimulée en réponse à l’hypoxie et la privation de nutriments [4]. Dans ces cellules, l’autophagie est également induite après ovariectomie chez le rat, vraisemblablement en raison d’une augmentation du stress oxydatif associé à la carence œstrogénique [4]. In vivo, la délétion du gène Atg7 dans les ostéocytes induit une diminution du volume d’os trabéculaire qui est associée à une réduction du nombre d’ostéoblastes et d’ostéoclastes chez des souris âgées de 6 mois. Ces résultats suggèrent que la suppression de l’autophagie dans les ostéocytes conduit à une baisse du remodelage, ce qui mime le processus de vieillissement osseux [8]. |
Autophagie dans les ostéoclastes Les ostéoclastes dérivent de progéniteurs hématopoïétiques. Ils appartiennent à la lignée des monocytes-macrophages et proviennent de la fusion de précurseurs mononucléés. Ce sont des cellules multinucléées de grande taille, localisées à la surface du tissu osseux, qui présentent une activité de résorption de la matrice minéralisée. Le processus de différenciation ostéoclastique, qui est favorisé par le stress oxydatif, est sous le contrôle de deux cytokines produites par les ostéoblastes et les ostéocytes : le M-CSF (macrophage colony-stimulating factor) et RANK-L [1]. Les ostéoclastes sont responsables de la dissolution de la matrice osseuse minéralisée par la sécrétion polarisée, au travers d’une bordure en brosse formée sur leur membrane apicale, de protons et d’enzymes protéolytiques dans une lacune de résorption [1]. Un rôle de Beclin-1 a été identifié dans la différenciation des ostéoclastes induite par RANK-L, vraisemblablement via la production de radicaux libres oxygénés et l’expression du facteur de transcription NFATc1 (nuclear factor of activated T-cells, cytoplasmic 1), responsable de l’expression de gènes requis pour l’ostéoclastogenèse [4]. Par ailleurs, l’extinction du gène Atg7, dans des précurseurs hématopoïétiques, inhibe l’expression de marqueurs ostéoclastiques, ce qui suggère la participation de l’autophagie dans le processus de différenciation de ces cellules. Ces données restent cependant controversées car d’autres travaux montrent que l’extinction de LC3 (microtubule-associated protein 1A/1B-light chain 3), une autre protéine essentielle de l’autophagie, n’affecte pas l’ostéoclastogenèse, mais inhibe l’activité de résorption de ces cellules [4]. Enfin, l’autophagie intervient dans la dégradation de la protéine TRAF3 (tumor necrosis factor receptor associated factor 3), qui module négativement l’ostéoclastogenèse induite par RANK-L [9] (Figure 2B).
DeSelm et ses collaborateurs ont, par ailleurs, mis en évidence in vivo que certaines protéines de l’autophagie, comme ATG5, ATG7, ATG4B et LC3, exerçaient des fonctions indépendantes de l’autophagie mais nécessaires à la formation de la bordure en brosse, l’activité de sécrétion et la résorption osseuse [10]. LC3 est en effet relocalisée, au cours du processus, au niveau de la bordure en brosse avec pour effet de diriger la fusion des lysosomes vers cette zone spécifique. Cette étude révèle également que la délétion du gène Atg5 dans les ostéoclastes conduit à une augmentation de masse osseuse et diminue la perte osseuse causée par l’ovariectomie [10]. |
Conclusions et perspectives L’ensemble de ces résultats indique donc que l’autophagie, via la dégradation de matériel cytoplasmique (mitochondries, protéines telles que TRAF3, etc.), la sécrétion du contenu des vésicules autophagiques (les cristaux de minéralisation dans les ostéoblastes) ou le rôle de certaines protéines ATG (impliquées dans l’activité de résorption des ostéoclastes), est un processus fondamental pour l’homéostasie osseuse. Une altération de l’autophagie, ou des mutations de certaines protéines de l’autophagie, ont d’ores et déjà été documentées dans différentes pathologies osseuses comme la maladie de Paget1,, l’ostéopétrose maligne infantile2, ou l’ostéoporose3, [4], identifiant l’autophagie comme une nouvelle voie cible de thérapeutiques prometteuses. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ces travaux ont été soutenus par des financements de la Société Française de Rhumatologie, du Groupe de Recherche et d’Information sur les Ostéoporoses, de l’association « Les Anges de Verre » et du Commissariat à l’énergie Atomique et aux énergies Alternatives.
|
Footnotes |
1.
Raggatt LJ, Partridge NC. Cellular and molecular mechanisms of bone remodeling . J Biol Chem. 2010; ; 285 : :25103.–25108. 2.
Mizushima N, Komatsu M. Autophagy: renovation of cells and tissues . Cell. 2011; ; 147 : :728.–741. 3.
Ponpuak M, Mandell MA, Kimura T, et al. Secretory autophagy . Curr Opin Cell Biol. 2015; ; 35 : :106.–116. 4.
Pierrefite-Carle V, Santucci-Darmanin S, Breuil V, et al. Autophagy in bone: Self-eating to stay in balance . Ageing Res Rev. 2015; ; 24 : :206.–217. 5.
Liu F, Fang F, Yuan H, et al. Suppression of autophagy by FIP200 deletion leads to osteopenia in mice through the inhibition of osteoblast terminal differentiation . J Bone Miner Res Off J Am Soc Bone Miner Res. 2013; ; 28 : :2414.–2430. 6.
Nollet M, Santucci-Darmanin S, Breuil V, et al. Autophagy in osteoblasts is involved in mineralization and bone homeostasis . Autophagy. 2014; ; 10 : :1965.–1977. 7.
Piemontese M, Onal M, Xiong J, et al. Low bone mass and changes in the osteocyte network in mice lacking autophagy in the osteoblast lineage . Sci Rep. 2016; ; 6 : :24262.. 8.
Onal M, Piemontese M, Xiong J, et al. Suppression of autophagy in osteocytes mimics skeletal aging . J Biol Chem. 2013; ; 288 : :17432.–17440. 9.
Xiu Y, Xu H, Zhao C, et al. Chloroquine reduces osteoclastogenesis in murine osteoporosis by preventing TRAF3 degradation . J Clin Invest. 2014; ; 124 : :297.–310. 10.
DeSelm CJ, Miller BC, Zou W, et al. Autophagy proteins regulate the secretory component of osteoclastic bone resorption . Dev Cell. 2011; ; 21 : :966.–974. |