| |
| Med Sci (Paris). 33(3): 217–220. doi: 10.1051/medsci/20173303004.La formation de l’autophagosome Un nouveau défi pour le biologiste cellulaire Etienne Morel1,2* 1Institut Necker-Enfants Malades (INEM), Département de biologie cellulaire, Inserm U1151-CNRS UMR 8253, 14, rue Maria Helena Viera Da Silva, 75014Paris, France 2Université Paris Descartes-Sorbonne Paris Cité, F-75993, Paris, France |
L’autophagie : une voie de dégradation lysosomale pour gérer le contenu cellulaire L’autophagie (« se manger soi-même ») est un terme générique qui rassemble un ensemble de voies cataboliques en une définition commune, à savoir une dégradation – sélective ou non – de constituants cellulaires par le lysosome [1]. En ce sens, l’autophagie est une véritable force de frappe pouvant répondre à différentes situations de stress, et trouve naturellement sa place aux côtés des autres voies de dégradation et de recyclage spécialisées dans une cellule, comme le trafic endosomal (connecté également avec le lysosome), la phagocytose ou encore le protéasome. Plusieurs notions et appareillages spécifiques se retrouvent dans la définition de l’autophagie : la CMA (chaperone-mediated autophagy ou autophagie relayée par des protéines chaperonnes), spécialisée dans la dégradation de protéines cytosoliques par l’entremise directe de protéines lysosomales ; la micro-autophagie qui se caractérise par la capture de matériel cytoplasmique pendant la formation de vésicules internes au niveau endo-lysosomal ; et, enfin, la macro-autophagie (ou simplement appelée autophagie) qui regroupe les phénomènes de séquestration par un organelle à double membrane, caractéristique de l’autophagie, appelé autophagosome [2]. L’autophagie est ainsi essentielle à l’homéostasie cellulaire et tissulaire et participe à certaines étapes clés du développement [3]. Quel que soit son degré d’implication, il est désormais admis que l’autophagie joue un rôle important, parfois même essentiel, dans l’émergence et/ou l’évolution de nombreuses pathologies humaines, comme les cancers ou les maladies neurodégénératives (Alzheimer, Parkinson, etc.) [4, 5]. La biogenèse de l’autophagosome est un processus biologique complexe, conservé au cours de l’évolution chez les eucaryotes, qui fait appel à de nombreuses protéines, notamment les protéines de la famille ATG (autophagy-related), initialement identifiées dans des modèles de levures déficientes pour l’autophagie [6]. Ces protéines vont permettre la mise en place de séquences de signalisation et de remodelage membranaire ayant pour fonction finale la formation de l’autophagosome (une vésicule à double membrane), ainsi que la capture de fractions de cytoplasme pour assurer leur transport jusqu’au lysosome (une vésicule à simple membrane). Un tel processus, conditionné par des réponses cataboliques différentes en fonction des situations de stress subies par la cellule, est donc très finement contrôlé, de la formation de l’autophagosome jusqu’à son transport et à la fusion avec la membrane du lysosome en passant par la sélection et la séquestration du matériel destiné à la dégradation : cette dernière étape voit l’apparition d’un organelle hybride et transitoire, l’autophagolysosome [7, 8]. |
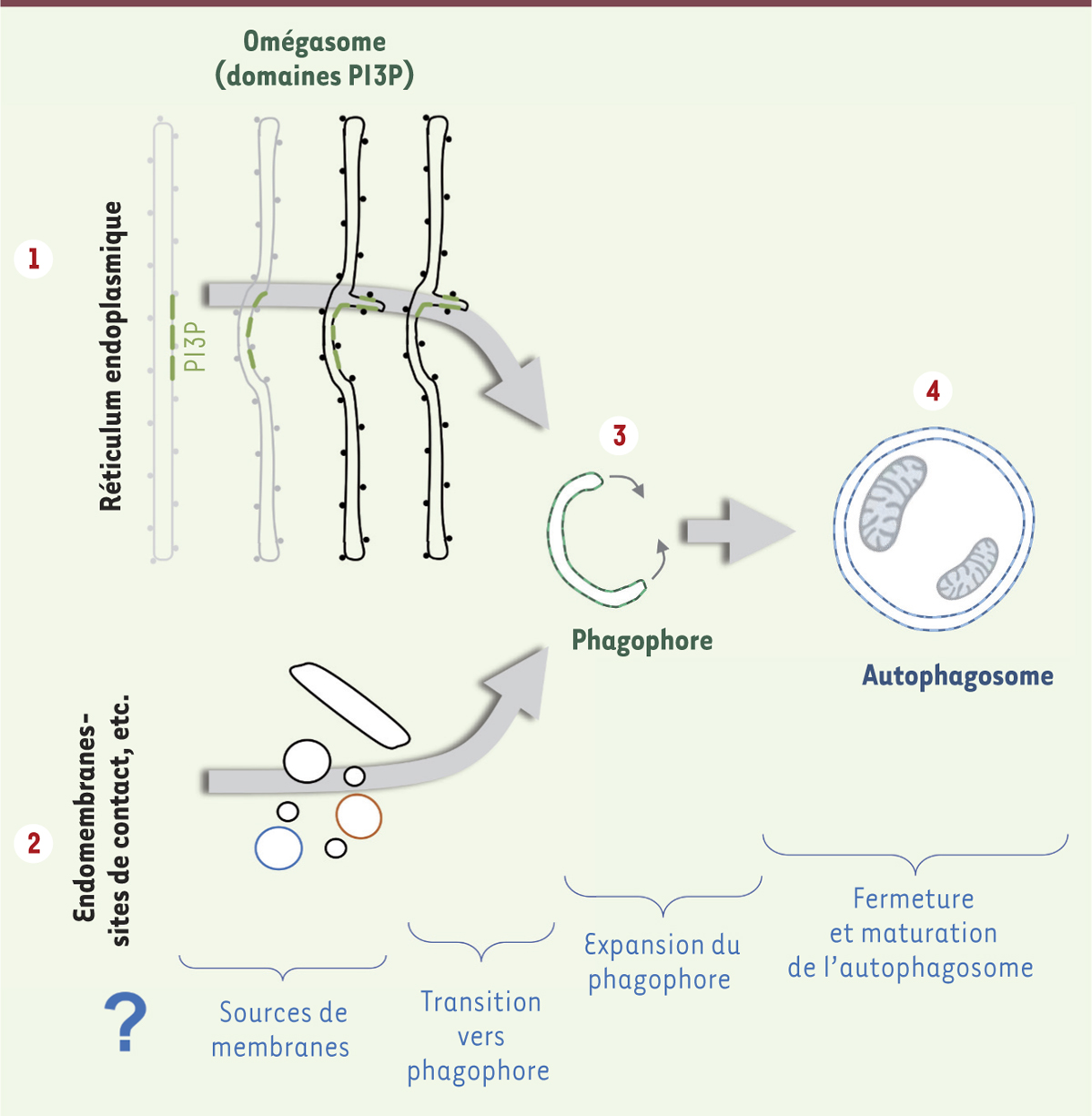
La biogenèse de l’autophagosome : une origine multi-membranaire et une régulation complexe La séquence précise d’événements conduisant à la formation de l’autophagosome est encore mal connue, malgré l’identification, ces dernières années, d’étapes préliminaires à la fermeture et à la fusion de cette structure à double membrane avec le lysosome. En effet, il a été suggéré qu’une zone spécialisée du réticulum endoplasmique (RE) était à l’origine du recrutement de nombreuses protéines ATG et initiait le processus de biogenèse de l’autophagosome. Cette zone du RE, enrichie en phosphatidylinositol-3-phosphate (PI3P), un lipide synthétisé par la kinase VPS34 (vacuolar protein sorting 34) (qui participe au complexe PI3kinase de classe III) et essentiel dans la dynamique membranaire endosomale et dans l’autophagie, est nommée omégasome en raison de sa structure particulière [9]. L’étape consécutive à la mobilisation de l’omégasome, correspond à la formation d’une structure en forme de coupe possédant déjà une double membrane, appelée phagophore (Figure 1). Le phagophore est une structure membranaire autonome, a priori sans contacts avec le RE, qui va subir des modifications et une élongation en forme de vésicule. La fermeture, tridimensionnelle, du phagophore conduit finalement à une vésicule close, à double membrane, l’autophagosome.
 | Figure 1.
Questions actuelles sur les étapes-clés de la formation de l’autophagosome. La biogenèse de l’autophagosome requiert un sous-domaine du réticulum endoplasmique (RE) enrichi en PI3P (phosphatidyl-inositol-3-phosphate) nommé omégasome (1). Cette zone du RE est à l’heure actuelle considérée comme une matrice possible pour la formation du phagophore (3), une structure à double membrane qui, après expansion et capture de matériel cytoplasmique, se referme par fusion membranaire et donne ainsi naissance à l’autophagosome mature (4). D’autres sources membranaires peuvent participer (2), de façon concomitante, parallèle ou directe, à la biogenèse du phagophore, telles que les mitochondries, les sites de contact RE-mitochondries, les gouttelettes lipidiques, la membrane plasmique ou encore les endosomes de recyclage. |
Le rôle du RE, via l’apparition de l’omégasome, semble acquis dans ces étapes très précoces mais il ne suffit probablement pas à fournir le matériel, notamment les membranes lipidiques, qui vont conduire à la formation d’un organite de taille importante : ainsi il a été montré récemment que plusieurs autres compartiments endomembranaires participaient, de façon directe ou indirecte, à « l’alimentation » en membranes afin d’initier la formation et/ou la maturation du phagophore (Figure 1). Les mitochondries, et plus particulièrement les sites de contact entre RE et mitochondries, participent en premier lieu activement à l’initiation de la biogenèse de l’autophagosome [10] ; cependant, il a également été démontré que l’appareil de Golgi [8, 11], la membrane plasmique et les endosomes [12, 13], notamment les endosomes de recyclage, qui assurent le transport et la connexion entre les endosomes précoces et la membrane plasmique [14], prennent part à la mise en place des échafaudages moléculaires nécessaires à la formation de l’autophagosome [15] (→).
(→) Voir la Nouvelle de K. Moreau, m/s n° 12, décembre 2011, page 1075
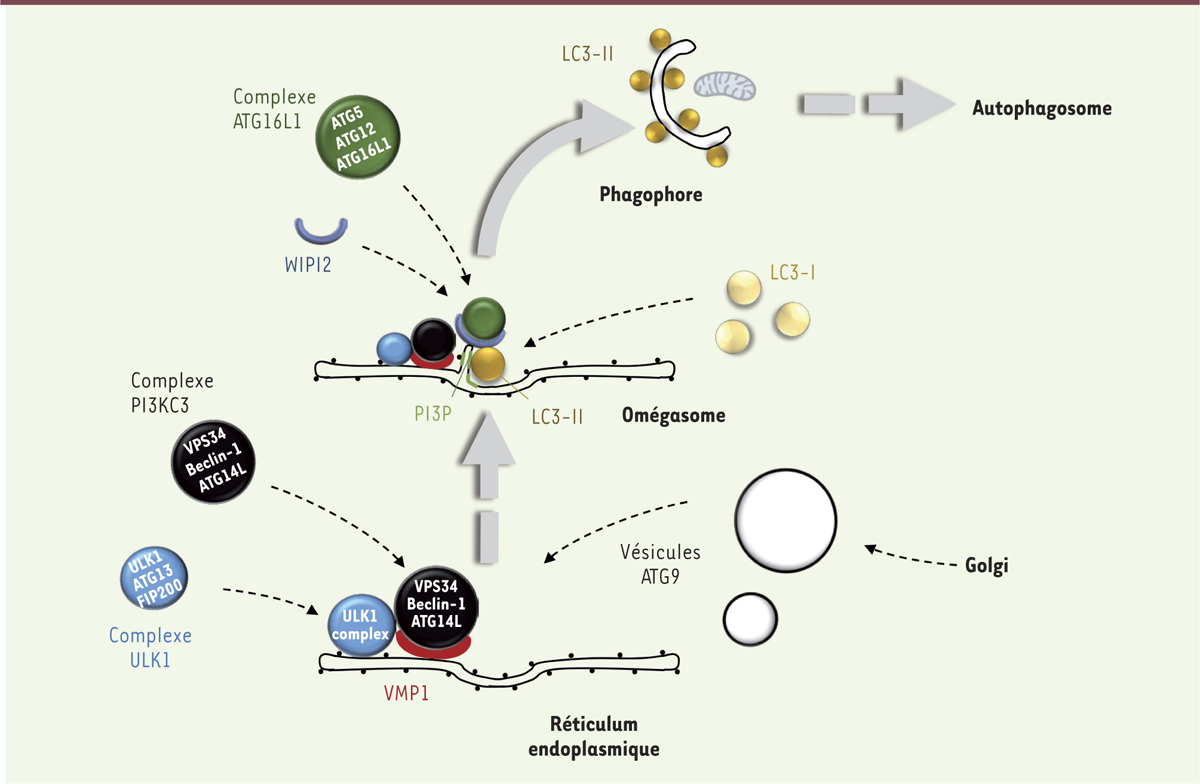
Enfin, comme précédemment cité, un ballet de protéines spécialisées, essentiellement des protéines ATG, régule finement les étapes liées à la mise en place de l’omégasome et du phagophore, de même que les étapes en amont de ces événements membranaires, lors de la (des) signalisation(s) de stress, notamment via les protéines ULK1/2 ([Unc]-51-like kinase 1/2), ATG13 et FIP200 (FAK family kinase-interacting protein of 200 kDa) qui dialoguent avec le complexe mTOR1 (mammalian target of rapamycin complex 1) [16] (Figure 2). Les premières protéines ATG (ou assimilées) à être recrutées lors des phases précoces de formation du futur phagophore sont des protéines régulatrices contrôlant l’adressage et les propriétés du complexe PI3kinase de classe III (également présent à la membrane de l’endosome précoce) composé de la protéine VPS34 et de la protéine accessoire VPS15/P150. Les protéines Beclin-1 (ATG6 chez la levure) et ATG14L sont requises pour l’adressage de VPS34 au futur site d’assemblage du phagophore afin d’y synthétiser un pool de PI3P, ce qui conduit à identifier l’omégasome [9]. Par la suite, un système moléculaire, relativement proche des processus d’ubiquitinylation, permet le recrutement séquentiel de protéines ATG dont la fonction principale est l’adressage de la protéine LC3 (microtubule-associated protein 1A/1B-light chain 3, ATG8 chez la levure) à la membrane de l’omégasome et/ou du phagophore. Les mieux caractérisées de ces protéines, dont certaines interagissent par conjugaison, sont ATG5, ATG12 et ATG16L1. ATG16L1 interagit notamment avec la protéine WIPI2 (WD repeat domain, phosphoinositide interacting 2, ATG18 chez la levure), cette dernière pouvant se fixer sur les zones membranaires enrichies en PI3P. Cette ultime étape, liant la membrane et le complexe ATG5-12-16L1, participe au recrutement de la protéine LC3 par conjugaison à une molécule de phosphatidyl-éthanolamine (PE) qui la stabilise sur la membrane (on parle alors de LC3II). Sous cette forme conjuguée, LC3 va rester associée au phagophore, puis à l’autophagosome mature et à l’autophagolysosome (Figure 2). Cette petite protéine, dont le rôle est encore mal cerné malgré son implication dans la fermeture du phagophore, est ainsi l’un des meilleurs marqueurs de l’autophagie et des structures membranaires qui lui sont liées.
 | Figure 2.
Le ballet des protéines ATG dans la biogenèse des membranes autophagosomales. Lors d’une induction d’autophagie par déprivation de nutriments, le complexe ULK1 (Unc-51-like autophagy activating kinase 1) est activé et recruté au niveau du réticulum endoplasmique (RE) où il permet l’adressage du complexe PI3KC3 (PI3 kinase de classe III, comprenant entre autres VPS34 [vacuolar protein sorting 34], Beclin-1 et ATG14L). À ce stade, des vésicules contenant la protéine ATG9 sont requises. Le complexe PI3KC3, après stabilisation par la protéine réticulaire VMP1 (vacuole membrane protein 1) permet probablement la synthèse d’un pool local de PI3P (phosphatidyl-inositol-3-phosphate) au niveau de l’omégasome. Par la suite, la protéine WIPI2 (WD repeat domain phosphoinositide-interacting protein 2) (qui peux s’associer spécifiquement au PI3P) est elle-aussi recrutée à l’omégasome où elle permet l’adressage du complexe ATG16L1 (ATG16L1, ATG5, ATG12) qui participe aux étapes clés de lipidation – et donc d’adressage membranaire – de la protéine LC3 (microtubule-associated protein 1A/1B-light chain 3). Celle-ci est ensuite concentrée au niveau du phagophore puis de l’autophagosome. |
|
Omégasome, phagophore et autophagosome : des modèles expérimentaux pour le biologiste cellulaire Comme on peut le voir, les événements moléculaires et membranaires qui conduisent à l’intégration d’un signal de stress cellulaire et à la formation d’un autophagosome sont désormais décrits, malgré certaines incohérences observées entre la chronologie des événements et l’ordre hiérarchique lors du recrutement des protéines ATG exposé dans la littérature. Cependant, il apparaît que si chaque étape est étudiée et documentée en détails, la liaison entre les différentes séquences de formation de l’autophagosome est loin d’être comprise et la difficulté à intégrer ces différents systèmes (phosphorylation de protéines, synthèse de lipides, interactions protéine-protéine et protéine-lipide, dynamique membranaire, etc.) soulève, de fait, un réel défi pour le biologiste cellulaire (Figure 1). En effet, les précieux modèles ayant permis de comprendre, entre autres, la formation d’une vésicule à manteau (comme une vésicule à clathrine) ou le bourgeonnement membranaire, vésiculaire ou tubulaire, assurant le transport entre certains compartiments endomembranaires, n’ont cependant pas permis d’apporter d’hypothèse convaincante quant à la biogenèse de l’autophagosome. De même, l’intervention précise et dynamique de molécules du cytosquelette (actine, tubuline, etc.) est encore mal comprise dans la formation du phagophore, alors qu’elle est bien caractérisée dans de nombreuses étapes de trafic membranaire dans le reste de la cellule, comme lors de l’endocytose ou de la phagocytose. Ainsi, de nombreux points restent à clarifier, voire à comprendre, dans les étapes d’assemblage du phagophore et dans la régulation des phénomènes de fermeture et de maturation de l’autophagosome. À titre d’exemple, l’adressage subcellulaire et la régulation locale de l’activité du complexe PI3K (malgré l’identification de protéines clés de l’autophagie telles que VPS34, Beclin-1, ATG14L, VMP1 [vacuole membrane protein 1], Ambra1 [autophagy/beclin-1 regulator 1], etc.), voire la synthèse localisée de PI3P, soulèvent encore des interrogations notamment dans sa capacité à agir en parallèle de son implication au niveau de l’endosome précoce, où le PI3P joue un rôle majeur dans la dynamique membranaire liée au transport endosomal (Figure 2). Un autre point d’interrogation important concerne directement la transition, et la possible continuité physique, entre l’omégasome (structure liée au RE) et le phagophore, cette transition ne pouvant pas s’expliquer par un simple échange (par protrusion, bourgeonnement et/ou tubulation) de membranes (Figure 1)
: les données récentes [7, 17] sur la participation de lipides membranaires ou de membranes provenant d’autres organites (comme les mitochondries, les sites de contact entre RE et mitochondries, les gouttelettes lipidiques, l’appareil de Golgi, les vésicules golgiennes, les endosomes et la membrane plasmique), soulèvent ainsi l’hypothèse de contributeurs multiples et de leur coordination spatio-temporelle pour permettre la mise en place de la structure si particulière qu’est le phagophore. Au niveau biophysique, les questions de fusion puis de maturation de membranes issues d’origines différentes ou, à l’inverse, la possibilité de formation de membranes de novo à partir de transport non-vésiculaire localisé sont des pistes particulièrement intéressantes (Figure 1). Enfin, de nombreuses études, issues de contextes biologiques différents, démontrent clairement que l’autophagie, ou, pour être plus précis, la machinerie autophagique, pouvait, d’une part, participer à d’autres fonctions intracellulaires en parallèle d’une dégradation lysosomale ciblée, comme le transport intracellulaire et la sécrétion, et, d’autre part, déclencher des réponses autophagiques à l’aide d’un nombre limité de protéines ATG, soulevant ainsi la notion d’autophagie non-canonique. Ces différentes avancées démontrent ainsi l’importance d’étudier en détail, et de façon intégrée, les étapes de trafic, de remodelages et d’échanges membranaires liées à la réponse autophagique afin de mieux comprendre comment la cellule mobilise son appareillage endomembranaire pour fabriquer l’autophagosome et lui donner les outils moléculaires lui permettant d’accomplir, au bon endroit et au bon moment, sa fonction de protection cellulaire contre les différents types de stress. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Mizushima N, Levine B, Cuervo AM, et al. Autophagy fights disease through cellular self-digestion . Nature. 2008; ; 451 : :1069.–1075. 2.
Rubinsztein DC, Shpilka T, Elazar Z. Mechanisms of autophagosome biogenesis . Curr Biol. 2012; ; 22 : :R29.–R34. 3.
Boya P, Reggiori F, Codogno P. Emerging regulation and functions of autophagy . Nat Cell Biol. 2013; ; 15 : :713.–720. 4.
Levine B, Kroemer G. Autophagy in the pathogenesis of disease . Cell. 2008; ; 132 : :27.–42. 5.
Klionsky DJ, Codogno P. The mechanism and physiological function of macroautophagy . J Innate Immun. 2013; ; 5 : :427.–433. 6.
Nakatogawa H, Suzuki K, Kamada Y, et al. Dynamics and diversity in autophagy mechanisms: lessons from yeast . Nat Rev Mol Cell Biol. 2009; ; 10 : :458.–467. 7.
Lamb CA, Yoshimori T, Tooze SA. The autophagosome: origins unknown, biogenesis complex . Nat Rev Mol Cell Biol. 2013; ; 14 : :759.–774. 8.
Tooze SA. Current views on the source of the autophagosome membrane . Essays Biochem. 2013; ; 55 : :29.–38. 9.
Roberts R, Ktistakis NT. Omegasomes: PI3P platforms that manufacture autophagosomes . Essays Biochem. 2013; ; 55 : :17.–27. 10.
Hamasaki M, Furuta N, Matsuda A, et al. Autophagosomes form at ER-mitochondria contact sites . Nature. 2013; ; 495 : :389.–393. 11.
Ge L, Melville D, Zhang M, et al. The ER-Golgi intermediate compartment is a key membrane source for the LC3 lipidation step of autophagosome biogenesis . Elife. 2013; ; 2 : :e00947.. 12.
Moreau K, Rubinsztein DC. The plasma membrane as a control center for autophagy . Autophagy. 2012; ; 8 : :861.–863. 13.
Puri C, Renna M, Bento CF, et al. Diverse autophagosome membrane sources coalesce in recycling endosomes . Cell. 2013; ; 154 : :1285.–1299. 14.
Gruenberg J. The endocytic pathway: a mosaic of domains . Nat Rev Mol Cell Biol. 2001; ; 2 : :721.–730. 15.
La Moreau K. biogenèse des autophagosomes perd de son mystère . Med Sci (Paris). 2011; ; 27 : :1075.–1077. 16.
Alers S, Loffler AS, Wesselborg S, et al. The incredible ULKs . Cell Commun Signal. 2012; ; 10 : :7.. 17.
Stanley RE, Ragusa MJ, Hurley JH. The beginning of the end: how scaffolds nucleate autophagosome biogenesis . Trends Cell Biol. 2014; ; 24 : :73.–81. |