| |
| Med Sci (Paris). 33(2): 130–132. doi: 10.1051/medsci/20173302005.Modulation de la sensibilité aux glucocorticoïdes dans les leucémies aiguës lymphoblastiques Pyr3, un nouvel outil thérapeutique ? Souleymane Abdoul-Azize,1* Isabelle Dubus,1 and Jean-Pierre Vannier1,2 1Micro-environnement et renouvellement cellulaire intégré, MERCI EA 3829, faculté de médecine et pharmacie, université de Rouen, 22, boulevard Gambetta, 76183Rouen Cedex, France 2Service immuno-hémato-oncologie pédiatrique, CHU Charles Nicolle, 1, rue de Germont, 76031Rouen Cedex, France |
Les leucémies aiguës lymphoblastiques (LAL) sont des proliférations malignes des cellules des lignées lymphoïdes. De façon générale, 85 % des cas de patients atteints de LAL correspondent à une atteinte de la lignée lymphoïde B, les cas d’atteintes de la lignée T étant plus rares. Les LAL sont les cancers les plus fréquents chez l’enfant, représentant environ un tiers des cancers pédiatriques et 75 % des leucémies de l’enfant [1] (→).
(→) Voir la Synthèse de D. Sinnett et al., m/s n° 11, novembre 2007, page 968
La prise en charge des patients atteints de LAL repose sur des protocoles de chimiothérapie dans lesquels les glucocorticoïdes (GC) ont une place importante. Bien que des progrès considérables dans le traitement de cette maladie maligne aient été observés au cours des dernières années, ces protocoles sont confrontés à un phénomène de résistance responsable, chez environ 20 % des patients, d’une rechute [2]. Les patients montrent une plus forte résistance aux GC en comparaison avec ce qui est initialement observé [3]. Pour prévenir la résistance et améliorer la sensibilité aux GC dans le traitement des tumeurs malignes lymphoïdes, plusieurs nouvelles associations de médicaments avec les GC sont actuellement testées. C’est dans ce contexte que l’association de la molécule Pyr31 aux GC a été évaluée in vitro. |
Pyr3, un inhibiteur du canal TRPC3, inhibe la signalisation cellulaire des cellules leucémiques Pyr3 est couramment utilisé comme antagoniste sélectif de TRPC3 (transient receptor potential canonical 3), un canal calcique. Il permet d’inhiber les influx de calcium ainsi que la signalisation cellulaire liée à ce canal, la croissance et la mort cellulaire [4]. Dans les cellules non-excitables telles que les cellules sanguines, l’épuisement des pools calciques intracellulaires active les canaux calciques membranaires à l’origine d’un influx calcique appelé SOCE (store-operated Ca2 + entry) [5]. SOCE est, depuis peu, considéré comme une cible dans la lutte contre les tumeurs [6]. Des défauts de signalisation de SOCE contribuent en effet au développement de plusieurs maladies malignes chez l’homme, notamment les leucémies lymphoïdes aiguës et chroniques [7]. Dans des lignées de cellules leucémiques, mais aussi dans des cellules primaires de patients atteints de leucémies, nous avons observé que Pyr3 bloque non seulement la libération du calcium à partir du réticulum endoplasmique, mais également l’influx calcique via les canaux calciques membranaires de manière dose-dépendante. Cette diminution du calcium intracellulaire induite par Pyr3 est corrélée à une diminution significative de la croissance des cellules leucémiques et aboutit à la mort cellulaire [8]. |
Pyr3 altère la signalisation cellulaire des glucocorticoïdes dans les cellules leucémiques La signalisation calcique est un régulateur clé impliqué dans la survie des lymphocytes. Des altérations de cette voie de signalisation ont été décrites dans de nombreuses maladies telles que les leucémies lymphoïdes chroniques et aiguës, impactant ainsi la réponse thérapeutique [9]. Cependant, le rôle de l’homéostasie et de la signalisation du calcium dans la mort cellulaire ou dans la sensibilité et la résistance aux glucocorticoïdes reste controversé. De précédentes études des effets des GC sur la signalisation calcique ont apporté des résultats contradictoires. Dans certains cas, une augmentation [10], et dans d’autres, une diminution [11] des influx et des concentrations cytosoliques de calcium ont été observées dans plusieurs types cellulaires. Ces résultats contradictoires pourraient être dus à la nature des lignées cellulaires utilisées dans ces études. Nous avons exploré l’effet des GC sur la signalisation intracellulaire des cellules lymphoblastiques provenant des patients atteints de LAL. La technique d’imagerie calcique nous a permis de montrer que, premièrement, les GC mobilisent la signalisation calcique dans les lignées cellulaires de LAL (lignées Nalm-6 et Reh) mais aussi dans les lymphoblastes primaires de patients. Cette augmentation du calcium intracellulaire est liée à la mobilisation des réserves correspondantes, suivie par un influx calcique dû à la mobilisation des réserves extracellulaires via l’ouverture des canaux membranaires. Ces résultats renforcent donc l’hypothèse selon laquelle les GC amplifient la concentration intracellulaire du calcium. Dans un deuxième temps, nous avons montré, et ce pour la première fois, que la signalisation calcique induite par les GC est significativement diminuée en présence de Pyr3, l’inhibiteur du canal calcique TRPC3 [8]. |
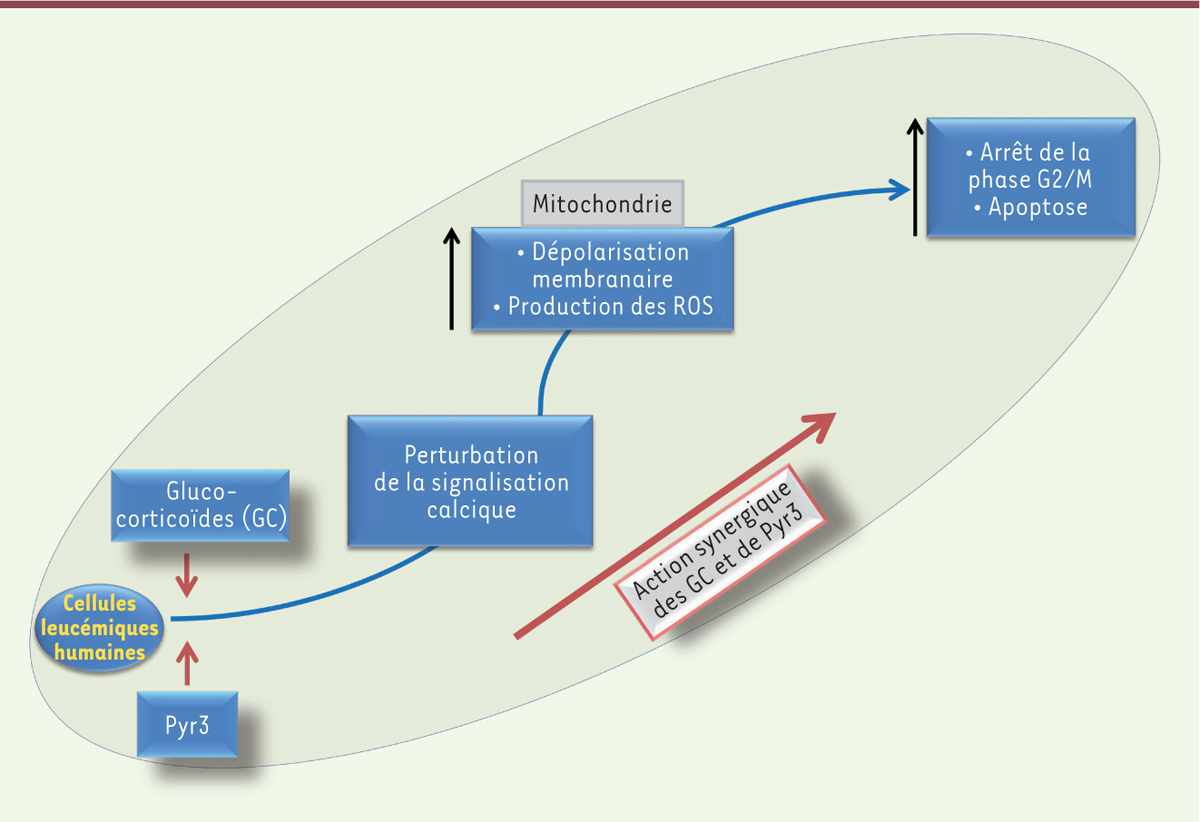
Pyr3 agit de manière synergique avec les glucocorticoïdes pour induire la mort des cellules leucémiques L’effet anti-leucémique des GC passe tout d’abord par l’activation du récepteur des glucocorticoïdes, suivie par la translocation de celui-ci dans le noyau. Le récepteur des glucocorticoïdes interagit alors avec les éléments de réponse aux GC pour activer les protéines pro-apoptotiques ou inhiber les protéines anti-apoptotiques à travers la voie mitochondriale. Afin de renforcer l’effet anti-leucémique des GC, nous avons exploré l’action d’un traitement associant Pyr3 aux GC sur la survie des cellules de LAL. Nous avons observé que l’association des GC et de Pyr3 diminue significativement la viabilité des cellules LAL de façon dose-dépendante. En combinaison avec les GC, Pyr3 déclenche une activité anti-leucémique de façon synergique et non additive. En effet, l’indice de combinaison2, entre les deux médicaments est nettement inférieur à un [8]. L’exploration des mécanismes pouvant réduire la viabilité des cellules LAL suite au traitement combiné GC et Pyr3 a permis de faire quatre observations : (1) un arrêt du cycle cellulaire en phase G2/M ; (2) une quantité importante de cellules apoptotiques en phase sous-G1 ; (3) une dissipation du potentiel transmembranaire mitochondrial ; et (4) une forte production de ROS (reactive oxygen species) [8]. L’ensemble de ces phénomènes conduit à l’apoptose cellulaire (Figure 1).
 | Figure 1.
Effet synergique entre glucocorticoïdes (GC) et Pyr3 sur la survie des cellules leucémiques. Le co-traitement par des GC et Pyr3 de cellules de leucémies pédiatriques aiguës perturbe la signalisation calcique intracellulaire indispensable à la survie de ces cellules. Cette modulation calcique engendre une perte du potentiel membranaire de la mitochondrie suivie par une production importante des ROS (reactive oxygen species). Il en résulte un arrêt de la phase G2/M du cycle cellulaire et une augmentation de la mortalité cellulaire par apoptose. |
|
Ces résultats suggèrent qu’il est possible d’améliorer la sensibilité des cellules leucémiques aux glucocorticoïdes en associant ces derniers avec d’autres molécules comme Pyr3. Notre étude démontre en effet pour la première fois une action synergique entre Pyr3 et les glucocorticoïdes sur l’induction de la mort des cellules de lignées cellulaires leucémiques et les cellules primaires des patients atteints de leucémies, notamment celles qui sont normalement cortico-résistantes. Pyr3 présente ainsi un bénéfice thérapeutique potentiel qui pourrait permettre d’inverser la résistance aux glucocorticoïdes dans les LAL pédiatriques et probablement dans d’autres tumeurs lymphoïdes malignes. Des études in vivo chez la souris sont désormais envisagées. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ce travail a été soutenu par des subventions du ministère français de l’Enseignement supérieur et de la Recherche, de l’association Vie et Espoir, et de la Ligue contre le Cancer de Normandie.
|
Footnotes |
1.
Sinnett Dd, N’Diaye N, St-Onge P, Healy J. La leucémie de l’enfant : une maladie génétique ! . Med Sci (Paris). 2007; ; 23 : :968.–974. 2.
Jones CL, Gearheart CM, Fosmire S, et al. MAPK signaling cascades mediate distinct glucocorticoid resistance mechanisms in pediatric leukemia . Blood. 2015; ; 126 : :2202.–2212. 3.
Klumper E, Pieters R, Veerman AJ, et al. In vitro cellular drug resistance in children with relapsed/refractory acute lymphoblastic leukemia . Blood. 1995; ; 86 : :3861.–3868. 4.
Dragoni S, Laforenza U, Bonetti E, et al. Canonical transient receptor potential 3 channel triggers vascular endothelial growth factor-induced intracellular Ca2 + oscillations in endothelial progenitor cells isolated from umbilical cord blood . Stem Cells Dev. 2013; ; 22 : :2561.–2580. 5.
Kumar VS, Gopalakrishnan A, Nazirogˇlu M, Rajanikant GK. Calcium ion: the key player in cerebral ischemia . Curr Med Chem. 2014; ; 21 : :2065.–2075. 6.
Wei J, Zhang J, Si Y, et al. Blockage of LMP1-modulated store-operated Ca2 + entry reduces metastatic potential in nasopharyngeal carcinoma cell . Cancer Lett. 2015; ; 360 : :234.–244. 7.
Castro-Caldas M, Duarte CB, Carvalho AP. M Fernandes Lopes C. Dexamethasone induces the secretion of annexin I in immature lymphoblastic cells by a calcium dependent mechanism . Mol Cell Biochem. 2002; ; 237 : :31.–38. 8.
Abdoul-Azize S, Buquet C, Vannier JP, Dubus I. Pyr3, a TRPC3 channel blocker, potentiates dexamethasone sensitivity and apoptosis in acute lymphoblastic leukemia cells by disturbing Ca2 + signaling, mitochondrial membrane potential changes and reactive oxygen species production . Eur J Pharmacol. 2016; ; 784 : :90.–98. 9.
Stewart TA, Yapa KT, Monteith GR. Altered calcium signaling in cancer cells . Biochim Biophys Acta. 2015; ; 1848 : :2502.–2511. 10.
Davis MC, McColl KS, Zhong F, et al. Dexamethasone-induced inositol 1,4,5-trisphosphate receptor elevation in murine lymphoma cells is not required for dexamethasone-mediated calcium elevation and apoptosis . J Biol Chem. 2008; ; 283 : :10357.–10365. 11.
Suwanjang W, Holmström KM, Chetsawang B, Abramov AY. Glucocorticoids reduce intracellular calcium concentration and protect neurons against glutamate toxicity . Cell Calcium. 2013; ; 53 : :256.–263. |