| |
| Med Sci (Paris). 33(1): 95–98. doi: 10.1051/medsci/20173301018.Les liaisons dangereuses : p53, dyskératose congénitale et anémie de Fanconi Eléonore Toufektchan,1,2,3,4 Sara Jaber,1,2,3,4 and Franck Toledo1,2,3,4* 1Génétique de la suppression tumorale, Équipe Labellisée Ligue, Institut Curie, Centre de recherche, 26, rue d’Ulm, 75248Paris Cedex 05, France 2Sorbonne Universités, UPMC, Université Paris 6, Paris, France 3CNRS UMR 3244, Paris, France 4PSL Research University, Paris, France MeSH keywords: Animaux, Réparation de l'ADN, Dyskératose congénitale, Anémie de Fanconi, Gènes p53, Humains, Souris, Souris knockout, Télomère, Homéostasie des télomères, Protéine p53 suppresseur de tumeur, génétique, complications, physiologie, métabolisme |
Les syndromes d’insuffisance médullaire héréditaire Les syndromes d’insuffisance médullaire héréditaire sont des maladies rares, caractérisées par un défaut de production de cellules hématopoïétiques associé à des malformations physiques et une prédisposition au développement tumoral. Deux de ces syndromes d’insuffisance médullaire majeurs sont la dyskératose congénitale (DC) et l’anémie de Fanconi (AF). Ces pathologies sont causées par des mutations de gènes codant des protéines impliquées dans des mécanismes cellulaires essentiels, respectivement le métabolisme des télomères et la réparation de l’ADN. La DC est ainsi caractérisée par un raccourcissement accéléré des télomères et l’AF par un défaut de réparation des ponts inter-brins de l’ADN. Malgré la distinction des voies moléculaires affectées, la DC et l’AF montrent de nombreuses similitudes au niveau phénotypique (Tableau I), ce qui complique leur diagnostic clinique et rend complexe la compréhension des mécanismes sous-jacents [1].
Tableau I.
|
Dyskératose congénitale |
Anémie de Fanconi |
|
Phénotypes cellulaires
|
|
|
|
| Raccourcissement télomérique |
✓ |
✓a |
|
| Défauts de réparation de l’ADN |
✓b |
✓ |
|
| Instabilité chromosomique |
✓ |
✓ |
|
|
Phénotypes cliniques
|
|
|
|
| Retard de croissance |
✓ |
✓ |
|
| Hyperpigmentation cutanée |
✓ |
✓ |
|
| Leucoplasie orale |
✓ |
✗ |
|
| Dystrophie unguéale |
✓ |
✗ |
|
| Microphtalmie |
✗ |
✓ |
|
| Anomalies du squelette |
✗ |
✓ |
|
| Tâches « café au lait » |
✗ |
✓ |
|
| Insuffisance médullaire progressive |
✓ |
✓ |
|
| Fibrose pulmonaire |
✓ |
✗ |
|
| Malformations cardiaques |
✗ |
✓ |
|
| Hypertrophie cardiaque |
✓ |
✗ |
|
| Microcéphalie |
✓ |
✓ |
|
| Hypoplasie cérébelleuse |
✓ |
✗ |
|
| Atrophie testiculaire |
✓ |
✓ |
|
| Maladies hépatiques et gastro-intestinales |
✓ |
✗ |
|
|
Prédisposition au développement tumoral
|
|
|
|
| Carcinomes de la sphère ORL et ano-génitale |
✓ |
✓ |
|
| Leucémies |
✓ |
✓ |
|
| Myélodysplasie |
✓ |
✓ |
|
| Carcinomes de la peau et du tube digestif |
✗ |
✓ |
|
| Tumeur mammaire ou de l’ovaire |
✗ |
✓c
|
|
| Tumeur du cerveau et du rein |
✗ |
✓d
|
Comparatif dyskératose congénitale (DC)/anémie de Fanconi (AF). ✓ : phénotype caractéristique des patients DC ou AF ; ✗ : phénotype non retrouvé chez les patients DC ou AF ; ✓ : phénotype retrouvé chez des patients atteints de variants sévères de DC. a : phénotype retrouvé chez des patients mutés pour FANCD2 (Fanconi anemia complementation group D2). b : phénotype retrouvé chez des patients mutés pour RTEL1 (regulator of telomere elongation helicase 1). c : phénotype retrouvé chez des patients mutés pour FANCS/BRCA1 (breast cancer 1), FANCD1/BRCA2 et FANCN/PALB2 (partner and localizer of BRCA2). d : phénotype retrouvé chez des patients mutés pour FANCD1/BRCA2, FANCN/PALB2 et FANCJ/BRIP1/BACH1 (BRCA1-interacting protein 1 ou BRCA1-associated C-terminal helicase). ORL : oto-rhino-laryngologie. |
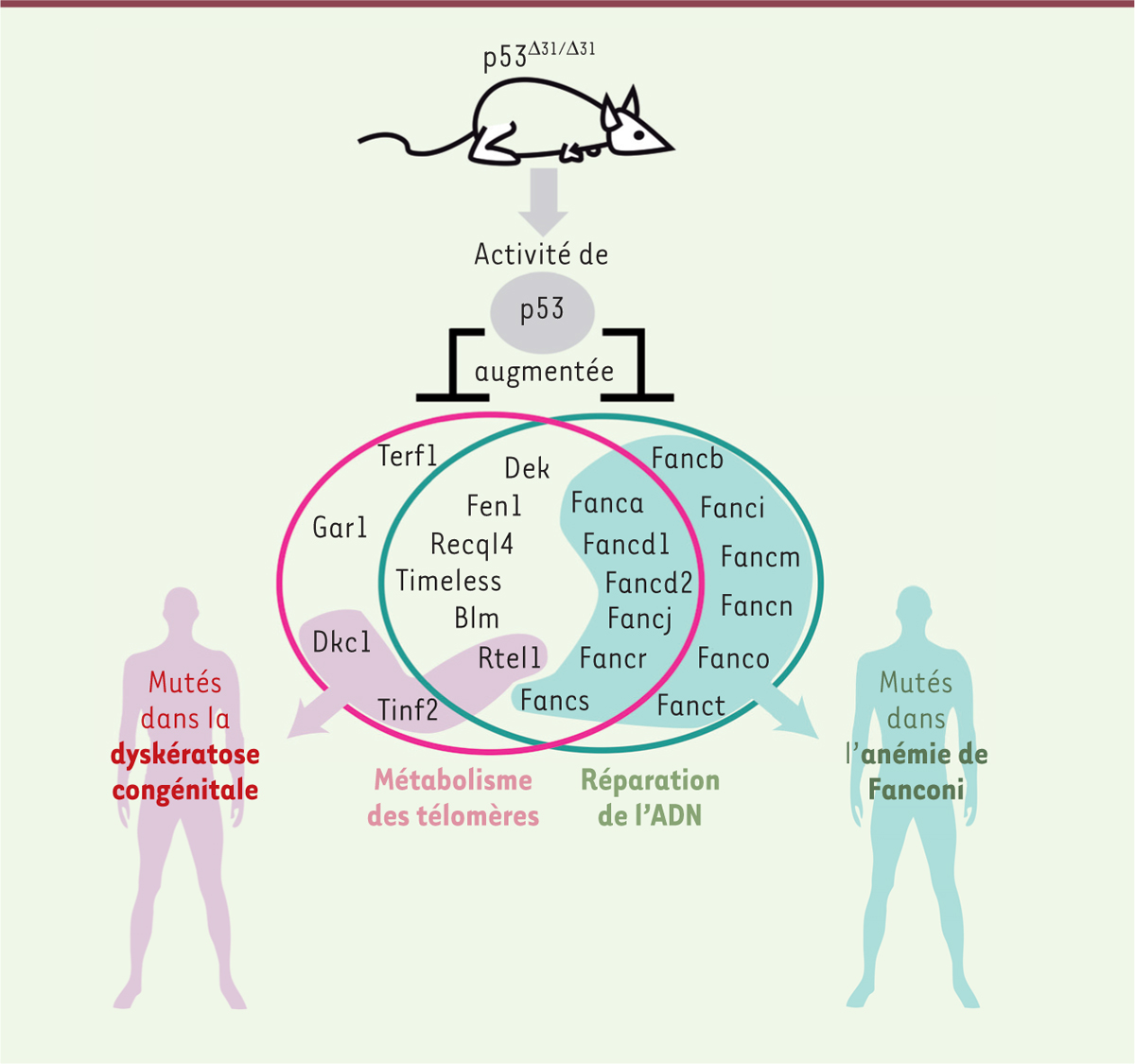
De nombreuses études ont été menées pour comprendre les mécanismes cellulaires impliqués dans le développement des syndromes d’insuffisance médullaire héréditaire, notamment via la création de souris mutantes. Mais si l’inactivation chez la souris d’un gène muté chez des patients permet de reproduire certains phénotypes, très peu de modèles ont réellement permis de récapituler l’ensemble des symptômes de ces pathologies. Néanmoins, notre équipe a récemment créé un très bon modèle murin de DC caractérisé, de façon surprenante, par une délétion du domaine C-terminal de la protéine p53, mieux connue pour ses activités anti-tumorales [2]. |
La protéine p53 régule le métabolisme des télomères La protéine p53 est un facteur de transcription stabilisé et activé en réponse à divers stress cellulaires, qui régule l’expression de nombreux gènes cibles impliqués dans la sénescence, l’apoptose ou encore la régulation du métabolisme énergétique. Cette protéine, dont le gène humain TP53 est inactivé dans 50 à 70 % des cancers sporadiques [3], exerce un rôle anti-tumoral majeur. Toutefois, p53 est impliquée dans de nombreux autres processus physiologiques, tels que la fertilité ou le vieillissement, et sa dérégulation jouerait un rôle dans diverses pathologies comme le diabète et les maladies neuro-dégénératives [4]. Le modèle murin p53Δ31, qui exprime une protéine p53 hyperactive tronquée de son domaine C-terminal, récemment généré par notre équipe, a permis d’associer p53 à une nouvelle fonction majeure : la régulation du métabolisme des télomères [2]. En effet, nous avons montré que les souris homozygotes p53Δ31/Δ31
récapitulent les phénotypes cliniques et moléculaires du syndrome de DC, et que p53 régule l’expression de plusieurs gènes mutés dans cette pathologie [2, 5] (→).
(→) Voir la Nouvelle de S. Jaber et al., m/s n° 12, décembre 2013, page 1071
|
p53 régule également la voie Fanconi de réparation de l’ADN L’étude initiale du modèle murin p53Δ31 a permis d’évaluer l’expression de 10 gènes mutés chez des patients atteints de DC [2]. Mais la maintenance des télomères dépend de plusieurs dizaines de protéines, ce qui nous a récemment incités à étendre cette étude à un éventail plus large de gènes codant des protéines impliquées dans le métabolisme des télomères. Parmi 42 nouveaux candidats, nous avons ainsi identifié 7 gènes dont l’expression diminue significativement lorsque l’activité de p53 augmente [6]. Parmi eux, le gène qui présente la plus forte répression est le gène murin Fancd2 (Fanconi anemia complementation, group d2), homologue du gène humain FANCD2
1,, qui code une protéine centrale de la voie de l’AF. La voie Fanconi de réparation de l’ADN compte 21 protéines FANC, réparties en 3 complexes protéiques nécessaires à la réparation de lésions particulières, appelées ponts inter-brins. La régulation négative de Fancd2 par p53 chez la souris nous a fortement intrigués car, chez l’homme, l’inactivation d’un seul des gènes FANC est suffisante pour induire l’AF, présentant de nombreux traits phénotypiques semblables à la DC, la pathologie modélisée par les souris p53Δ31/Δ31. Par ailleurs, Rtel1 (regulator of telomere elongation helicase 1), l’un des gènes mutés dans la DC et précédemment identifiés comme réprimés par p53 [2], code une hélicase apparentée à FANCJ. De plus, Blm (Bloom syndrome gene) et Fen1 (Flap endonuclease 1), deux autres gènes nouvellement trouvés comme réprimés par p53, codent respectivement une hélicase et une endonucléase interagissant avec des protéines FANC [13] (→).
(→) Voir la Synthèse de E.L. Dubois et al., m/s n° 6-7, juin-juillet 2016, page 598
Ces observations nous ont conduits à évaluer plus précisément l’impact de p53 sur l’expression des gènes Fanc. Nous avons ainsi identifié 11 autres gènes Fanc réprimés suite à la suractivation de p53 [6]. Nous avons, de plus, montré que les cellules p53Δ31/Δ31
sont hypersensibles à la mitomycine C2,, un agent induisant des ponts inter-brins, ce qui se manifeste par un nombre accru d’aberrations chromosomiques et d’échanges entre chromatides sœurs [6], des caractéristiques typiquement retrouvées dans les cellules de patients atteints d’AF [7]. Ainsi, l’ensemble des résultats obtenus par l’étude du modèle murin p53Δ31 nous a permis d’associer p53 à la régulation du métabolisme des télomères, mais également à celle de la voie Fanconi de réparation de l’ADN. Ces régulations constitueraient un système de rétrocontrôle positif selon le modèle suivant [6] : p53 réprime l’expression de nombreux gènes impliqués dans ces deux voies cellulaires, ce qui induit des défauts de régulation des télomères et de réparation de l’ADN qui, en retour, activent p53. Lorsque la protéine p53 est sauvage, cette boucle de régulation est contrebalancée par la dégradation de p53 par MDM2 (murine double minute 2), un régulateur majeur et gène cible de p53. En revanche, la délétion du domaine C-terminal de p53 atténuerait sa régulation négative par MDM2, ce qui conduirait à une hyperactivation de p53 et provoquerait un défaut accru dans le maintien des télomères et la réparation de l’ADN. Ceci expliquerait pourquoi les souris p53Δ31/Δ31
développent une DC, mais aussi pourquoi les cellules de ces souris présentent également des phénotypes caractéristiques de l’AF. |
p53 réduit la frontière entre DC et AF Les régulations négatives de la biologie des télomères et de la voie Fanconi de réparation de l’ADN sont de nouvelles fonctions qui semblent bousculer l’idée généralement admise de p53 comme gardien du génome. Néanmoins, ces régulations permettraient de faciliter l’entrée en apoptose de cellules dont le génome est altéré. La suractivation de p53 favorise des dérégulations à l’origine de la DC et de l’AF. Ce mécanisme commun pourrait expliquer la confusion clinique possible entre ces deux syndromes d’insuffisance médullaire. En effet, des défauts télomériques ont été observés chez certains patients atteints d’AF présentant une mutation de FANCD2 [8]. À l’inverse, des cellules de patients souffrant du syndrome Hoyeraal-Hreidarsson, un variant sévère de la DC, et mutées pour RTEL1, peuvent présenter une hypersensibilité à la mitomycine C [9]. Il a également été récemment montré que des mutations de BRCA1 (breast cancer 1 ou FANCS) ou BRCA2 (FANCD1) peuvent altérer la structure et la fonction des télomères [10]. Par ailleurs, une étude plus précise de la littérature nous a permis de mettre en relation d’autres protéines FANC avec le métabolisme des télomères, et consolider le lien entre ces deux voies cellulaires. FANCA participerait ainsi à la colocalisation des protéines FANCD2 et TRF1 (telomeric repeat factor 1) au niveau des télomères dans des cellules qui n’expriment pas la télomérase [11]. BRCA2, quant à lui, permettrait à RAD51 (FANCR) d’accéder aux télomères afin de faciliter leur réplication [12]. Certaines études tendent aussi à relier FANCJ à la maintenance des télomères, sans toutefois la démontrer, puisque son activité principale est la résolution des structures en G-quadruplex3, [11]. |
Conclusion et perspectives L’étude du modèle murin p53Δ31 a permis d’identifier 12 gènes régulés par p53 qui participeraient à la fois à la biologie des télomères et à la réparation des ponts inter-brins de l’ADN (Figure 1). Les dérégulations de ces deux voies cellulaires, pourtant distinctes, convergeraient vers deux conséquences communes : une instabilité chromosomique et une suractivation de p53, dont la conséquence ultime serait la perte de cellules souches hématopoïétiques. Mieux comprendre la régulation et les fonctions de p53 pourrait donc être crucial pour approfondir notre compréhension de la DC et de l’AF, et réévaluer les frontières entre ces syndromes d’insuffisance médullaire héréditaire présentant de nombreuses ressemblances au niveau clinique, mais également au niveau moléculaire. L’altération génétique causant une DC ou une AF reste aujourd’hui encore inconnue pour certains patients. Les résultats que nous avons obtenus suggèrent que la recherche de mutation des gènes codant p53 ou ses régulateurs principaux, tels que les protéines MDM2 et MDM4, serait une piste à explorer.
 | Figure 1.
Le modèle murin p53Δ31 révèle que la protéine p53 régule l’expression de 22 gènes impliqués dans le métabolisme des télomères et/ou la voie Fanconi de réparation de l’ADN. Sept des 12 gènes impliqués à la fois dans la régulation des télomères et la réparation de l’ADN sont mutés chez l’homme, chez des patients atteints de DC ou d’AF. Adapté de [ 6]. Blm : Bloom syndrome gene ; Dkc1 : dyskeratosis congenita 1 ; Fanca, b, d1, d2, i, j, m, n, o, r, s ou t : Fanconi anemia complementation group a, b, d1, d2, i, j, m, n, o, r, s, ou t ; Fen1 : Flap endonuclease 1 ; Gar1 : homolog of S. cerevisiae glycine and arginine rich 1 ; Recql4 : RecQ like helicase 4 ; Rtel1 : regulator of telomere elongation helicase 1 ; Terf1 : telomeric repeat binding factor 1 ; Tinf2 : Terf1-interacting nuclear factor 2. |
En corollaire de ce travail, nos résultats impliquent que, dans des cellules tumorales ayant partiellement conservé une activité de p53, la suractivation de p53 (par exemple avec la nutlin, un inhibiteur spécifique de MDM2) peut sensibiliser ces cellules à l’action de molécules provoquant des ponts inter-brins. Nous avons effectivement obtenu la preuve de ce concept [6] qui, sous réserve d’un index thérapeutique satisfaisant, pourrait s’avérer utile pour améliorer l’efficacité de certaines stratégies anti-tumorales. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Chirnomas SD, Kupfer GM. The inherited bone marrow failure syndromes . Pediatr Clin North Am. 2013; ; 60 : :1291.–1310. 2.
Simeonova I, Jaber S, Draskovic I, et al. Mutant mice lacking the p53 C-terminal domain model telomere syndromes . Cell Rep. 2013; ; 3 : :2046.–2058. 3.
Vogelstein B, Lane D, Levine AJ. Surfing the p53 network . Nature. 2000; ; 408 : :307.–310. 4.
Brady CA, Attardi LD. p53 at a glance . J Cell Sci. 2010; ; 123 : :2527.–2532. 5.
Jaber S, Simeonova I, Toledo F. De la mesure en toute chose : dérégulation de p53, cancer et syndromes télomériques . Med Sci (Paris). 2013; ; 29 : :1071.–1073. 6.
Jaber S, Toufektchan E, Lejour V, et al. p53 downregulates the Fanconi anaemia DNA repair pathway . Nat Commun. 2016; ; 7 : :11091.. 7.
Longerich S, Li J, Xiong Y, et al. Stress and DNA repair biology of the Fanconi anemia pathway . Blood. 2014; ; 124 : :2812.–2819. 8.
Joksic I, Vujic D, Guc-Scekic M, et al. Dysfunctional telomeres in primary cells from Fanconi anemia FANCD2 patients . Genome Integr. 2012; ; 3 : :6.. 9.
Ballew BJ, Joseph V, De S, et al. A recessive founder mutation in regulator of telomere elongation helicase 1, RTEL1, underlies severe immunodeficiency and features of Hoyeraal Hreidarsson syndrome . PLoS Genet. 2013; ; 9 : :e1003695.. 10.
Uziel O, Yerushalmi R, Zuriano L, et al. BRCA1/2 mutations perturb telomere biology: characterization of structural and functional abnormalities in vitro and in vivo . Oncotarget. 2016; ; 7 : :2433.–2454. 11.
Sarkar J, Liu Y. Fanconi anemia proteins in telomere maintenance . DNA Repair (Amst). 2016; ; 43 : :107.–112. 12.
Badie S, Escandell JM, Bouwman P, et al. BRCA2 acts as a RAD51 loader to facilitate telomere replication and capping . Nat Struct Mol Biol. 2010; ; 17 : :1461.–1469. 13.
Dubois EL, Béliveau M, Masson JY. Les modèles animaux de l’anémie de Fanconi. Ou comment les différences peuvent être aussi précieuses que les similitudes . Med Sci (Paris). 2016; ; 32 : :598.–605. |