| |
| Med Sci (Paris). 33(1): 89–92. doi: 10.1051/medsci/20173301016.Le récepteur des adénovirus et des coxsackievirus (CAR) est impliqué dans les processus cognitifs Charleine Zussy,1,2 Fabien Loustalot,1,2 Felix Junyent,1,2 Eric J. Kremer,1,2 and Sara Salinas3* 1Institut de génétique moléculaire de Montpellier, CNRS 5535, 1919, route de Mende, 34293Montpellier Cedex 5, France 2Université de Montpellier, 4, boulevard Henry IV, 34967Montpellier Cedex 2, France 3UMR 1058, Inserm, Université de Montpellier, Établissement français du sang, Pathogenèse et contrôle des infections chroniques, 60, rue de Navacelles, 34394Montpellier Cedex 5, France MeSH keywords: Maladie d'Alzheimer, Animaux, Système nerveux central, Cognition, Protéine membranaire apparentée au récepteur des coxsackievirus et adénovirus, Humains, Plasticité neuronale, génétique, anatomopathologie, physiopathologie, métabolisme, physiologie |
Lors du développement du système nerveux, les neurones s’organisent en réseaux permettant notre fonctionnement moteur, sensoriel et cognitif. Ces réseaux ne sont cependant pas figés. La plasticité neuronale permet à notre cerveau, via des modifications au niveau synaptique et/ou cellulaire, de s’adapter à l’environnement. La découverte de la génération de nouveaux neurones chez l’adulte (processus appelé neurogenèse adulte) [1] (→) a provoqué de nombreux débats. Il est désormais démontré que ce processus participe à la plasticité neuronale. La neurogenèse adulte joue notamment un rôle crucial dans la régulation de nombreux processus cognitifs comme la mémoire ou dans certains désordres psychiatriques tels que la dépression et le stress post-traumatique [1]. Chez l’être humain, la région sous-granulaire (SGZ, subgranular zone) de l’hippocampe1 est un des lieux privilégiés de la neurogenèse adulte où environ 700 nouveaux neurones par jour sont générés [2]. L’hippocampe contient des précurseurs qui peuvent soit se diviser pour maintenir leur population, soit, en fonction de signaux spécifiques, se différencier en neurones. Après un stade de neurone immature, le neurone « nouveau-né » sera intégré dans les réseaux hippocampiques et participera à la régulation de l’activité neuronale de cette structure.
(→) Voir la Nouvelle de M. Lemasson et P.M. Lledo, m/s n° 6-7, juin-juillet 2003, page 664
Un dysfonctionnement des réseaux neuronaux suite à la dérégulation d’un mécanisme moléculaire ou à une mort cellulaire, est à l’origine de nombreuses maladies neurodégénératives. Parmi celles-ci, la maladie d’Alzheimer (MA) est la première cause de démence dans le monde. Cette maladie est caractérisée par l’apparition de plaques composées d’oligomères de peptide Aβ, générés par un clivage anormal de la protéine APP (amyloid precursor protein), et par l’accumulation de filaments intracellulaires constitués de la protéine Tau. Si l’étiologie de cette pathologie reste peu claire, les processus inflammatoires semblent exacerber, voire provoquer, les dérégulations des mécanismes neuronaux touchés dans cette maladie [3]. |
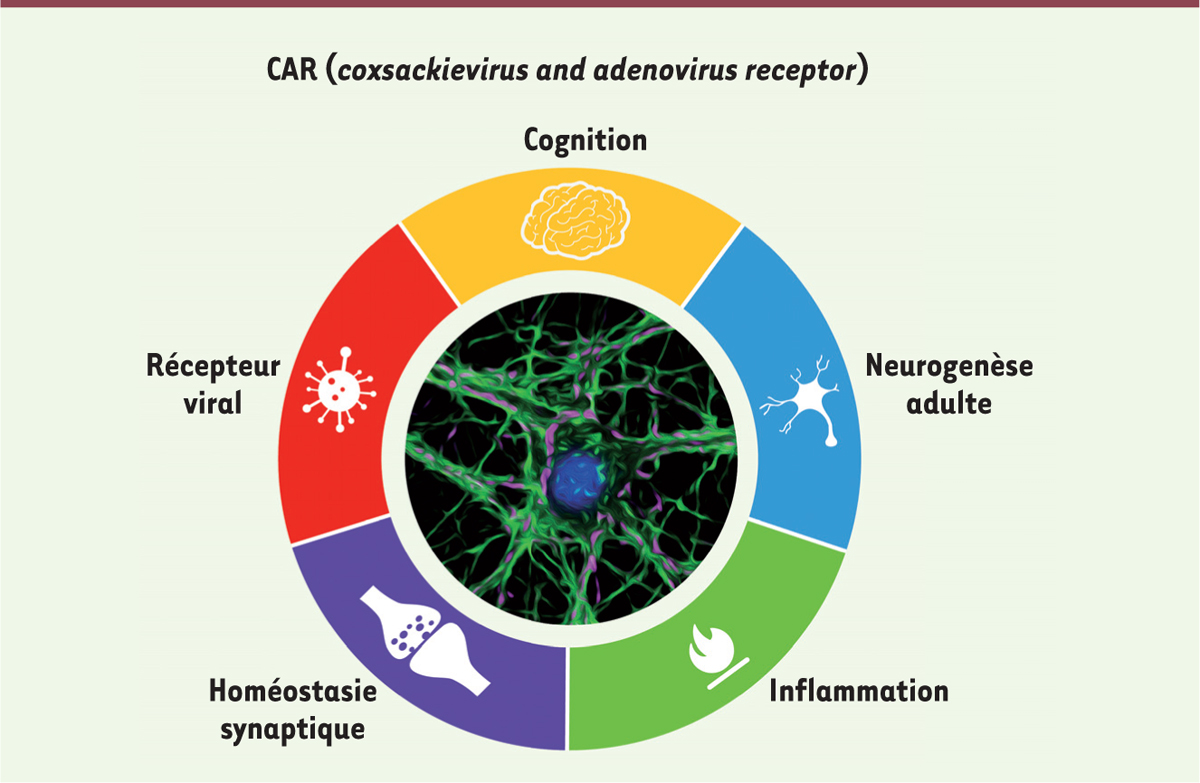
CAR et le système nerveux central La protéine CAR (coxsackievirus and adenovirus receptor) fait partie de la superfamille des immunoglobulines et, comme son nom le suggère, a été initialement identifiée comme récepteur viral [4]. Des études sur son rôle cellulaire ont ensuite démontré qu’elle possède une fonction d’adhérence au sein des jonctions serrées au niveau des épithéliums. Les domaines extracellulaires de CAR y forment des homodimères en trans et renforcent l’interaction cellule-cellule [4]. CAR est de plus fortement exprimée dans le système nerveux central (SNC) au cours du développement, ce qui a mené à la proposition d’un rôle de cette molécule dans l’établissement des réseaux neuronaux [5]. Nos résultats antérieurs ont montré, dans les neurones moteurs, que CAR était impliquée dans le tropisme neuronal et le transport axonal rétrograde2 de vecteurs dérivés de CAV-2 (canine adenovirus type 2) [6, 7]. CAR est en effet exprimée par les neurones moteurs et se localise à la jonction neuromusculaire. Suite à la fixation de CAV-2, CAR est internalisée et transportée dans les axones [6]. Ces observations ont soulevé des questions quant à la fonction de CAR dans les neurones matures, c’est-à-dire dans le cerveau adulte. En tant que molécule d’adhérence, CAR pourrait réguler des processus neuronaux tels que la pousse neuritique, la formation des synapses (synaptogenèse) ou la neurogenèse adulte, comme d’autres protéines appartenant à la même famille, par exemple NCAM (neuronal cell adhesion molecule). |
Étude du rôle de CAR dans le SNC Afin de caractériser le rôle de CAR dans le cerveau, nous avons utilisé une combinaison d’approches moléculaires, biochimiques, cellulaires, électrophysiologiques et comportementales. Nous avons ainsi montré que CAR se trouve à la synapse, une sous-structure neuronale clé permettant la neurotransmission [8]. Nos études histologiques sur cerveau de souris ont montré une expression importante de CAR dans l’hippocampe, en particulier au niveau de la zone sous-granulaire. Grâce à l’utilisation de marqueurs spécifiques des différentes étapes de la neurogenèse adulte, nous avons mis en évidence l’expression préférentielle de CAR dans les neurones « nouveau-nés » immatures. Après avoir isolé biochimiquement les synapses de cerveaux adultes (synaptosomes3,), nous avons pu également démontrer que CAR est une protéine synaptique plus particulièrement localisée à la pré-synapse4,. Ces observations ont ensuite été confirmées sur des neurones hippocampiques murins mis en culture : dans ces neurones, CAR est localisée dans des structures contenant des protéines régulant l’activité synaptique telle que la synaptophysine5. Ces données sur la localisation de CAR suggèrent que cette protéine pourrait influencer la neurogenèse adulte et/ou la plasticité synaptique. Afin d’avoir une vision plus globale du rôle de CAR dans le SNC, nous avons créé une lignée de souris dans laquelle le gène codant pour CAR, Cxadr, a été invalidé spécifiquement dans les cellules d’origine neurale, grâce à la technique de la recombinase Cre6 [9]. Les souris KO (knock-out) pour CAR dans le SNC (CAR-SNCKO) ne présentent pas d’anomalies dans l’architecture cérébrale [8]. Nous avons ensuite évalué plus précisément la neurogenèse adulte hippocampique grâce à l’utilisation d’un analogue nucléotidique (EdU, 5-éthynyl-2′-déoxyuridine), qui s’insère spécifiquement dans les cellules en division (comme les cellules souches neurales), et de marqueurs spécifiques des neurones immatures (exprimant la forme polysialisée de NCAM, PSA-NCAM) ou mature (exprimant le facteur de transcription NeuN [neuronal nuclei]). Nous avons ensuite attendu 1, 7 et 28 jours après l’injection d’EdU et quantifié le nombre de nouveaux neurones immatures et matures chez les souris contrôles et CAR-SNCKO. Nous avons mis en évidence une augmentation des neurones immatures et une diminution des neurones matures chez les souris n’exprimant pas CAR dans le SNC, suggérant un défaut de neurogenèse adulte en l’absence de cette molécule d’adhérence. Lorsque nous avons mesuré la neurotransmission sur des tranches7, d’hippocampes, nous avons également observé un défaut de transmission synaptique chez les souris CAR-SNCKO femelles. En utilisant un ensemble de tests comportementaux, nous avons pu démontrer que ces défauts fonctionnels se traduisaient par des problèmes cognitifs puisque les souris CAR-SNCKO présentent des problèmes de mémoire spatiale à court et à long terme8, mais également un comportement anxieux (Figure 1).
 | Figure 1.
Rôle de CAR dans le SNC mature. CAR (coxsackievirus and adenovirus receptor) est fortement exprimée dans le système nerveux central (SNC) en développement et mature. L’invalidation de son expression, spécifiquement dans les cellules d’origine neurale au cours du développement, n’a pas d’effet drastique sur l’organisation architecturale du cerveau. Cependant, au niveau cellulaire, l’absence de CAR au niveau des neurones nouveau-nés issus de la neurogenèse adulte et des synapses, où elle est trouvée en condition normale, déclenche des déficits cognitifs. De plus, un environnement pro-inflammatoire tel qu’on peut le trouver dans la maladie d’Alzheimer mène à une baisse de CAR, ce qui pourrait être cohérent avec un rôle de CAR dans l’homéostasie de l’hippocampe, structure clé impliquée dans la régulation de processus cognitifs tels que l’apprentissage et la mémoire. |
|
CAR et maladie d’Alzheimer Compte-tenu de l’effet potentiel de l’absence de CAR dans le SNC sur les processus cognitifs, nous nous sommes interrogés sur le rôle de CAR dans des pathologies neuronales présentant des déficits cognitifs, et pour lesquelles la fonction synaptique et la neurogenèse adulte sont affectées. Nous nous sommes donc concentrés sur la MA, dans laquelle des défauts de ces processus participeraient à la progression de la pathologie. Ce choix a été conforté par le fait que CAR pouvait être modulée par des sécrétases, enzymes également impliquées dans la MA. Nous avons dans un premier temps évalué le niveau de CAR dans un modèle animal de la MA, les souris 3xTgAD [10]. Nous avons pu observer une diminution de l’expression de CAR à des stades précoces et tardifs de la maladie [8]. Puis, nous avons également observé une baisse de CAR dans des échantillons d’hippocampes de patients atteints de la MA (à un stade précoce), démontrant que le niveau de CAR est dérégulé dans cette pathologie. Nous nous sommes alors intéressés au(x) mécanisme(s) impliqué(s) dans la diminution de CAR dans le SNC pathologique. Pour cela, nous avons testé l’hypothèse selon laquelle la neuro-inflammation pouvait moduler la stabilité de CAR. Nous avons observé l’effet direct de cytokines pro-inflammatoires (le facteur de nécrose tumorale TNF-α et l’interféron [IFN]-γ) sur le niveau de CAR dans des neurones hippocampiques murins en culture. De manière intéressante, ces cytokines provoquent une baisse de CAR (Figure 1). Nous avons ensuite montré que l’injection de LPS (lipopolysaccharide), une molécule pro-inflammatoire, menait à une diminution, potentiellement sélective, du niveau de CAR au niveau des neurones immatures de l’hippocampe murin. |
Notre étude montre que CAR joue un rôle clé dans l’homéostasie de l’hippocampe et que, dans un environnement pro-inflammatoire tel qu’observé dans la MA, sa stabilité est modulée. Il est donc possible que cette molécule participe, en concomitance avec d’autres acteurs cellulaires et moléculaires, à l’établissement de dysfonctionnements neuronaux qui, ultimement, mèneront à des troubles cognitifs (Figure 1). |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Lemasson M, Lledo PM. Le cerveau adulte : un perpétuel chantier ! Med Sci (Paris). 2003; ; 19 : :664.–666. 2.
Lepousez G, Nissant A, Lledo PM. Adult neurogenesis and the future of the rejuvenating brain circuits . Neuron. 2015; ; 86 : :387.–401. 3.
Spalding KL, Bergmann O, Alkass K, et al. Dynamics of hippocampal neurogenesis in adult humans . Cell. 2013; ; 153 : :1219.–1227. 4.
Heneka MT, Carson MJ, El Khoury J, et al. Neuroinflammation in Alzheimer’s disease . Lancet Neurol. 2015; ; 14 : :388.–405. 5.
Loustalot F, Kremer EJ, Salinas S. Membrane dynamics and signaling of coxsackievirus and adenovirus receptor . Int Rev Cell Mol Biol. 2016; ; 322 : :331.–362. 6.
Patzke C, Max KE, Behlke J, et al. The coxsackievirus-adenovirus receptor reveals complex homophilic and heterophilic interactions on neural cells . J Neurosci. 2010; ; 30 : :2897.–2910. 7.
Salinas S, Bilsland LG, Henaff D, et al. CAR-associated vesicular transport of an adenovirus in motor neuron axons . PLoS Pathog. 2009; ; 5 : :e1000442.. 8.
Junyent F, Kremer EJ. CAV-2: why a canine virus is a neurobiologist’s best friend . Curr Opin Pharmacol. 2015; ; 24 : :86.–93. 9.
Zussy C, Loustalot F, Junyent F, et al. Coxsackievirus adenovirus receptor loss impairs adult neurogenesis, synapse content and hippocampus plasticity . J Neurosci. 2016; ; 36 : :9558.–9571. 10.
Tronche F, Kellendonk C, Kretz O, et al. Disruption of the glucocorticoid receptor gene in the nervous system results in reduced anxiety . Nat Genet. 1999; ; 23 : :99.–103. 11.
Oddo S, Caccamo A, Shepherd JD, et al. Triple-transgenic model of Alzheimer’s disease with plaques and tangles: intracellular Aβ and synaptic dysfunction . Neuron. 2003; ; 39 : :409.–421. |