| |
| Med Sci (Paris). 33(1): 60–65. doi: 10.1051/medsci/20173301010.Substituts osseux Fabienne Jordana,1,2,3* Catherine Le Visage,1 and Pierre Weiss1,2,3 1Inserm, U1229, Regenerative Medicine and Skeleton Research, RMeS, 1, place Alexis Ricordeau, 44042Nantes Cedex 1, France 2Université de Nantes, UFR Odontologie, 44042Nantes, France 3CHU Nantes, PHU 4 OTONN, 44042Nantes, France |
Les substituts osseux servent à combler un défaut après un traumatisme ou une chirurgie, et apportent un support mécanique et une éventuelle cicatrisation osseuse. Ils constituent une alternative à l’autogreffe osseuse. Dès le xiiie siècle, les Incas ont employé des plaques d’or comme substitut osseux et la première xénogreffe1 a été réalisée par J. van Meekeren en 1668 en utilisant de l’os provenant d’un chien [1]. Les nécessités dues aux deux Guerres mondiales promurent l’introduction de matériaux alternatifs pour réparer les dommages faits aux hommes, comme les alliages et les polymères [1]. À l’heure actuelle, plus de deux millions de greffes osseuses sont réalisées annuellement dans le monde en chirurgie orthopédique, en neurochirurgie, en chirurgie maxillo-faciale et en chirurgie dentaire [2]. Dans cette revue, nous évoquerons les nécessités et les possibilités actuellement développées concernant les substituts osseux et leurs utilisations. Nous aborderons ainsi la structure et la composition de l’os, et les nécessaires adéquations avec un tissu synthétique. Nous nous référerons à quelques définitions exposées dans le Glossaire
2. |
Composition de l’os natif et propriétés des substituts L’os est constitué de deux fractions [3] : (1) une fraction minérale (qui représente 70 % du tissu) composée de phosphate de calcium de structure apatitique (calcium, Ca : 35,5 % ; phosphore, P : 18,5 % ; ions sous forme de traces). La cristallinité et le rapport Ca/P (qui est compris entre 1,61 et 1,66) dépendent de l’âge et du type d’os (os spongieux, os cortical) ; (2) une fraction organique (30 %) protéique (constituée à 95 % de collagène de type I). La résistance de l’os à la compression est de 150 MPa3, pour l’os cortical et de 7 MPa pour l’os trabéculaire. Sa porosité ou celle du biomatériau est représentée par le rapport (en %) du volume de l’espace vide sur le volume global [3]. Elle est continue si les pores sont interconnectés, et ouverte s’ils débouchent sur l’extérieur. La porosité d’un biomatériau conditionne ses propriétés mécaniques et la repousse osseuse. On distingue [3, 7], d’une part, la microporosité due aux pores de diamètre inférieur à 5-10 µm. Celle-ci représente les espaces entre les grains ou cristaux du biomatériau et permet la diffusion des fluides biologiques et les échanges ioniques (Ca2+ et PO4
3-) ; et, d’autre part, la macroporosité due, elle, aux pores de diamètres supérieurs à 100 µm, qui guide en profondeur les cellules. Enfin, la résorbabilité d’un biomatériau, qui modifie ses propriétés physiques et chimiques, conduit à sa disparition soit par dissolution, soit par dégradation et élimination des produits de dégradation par excrétion rénale ou métabolisation [3, 8]. |
Substituts osseux : un cahier des charges Une composition chimique proche de celle de l’os, la microporosité, la surface spécifique, la cristallinité, la taille des cristaux et la rugosité de surface sont des facteurs importants à prendre en considération [9], ainsi que les propriétés des greffes osseuses autologues et allogéniques (Tableau I). Le substitut osseux idéal [2, 10–13] devrait ainsi être biocompatible, biorésorbable, facile d’utilisation, peu coûteux, tout en présentant (1) une intégrité structurelle similaire à celle de l’os, (2) une matrice ostéoconductrice, et (3) contenir des facteurs ostéo-inducteurs, capables de recruter et stimuler les cellules ostéoformatrices et la réparation osseuse.
Tableau I.
|
Ostéoconduction |
Ostéo-induction |
Présence de cellules ostéogéniques |
Structure |
Remarques |
| Autogreffe trabéculaire |
+++ |
+++ |
+++ |
+ |
Morbidité potentielle du site donneur |
|
| Autogreffe corticale |
++ |
+ |
+ |
+++ |
Se fragilise avec le remodelage |
|
| Allogreffe trabéculaire |
+++ |
- |
- |
+ |
Transmission éventuelle de maladies |
|
| Allogreffe corticale |
+ |
- |
- |
+++ |
Faible remodelage, fracture à la fatigue possible |
|
| Matrice osseuse déminéralisée (DBM) |
++ |
++ |
- |
- |
Activité selon traitement |
|
| Céramiques |
+++ |
± |
- |
+ |
Taux de remodelage variable |
Propriétés des greffes osseuses et des substituts osseux (- : pas d’effet ; + : effet minime ; ++ : effet modéré ; +++ : effet important) (d’après [2, 13]). |
Actuellement, aucun substitut osseux ne répond à toutes ces exigences et ces substituts sont souvent utilisés en association avec de l’os autologue, une membrane, du matériel d’ostéosynthèse ou un autre moyen de stabilisation osseuse, ou encore du coagulât sanguin [4]. Le choix du substitut osseux est fait par le clinicien selon la localisation anatomique et le volume osseux nécessaire [4], son origine naturelle ou synthétique, sa vitesse de résorption et ses propriétés d’injectabilité et de malléabilité. |
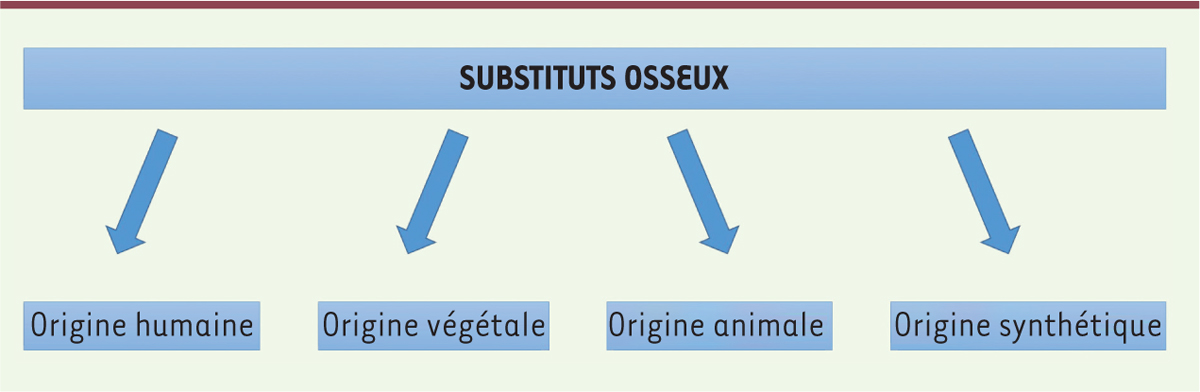
Les différentes familles de substituts osseux Différentes familles de substituts osseux sont disponibles [4] (Figure 1). La Commission nationale d’évaluation des dispositifs médicaux et des technologies de santé (CNEDiMTS) en distingue deux grandes catégories [4] : ceux issus de dérivés, de tissus d’origine animale non viables ou en comportant, et les substituts synthétiques qui ne comportent aucun dérivé ou tissu d’origine biologique ou n’étant pas issus de tels dérivés.
 | Figure 1.
Familles de substituts osseux disponibles.
|
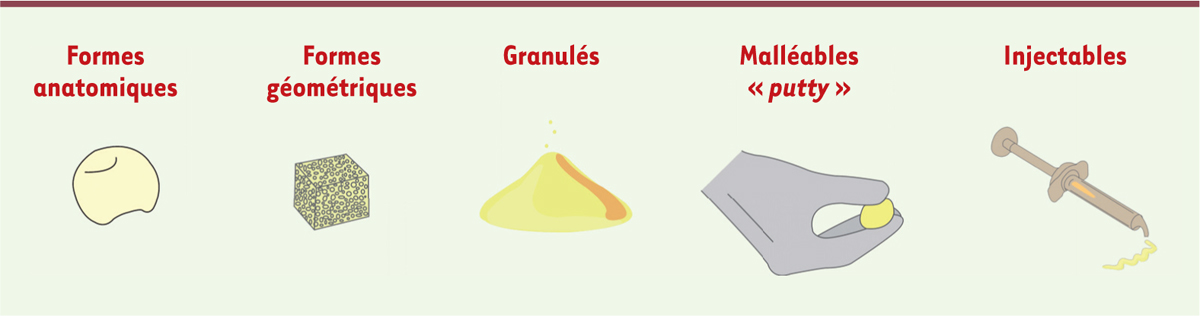
Les substituts osseux peuvent se présenter sous formes anatomiques, géométriques (cylindres, coins, etc.), sous forme de granules, sous forme malléable, voire sous forme injectable. Les matériaux injectables permettent une chirurgie moins invasive et un remplissage optimal des défauts (Figure 2).
 | Figure 2.
Présentation commerciale des substituts osseux.
|
Les allogreffes La transplantation d’un fragment osseux d’un individu à un autre a été réalisée pour la première fois en chirurgie orthopédique, il y a plus de 120 ans [ 14]. Pour l’os destiné aux banques, le greffon est prélevé sur des donneurs consentants lors de chirurgie orthopédique (arthroplastie). Les prélèvements sont congelés, voire lyophilisés. Un risque théorique lié aux réactions immunitaires et à la transmission de maladies existe mais il est pratiquement éliminé par le traitement imposé aux greffons [2]. Les allogreffes sont soumises à des prérequis réglementairement opposables tels que l’autorisation d’établissement et l’autorisation de procédé, voire l’autorisation d’importation [4]. Elles entrent dans le cadre légal des transplantations d’organes, sous la responsabilité de l’établissement français des greffes (soumises aux règles de bioéthique). Pour les matrices osseuses déminéralisées (DBM), le greffon est prélevé sur des cadavres. Lors du procédé industriel de déminéralisation et de lyophilisation du greffon osseux, la stabilité mécanique de celui-ci est endommagée, avec une perte de résistance de 30 % à la compression, de 40 % à la flexion et de 60 % à la torsion. La matrice osseuse déminéralisée résultante doit donc être utilisée en combinaison avec un matériau de maintien d’espace [9]. Dans l’organisme, la DBM est ostéo-conductrice, voire ostéo-inductrice, grâce aux protéines et aux facteurs de croissance qu’elle contient [15, 16] et sa néovascularisation est rapide [15]. Cependant, ses propriétés varient en fonction du procédé industriel appliqué et du donneur [15, 17, 18]. Les substituts d’origine végétale Un biomatériau issu d’algues rouges marines comportant un exosquelette calcifié constitué de carbonate de calcium, converti industriellement en hydroxyapatite par un traitement à environ 700 °C est disponible [ 9, 19]. Les particules poreuses sont reliées par des microperforations d’environ 3 µm [ 20]. Sa résorption lente est réalisée par dégradation enzymatique ou par les ostéoclastes [ 9, 20]. Les xénogreffes Une xénogreffe est constituée de minéraux osseux d’origine animale, dont le composant organique a été éliminé pour éviter le risque d’immunogénicité ou la transmission de maladies [ 9]. Les xénogreffes sont issues de tissus d’origine animale non viables ou de dérivés rendus non viables [ 4]. Le corail Des substituts osseux sont issus de l’exosquelette de certains coraux marins, qui présentent une structure poreuse, constituée de carbonate de calcium sous forme d’aragonite, similaire à celle de l’os spongieux humain [ 2, 15, 21]. Ce squelette de carbonate de calcium de corail peut être transformé en hydroxyapatite par frittage à haute température [ 2]. La résistance à la compression du corail est élevée, mais il est friable [ 2]. Son ostéoconduction serait moindre que celle d’autres substituts osseux [ 22, 23]. Le taux de résorption du corail varie en fonction de sa porosité, elle-même dépendant de l’espèce, du site d’implantation et du volume osseux [ 3, 24]. Ces coraux biocompatibles peuvent servir de support aux facteurs de croissance et permettre la fixation, la croissance et la différenciation des cellules [2, 21, 24]. Les substituts d’origine animale (mammifères : bovins, porcins notamment) L’os spongieux bovin est très utilisé, en raison de sa similitude de composition et de porosité avec l’os humain. Il subit un traitement thermique et/ou un procédé d’extraction chimique afin d’éliminer la phase organique et limiter les risques de transmission notamment d’encéphalopathie spongiforme bovine [ 25, 26]. Une température supérieure à 1 000 °C entraîne le frittage de l’hydroxyapatite naturelle, le grossissement du cristal d’apatite et la quasi-disparition des espaces intercristallins. La porosité et la microrugosité sont diminuées, et la cristallinité augmentée [ 27]. Ces substituts osseux sont utilisés comme hydroxyapatites biologiques. Comme pour les allogreffes, les procédés industriels utilisés retentissent sur leurs propriétés biologiques. Les substituts osseux bovins déprotéinisés, non résorbables, sont les plus utilisés [ 9] car ils sont biocompatibles et ostéoconducteurs [ 28, 29]. Les substituts osseux d’origine synthétique La CNEDiMTS définit ces substituts comme ne comportant aucun dérivé ou tissu d’origine biologique et n’étant pas issus de tels dérivés [ 4]. Ils constituent 60 % du marché des substituts osseux [ 30]. Le risque de transmission de maladie est nul et ils peuvent être utilisés pour des nécessités éthiques ou religieuses [ 9]. Leurs caractéristiques (composition chimique, porosité, rapport entre les phases cristallines et amorphes, morphologie des particules et des blocs) et leurs propriétés peuvent être adaptées, dans une certaine mesure, pour une indication clinique spécifique [9]. Sulfate de calcium Ce substitut osseux synthétique, le plus ancien, est utilisé depuis la fin du XIX e siècle. Le mélange de la poudre de sulfate de calcium avec de l’eau produit une réaction exothermique qui conduit à la formation d’une structure cristalline [ 31]. Dès 1959, Peltier le décrit comme biocompatible, biorésorbable et radio-opaque [ 12]. Le sulfate de calcium inorganique est ostéoconducteur [ 15] mais il présente une faible résistance mécanique [ 31]. Il est possible d’y inclure des antibiotiques et des facteurs de croissance et de l’associer avec des autogreffes et des matrices osseuses déminéralisées. Bioverres Le premier verre bioactif, initialement nommé 45S5 puis Bioglass®, a été inventé par l’Américain L. Hench en 1969 [ 32]. De formule chimique Na 2O-CaO-SiO 2-P 2O 5, les bioverres sont composés de calcium, de phosphore et de dioxyde de silicium. Des bioverres résorbables ou non peuvent être obtenus en fonction de la proportion des éléments qui les composent. Les bioverres sont biocompatibles, durs, granuleux et non poreux [ 33]. Ils possèdent des propriétés d’ostéointégration et sont ostéoconducteurs [ 2]. Leurs propriétés ostéogéniques seraient dues aux produits de dissolution et à la re-précipitation en apatites biologiques qui s’effectue à leur surface, permettant de stimuler les cellules ostéogéniques [ 5]. Leur structure offre une résistance à la compression, mais elle ne fournit pas de support structurel [ 15]. À terme, le bioverre ne peut être retiré sans fracture de l’os. Phosphates de calcium Les céramiques phosphocalciques, généralement polycristallines, ont une composition chimique similaire à celle de la phase minérale de l’os et fournissent un échafaudage ostéoconducteur [ 15]. Les céramiques, cassantes, présentent une faible résistance mécanique (à la traction et au cisaillement). Elles sont utilisées majoritairement pour le comblement [ 34]. Elles sont disponibles sous forme de blocs, poreux ou non, présentant diverses tailles, ou de granulés. Elles sont préparées à partir de poudres synthétisées chimiquement dont les cristaux à grains sont agrégés par frittage à haute température [ 35]. Les céramiques sont biocompatibles. Pour la plupart, elles ne présentent pas, à elles seules, d’activité ostéogénique. Elles sont ostéoconductrices en fournissant un support pour les cellules osseuses et les protéines morphogénétiques osseuses [2]. Au contact avec de l’os sain, un tissu ostéoïde se forme puis se minéralise, avec l’acquisition progressive d’une résistance mécanique semblable à celle de l’os [2]. Parmi les céramiques phosphocalciques, on retrouve notamment :
-
L’hydroxyapatite (HA), de formule Ca10(PO4)6(OH)2 et de rapport Ca/P de 1,67. Ce phosphate de calcium est très proche chimiquement des apatites biologiques. Il est considéré comme ostéoconducteur, peu résorbé, voire non résorbable [7].
-
Le phosphate tri-calcique (TCP), de formule Ca3(PO4)2, sous la forme cristalline α ou β4,, et de rapport Ca/P de 1,5. Le TCP le plus utilisé est le β-TCP. Sa résistance à la compression est plus faible [35]. Il s’agit d’une céramique poreuse qui se transforme partiellement en hydroxyapatite in vivo [36]. Le TCP est considéré comme ostéoconducteur et présente une résorption rapide par solubilisation des ions calcium et phosphate, qui sont utilisés dans la néoformation osseuse. L’espace ménagé par la résorption du TCP permet le dépôt d’os nouveau [9, 22].
-
Les céramiques biphasées (BCP) associant l’HA et le TCP, généralement du β-TCP. À noter que l’HA ou le β-TCP purs sont difficiles à préparer en raison de leur contamination, lors de la synthèse, par d’autres phases minérales, du β-TCP par l’HA, et de l’HA par le β-TCP. Rares sont les produits monophasés réellement purs qui soient commercialisés [7]. Les BCP allient les propriétés physico-chimiques de chacun des composés [7] : une forte bioactivité, due à la plus grande solubilité du TCP ; une stabilité à long terme nécessaire à l’adhérence cellulaire, à la mise en place du néo-tissu osseux, et le maintien de l’espace grâce à la non-résorbabilité de l’hydroxyapatite [7]. Ainsi, le ratio HA/TCP peut être modulé selon la vitesse de résorption et la substitution osseuse souhaitée [7]. C’est le concept de bioactivité contrôlée [7]. Cependant, en fonction de leur composition et de leur température de frittage, la plupart des BCP ne sont pas ostéo-inductrices et doivent toujours être utilisées en site osseux et en contact avec des berges osseuses avivées selon G. Daculsi [7].
-
Les ciments de phosphate de calcium injectables et solutions injectables. Ces substituts se présentent sous forme d’une pâte injectable obtenue par le mélange de poudre de phosphates de calcium (pouvant être de l’hydroxyapatite, du β-TCP et/ou phosphate dicalcique dihydraté dit « brushite » en proportions variables), avec une solution aqueuse. La solidification du mélange s’opère après l’injection, en quelques minutes, avec la formation d’une apatite carbonatée de faible cristallinité similaire à celle trouvée dans la phase minérale de l’os [37]. Ces substituts présentent deux inconvénients majeurs. En effet, leur injectabilité varie considérablement en fonction de la composition de la poudre de ciment, du rapport poudre/liquide, du temps après le début du mélange poudre/liquide [38]. L’absence de porosité adéquate retarde d’autre part la résorption du matériau et la croissance cellulaire. Certains fabricants incorporent des microparticules d’acide poly-lactique-glycolique à dégradation rapide afin d’améliorer la résorption [39].
Les matériaux composites Avec du collagène Ces substituts osseux sont composés d’une céramique de phosphate de calcium associée à une matrice de collagène d’origine animale [ 4] ou sont constitués d’un substitut osseux bovin déprotéinisé associé à un peptide synthétique issu du collagène de type I. Les polymères d’acide acrylique/hydroxyde de calcium Ces substituts osseux sont constitués de PMMA (polyméthylméthacrylate) et de PHEMA (polyhydroxyéthylméthacrylate) recouverts d’hydroxyapatite. Les hydrogels Les hydrogels sont des réseaux de polymères fortement hydratés, d’origine synthétique ou naturelle, qui ont des propriétés proches de celles des tissus mous. La réaction de formation du gel (la gélification), les propriétés mécaniques et les cinétiques de dégradation varient selon le polymère utilisé pour constituer l’hydrogel. Les hydrogels peuvent être associés à des céramiques phosphocalciques (hydroxyapatite et/ou TCP), parfois à de l’alumine. Ils sont injectés dans un défaut osseux facilitant la néoformation osseuse [40]. L’hydrogel fournit un support temporaire pour la prolifération cellulaire, en facilitant le transfert des nutriments, des gaz, des déchets métaboliques et des molécules de signalisation cellulaire [39]. |
L’utilisation des substituts osseux est en constante augmentation grâce au développement récent de formes injectables. L’avenir verra peut-être l’avènement de substituts osseux pour une indication chirurgicale, associant des facteurs de croissance et des cellules ostéogéniques afin d’induire une véritable régénération du tissu osseux. L’addition de cocktails biologiques intégrant le PRP (platelet rich plasma) et le PRF (platelet rich fibrin) pourrait être réalisée lors de l’intervention chirurgicale. Bien que la mise en œuvre d’approches de bio-ingénierie puisse se heurter à des contraintes pratiques, réglementaires et économiques, cette voie de recherche est très prometteuse. Les nouvelles techniques de préparation de matériaux reposant sur des techniques soustractive ou additive (prototypage rapide, lithographie), l’electrospinning
5, etc. permettent aujourd’hui l’obtention de matériaux présentant une architecture contrôlée. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
|
Biomatériau
|
« matériau destiné à être en contact avec les tissus vivants et/ou les fluides biologiques pour évaluer, traiter, modifier les formes ou remplacer tout tissu, organe ou fonction du corps (consensus de Chester, Royaume-Uni, 1991). |
|
Substitut osseux
|
« biomatériau d’origine humaine, animale, végétale ou synthétique destiné à l’implantation […], dans la perspective d’une reconstitution du stock osseux par le renforcement d’une structure osseuse ou le comblement d’une perte de substance osseuse » [3]. |
|
Ostéoconduction
|
« propriété passive d’un biomatériau à recevoir la repousse osseuse, par invasion vasculaire et cellulaire à partir du tissu receveur au contact de ce matériau » [3]. |
|
Ostéo-induction
|
« processus de stimulation par des protéines conduisant à la prolifération et/ou à la différenciation de cellules souches en matrice osseuse minéralisable » [4]. Il s’agit donc de la capacité d’induire sur un site non-osseux une différenciation cellulaire pour synthétiser une matrice osseuse minéralisable. |
|
Ostéogenèse ou ostéoformation
|
formation de matrice osseuse par des cellules ostéoformatrices sans indication de l’origine cellulaire (issue de la greffe ou de l’hôte) [3, 4]. |
|
Bioactivité :
|
La bioactivité d’un biomatériau substitut osseux est définie comme la capacité d’un biomatériau à créer des liens chimiques à son interface avec le tissu osseux, par opposition avec un biomatériau inerte [3, 5, 6]. |
|
Footnotes |
1.
Sanan A, Haines SJ. Repairing holes in the head: a history of cranioplasty . Neurosurgery. 1997; ; 40 : :588.–603. 2.
Giannoudis PV, Dinopoulos H, Tsiridis E. Bone substitutes: an update . Injury. 2005; ; 36 : :S20.–S27. 3.
Mainard D. Les substituts de l’os, du cartilage et du ménisque en 2011. Paris: : Romillat; , 2011 : :202. p. 4.
Haute Autorité de Santé.
Substituts osseux. Saint-Denis La Plaine: : HAS; , 2013 : :134.. 5.
Daculsi G, Passuti N. Bioactive ceramics, fundamental properties and clinical application: the osteocoalescence process . Bioceramics. 1989; ; 2 : :3.–10. 6.
Daculsi G, Passuti N, Martin S, et al. Macroporous calcium phosphate ceramic for long bone surgery in humans and dogs. Clinical and histological study . J Biomed Mater Res. 1990; ; 24 : :379.–396. 7.
Daculsi G. L’os artificiel, une solution pour la reconstruction osseuse et une alternative aux allogreffes et aux autogreffes . J Biomat Dent. 2001; ; 16 : :21.–27. 8.
Piattelli A, Cordioli GP, Trisi P, et al. Light and confocal laser scanning microscopic evaluation of hydroxyapatite resorption patterns in medullary and cortical bone . Int J Oral Maxillofac Implants. 1993; ; 8 : :309.–315. 9.
Buser D. 20 years of guided bone regeneration in implant dentistry. (2nd ed.) , 2nd ed. Berlin: : Quintessence Publishing Co; , 2009 : :272. p. 10.
Global Industry Analysts Inc. , Global bone grafts industry . San Jose: : Global Industry Analysts Inc; , 2014 : :188. p. 11.
Greenwald AS, Boden SD, Goldberg VM, et al. Bone-graft substitutes: facts, fictions, and applications . J Bone Joint Surg Am. 2001; ; 83 : :98.–103. 12.
Peltier LF. The use of plaster of Paris to fill large defects in bone . Clin Orthop. 1961; ; 21 : :1.–31. 13.
McAuliffe J. Bone graft substitutes . J Hand Ther. 2003; ; 16 : :180.–187. 14.
Tomford WW. Bone allografts: past, present and future . Cell Tissue Bank. 2000; ; 1 : :105.–109. 15.
Finkemeier CG. Bone-grafting and bone-graft substitutes . J Bone Joint Surg Am. 2002; ; 84 : :454.–464. 16.
Reddi AH, Wientroub S, Muthukumaran N. Biologic principles of bone induction . Orthop Clin North Am. 1987; ; 18 : :207.–212. 17.
Aspenberg P, Johnsson E, Thorngren KG. Dose-dependent reduction of bone inductive properties by ethylene oxide . J Bone Joint Surg Br. 1990; ; 72 : :1036.–1037. 18.
Munting E, Wilmart JF, Wijne A, et al. Effect of sterilization on osteoinduction. Comparison of five methods in demineralized rat bone . Acta Orthop Scand. 1988; ; 59 : :34.–38. 19.
Thorwarth M, Wehrhan F, Srour S, et al. Evaluation of substitutes for bone: comparison of microradiographic and histological assessments . Br J Oral Maxillofac Surg. 2007; ; 45 : :41.–47. 20.
Ewers R. Maxilla sinus grafting with marine algae derived bone forming material: a clinical report of long-term results . J Oral Maxillofac Surg. 2005; ; 63 : :1712.–1723. 21.
Damien E, Revell PA. Coralline hydroxyapatite bone graft substitute: a review of experimental studies and biomedical applications . J Appl Biomater Biomech. 2004; ; 2 : :65.–73. 22.
Buser D, Hoffmann B, Bernard JP, et al. Evaluation of filling materials in membrane–protected bone defects. A comparative histomorphometric study in the mandible of miniature pigs . Clin Oral Implants Res. 1998; ; 9 : :137.–150. 23.
Jensen SS, Aaboe M, Pinholt EM, et al. Tissue reaction and material characteristics of four bone substitutes . Int J Oral Maxillofac Implants. 1996; ; 11 : :55.–66. 24.
Demers C, Hamdy CR, Corsi K, et al. Natural coral exoskeleton as a bone graft substitute: a review . Biomed Mater Eng. 2002; ; 12 : :15.–35. 25.
Schwartz Z, Weesner T, van Dijk S, et al. Ability of deproteinized cancellous bovine bone to induce new bone formation . J Periodontol. 2000; ; 71 : :1258.–1269. 26.
Wenz B, Oesch B, Horst M. Analysis of the risk of transmitting bovine spongiform encephalopathy through bone grafts derived from bovine bone . Biomaterials. 2001; ; 22 : :1599.–1606. 27.
Ong JL, Hoppe CA, Cardenas HL, et al. Osteoblast precursor cell activity on HA surfaces of different treatments . J Biomed Mater Res. 1998; ; 39 : :176.–183. 28.
Taylor JC, Cuff SE, Leger JPL, et al. In vitro osteoclast resorption of bone substitute biomaterials used for implant site augmentation: a pilot study . Int J Oral Maxillofac Implants. 2002; ; 17 : :321.–330. 29.
Piattelli M, Favero GA, Scarano A, et al. Bone reactions to anorganic bovine bone (Bio-Oss) used in sinus augmentation procedures: a histologic long-term report of 20 cases in humans . Int J Oral Maxillofac Implants. 1999; ; 14 : :835.–840. 30.
Allison D, Lindberg A, Samimi B, et al. A comparison of mineral bone graft substitutes for bone defects . US Oncol Hematol. 2011; ; 7 : :38.–49. 31.
Jordana F, Dupuis V, Colat-Parros J. Plâtres dentaires. EMC (Elsevier Masson SAS, Paris). , Médecine buccale. 2014 ; 28–225-B10., :14. p. 32.
Hench LL. The story of Bioglass . J Mater Sci Mater Med. 2006; ; 17 : :967.–978. 33.
Vitale-Brovarone C, Verne E, Robiglio L, et al. Biocompatible glass-ceramic materials for bone substitution . J Mater Sci Mater Med. 2008; ; 19 : :471.–478. 34.
Bucholz RW, Carlton A, Holmes RE. Hydroxyapatite and tricalcium phosphate bone graft substitutes . Orthop Clin North Am. 1987; ; 18 : :323.–334. 35.
Jarcho M. Calcium phosphate ceramics as hard tissue prosthetics . Clin Orthop Relat Res. 1981; ; 157 : :259.–278. 36.
Hollinger JO, Brekke J, Gruskin E, Lee D. Role of bone substitutes . Clin Orthop Relat Res. 1996; ; 324 : :55.–65. 37.
Constantz BR, Ison IC, Fulmer MT, et al. Skeletal repair by in situ formation of the mineral phase of bone . Science. 1995; ; 267 : :1796.–1799. 38.
Khairoun I, Boltong MG, Driessens FC, Planell JA. Some factors controlling the injectability of calcium phosphate bone cements . J Mater Sci Mater Med. 1998; ; 9 : :425.–428. 39.
Bongio M, van den Beucken JJJP, Leeuwenburgh SCG, Jansen JA. Preclinical evaluation of injectable bone substitute materials . J Tissue Eng Regen Med. 2015; ; 9 : :191.–209. 40.
Weiss P, Obadia L, Magne D, et al. Synchrotron X-ray microtomography (on a micron scale) provides three-dimensional imaging representation of bone ingrowth in calcium phosphate biomaterials . Biomaterials. 2003; ; 24 : :4591.–4601. |