| |
| Med Sci (Paris). 33(1): 46–51. doi: 10.1051/medsci/20173301008.Ingénierie tissulaire Une approche multidisciplinaire Didier Letourneur1* and Laurence Bordenave2** 1Inserm U1148, Laboratoire de recherche vasculaire translationnelle (LVTS), Université Paris 13, Université Paris Diderot, CHU Xavier Bichat, 46, rue Henri Huchard, F-75018Paris, France 2Inserm, Bioingénierie tissulaire, U1026, Université Bordeaux, CHU de Bordeaux, CIC 1401, F-33000Bordeaux, France |
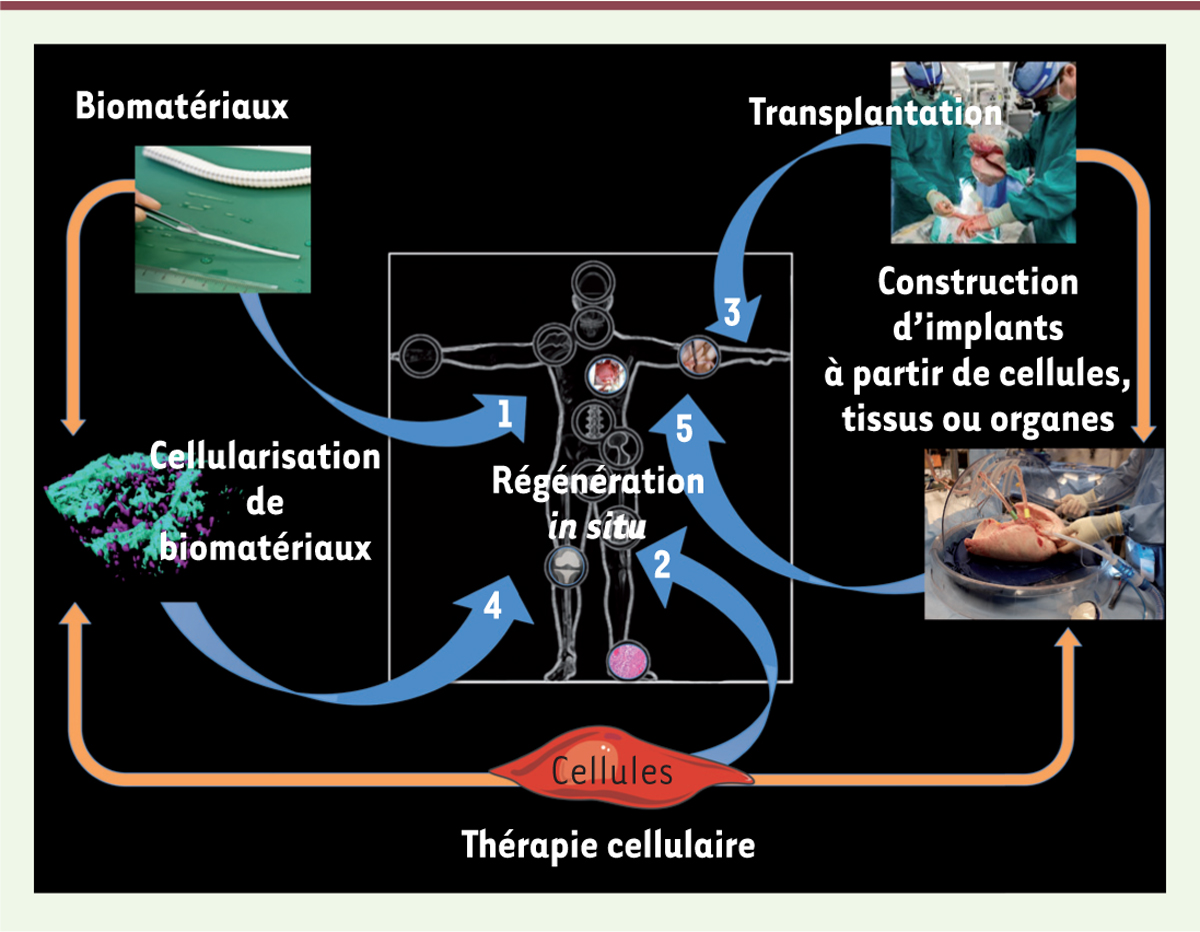
Les prothèses, du grec « pro » (à la place de) et « thesis » (action de poser), ont pour définition : « pièce ou appareil destinés à remplacer totalement ou partiellement un organe ou un membre, ou à rétablir une fonction ». C’est ainsi que l’on parle de prothèses vasculaires, de prothèses articulaires, de prothèses mammaires, etc. Elles étaient initialement constituées de matériaux créés à partir de produits naturels puis à partir de produits transformés par l’homme (bronze, acier). Les matériaux ont ensuite évolué, composés de différents types d’alliages métalliques, céramiques et de polymères résorbables ou non. Il s’agissait dans tous les cas de matériaux qui n’avaient pas été créés pour des applications médicales. Ils ont donné lieu aux « biomatériaux » actuels, définis en 1986 par la Société Européenne des Biomatériaux comme « matériau non-vivant utilisé dans un dispositif médical et conçu pour interagir avec des systèmes biologiques ». Afin d’offrir une alternative thérapeutique, voire un progrès par rapport aux greffes d’organes ou de tissus et aux solutions fondées sur l’usage de matériels prothétiques, d’autres stratégies de reconstruction des tissus sont apparues récemment. Elles visent à équiper les matériaux de moyens leur permettant de mieux s’intégrer au sein des tissus receveurs. Elles s’appuient sur l’utilisation de composants biologiques comme des protéines ou des cellules et donnent une dimension biologique au terme « biomatériau ». Cette évolution conduit ainsi à de nouvelles combinaisons. Globalement, on peut considérer trois stratégies majeures pour la réparation de tissus ou d’organes (Figure 1) :
-
L’approche par biomatériaux : les matériaux peuvent être naturels, synthétiques ou hydrides. Ils sont biodégradables/bioérodables ou non.
-
L’approche par thérapie cellulaire ou génique : les cellules adultes, souches ou reprogrammées, ainsi que des constructions géniques, sont utilisées.
-
La transplantation d’organes : elle est couramment utilisée chez l’homme et est réalisée au sein d’unités médicales hautement spécialisées.
 | Figure 1.
Trois stratégies principales utilisables pour la réparation de tissus ou d’organes. L’approche par biomatériaux (Axe 1), par thérapie cellulaire (Axe 2) ou par transplantation d’organes (Axe 3). Il est également possible de combiner biomatériaux et cellules (Axe 4), ou de construire des implants à partir de cellules, de tissus ou d’organes (Axe 5). |
De façon intéressante, il est également possible et assez innovant de combiner des biomatériaux avec des cellules permettant ainsi d’obtenir des matériaux cellularisés in vitro qui peuvent être maturés, par exemple dans des bioréacteurs, avant leur implantation (Figure 1, axe 4). L’induction d’une différenciation cellulaire en trois dimensions est possible à cette étape [1]. Cette stratégie permet également d’utiliser les biomatériaux comme vecteurs pour la délivrance de cellules ou de produits de thérapie génique, tout particulièrement par des systèmes implantables ou injectables. Enfin, la construction d’implants à partir de cellules, de tissus ou d’organes (Figure 1, axe 5) est une voie relativement récente du domaine de l’ingénierie tissulaire. À nouveau, les phases de construction et de maturation peuvent être plus ou moins longues et complexes et être réalisées in vitro ou in vivo [2]. Il ne faut pas oublier également les processus de régénération in situ après implantation et ceci quelle que soit la stratégie utilisée, le patient étant alors considéré comme un « bioréacteur » et la source des différents constituants biologiques. Après le mariage de la science des matériaux et de la médecine, à l’origine des premiers biomatériaux, nous assistons désormais à l’intégration de l’ingénierie, de la biologie mais également de l’électronique. Ces technologies sont porteuses de développements de nouveaux produits de santé et bouleversent de nombreux champs médicaux comme la rhumatologie et la traumatologie, la prise en charge de pathologies cardiovasculaires ou la reconstruction des voies aérodigestives supérieures. Nous illustrerons ces approches d’ingénierie tissulaire en prenant comme exemple les stratégies de régénérations musculaires et vasculaires. |
Qu’est-ce que l’ingénierie tissulaire ? Le terme « ingénierie tissulaire » a été inventé par Y.C. Fung1 pour une application d’ingénierie à l’analyse de tissu natif. Ce terme a cependant été rapidement utilisé pour décrire les méthodes visant à produire, à partir de cellules humaines en culture, des tissus vivants pour restaurer, maintenir ou améliorer leur fonction. L’ingénierie tissulaire est une spécialité multidisciplinaire, au carrefour des sciences du vivant et des sciences de l’ingénieur, qui utilise le biomimétisme. Elle tire parti des avancées accomplies par les spécialistes de biologie et des progrès réalisés par les spécialistes des biomatériaux et du génie des procédés. Les équipes pionnières, comme celles de H. Green et E. Bell2, ont développé des constructions cutanées qui ont été rapidement traduites en utilisations cliniques dans les années 1980. Elles restent sans doute à ce jour les produits d’ingénierie tissulaire les plus aboutis. Dans les années 1990, l’utilisation de polymères synthétiques pour des échafaudages cellulaires est devenue une stratégie omniprésente, adoptée avec enthousiasme par les ingénieurs chimistes et les spécialistes des matériaux. Depuis, les termes de « thérapie cellulaire » et « médecine régénérative » ont également émergé et se chevauchent souvent [3]. Quelle que soit la stratégie employée, peu de produits en dehors de la peau ont réussi à atteindre le stade de commercialisation aux États-Unis ou en Europe, malgré les efforts massifs réalisés en recherche au cours des 20 dernières années. Ceci est dû en partie aux défis que représentent la faisabilité économique de ces produits et les processus de réglementation lourds et nouveaux qui entravent les progrès. En Europe, ces produits sont considérés comme des médicaments de thérapie avancée (ou, en anglais, advanced therapy medicinal products - ATMP). Ils sont constitués de cellules ou de tissus qui peuvent être viables ou non. Ils peuvent également comporter des substances supplémentaires comme des produits cellulaires, des biomolécules, des biomatériaux supports, des substances chimiques. Parmi les ATMP, on peut citer ChondroCelect® qui est une suspension de cellules de cartilage autologues cultivées pour la réparation de simples défauts symptomatiques du cartilage du condyle fémoral du genou chez les adultes (une technologie qui a été développée dans les années 1990) ; MACI® est un produit de réparation du cartilage de nouvelle génération. Il est composé de cellules de cartilage autologues cultivées sur une membrane de collagène. La fibrine, constitutive du caillot lors de la coagulation du sang, est utilisée pour maintenir en place MACI® sur le cartilage [4]. Des produits plus ambitieux tels que les vaisseaux sanguins et les vessies ont montré des résultats prometteurs dans des essais cliniques, mais ces développements sont ralentis en particulier par les coûts de développement et les questions réglementaires [5, 6]. |
Des tissus décellularisés ont été administrés chez l’homme pour remédier à des pertes musculaires massives. L’approche utilisée récemment par Sicari et al. chez l’homme repose sur l’administration d’un échafaudage biologique provenant d’une matrice extracellulaire (MEC) décellularisée xénogénique3 de vessie de porc afin de stimuler et de soutenir la régénération musculaire [7]. La MEC, présente dans tous les tissus, est constituée de protéines, de glycosaminoglycanes, et de facteurs de croissance qui forment un microenvironnement, ou niche, permettant la fonctionnalité, la différenciation, et la prolifération de types cellulaires spécifiques. Durant plusieurs décennies, l’équipe de S. Badylak, Department of Bioengineering, Université de Pittsburgh (États-Unis), a travaillé intensivement sur l’utilisation de la MEC xénogénique pour la réparation des tissus [8]. L’application clinique de ces matrices est déjà effective chez l’homme pour la réparation tissulaire dans le traitement des hernies et des ulcères de la peau. Leur effet bénéfique sur la régénération du tissu pourrait avoir pour origine leur rôle de support physique mais également leur capacité à créer un microenvironnement facilitant le recrutement de cellules capables de régénérer les tissus lésés. Cet effet trophique reposerait sur la présence de facteurs de croissance ou angiogéniques libérés lors de la dégradation de la matrice par les cellules immunitaires de l’hôte [9]. Les glycosaminoglycanes (GAG), présents dans la MEC, semblent jouer un rôle important dans la capacité de ces matrices à lier les facteurs de croissance. Ils induisent également une signalisation dans les cellules recrutées par l’intermédiaire des récepteurs qu’elles présentent à leur surface [10]. La MEC la plus largement utilisée est préparée à partir de la sous-muqueuse de l’intestin grêle du porc, une couche de tissu conjonctif riche en collagène et présentant une faible densité de cellules. Cette approche a été utilisée chez 5 patients (dont 3 militaires) présentant des pertes musculaires massives [7]. Du point de vue fonctionnel, une augmentation significative de la production de la force (jusqu’à 220 %) et une amélioration des performances des tâches et de l’équilibre ont été observées chez la plupart des patients. Les signes de régénération du tissu ont été mis en évidence chez trois d’entre eux. Cette étude représente donc une étape dans la traduction clinique de supports décellularisés dans le domaine de la régénération des tissus. La MEC acellulaire produite à partir du muscle constituerait un biomatériau dont la composition devrait être plus favorable au développement du tissu musculaire en fournissant une niche en trois dimensions qui soit optimale pour le développement des myocytes. En effet, les MEC de la muqueuse intestinale et de la vessie ont des densités cellulaires différentes de celle du muscle. Ainsi, dans des modèles précliniques murins, l’ensemencement cellulaire préalable de MEC de vessie avec une population hétérogène de cellules dérivées du muscle, permet d’obtenir une meilleure récupération fonctionnelle et une histologie plus organisée (fibres musculaires abondantes) du muscle que celle observée avec la MEC seule [11]. Il est tentant de supposer que la combinaison de la thérapie cellulaire et de la MEC musculaire pourrait conduire à des résultats encore meilleurs mais cette approche n’a pas encore été testée cliniquement. La décellularisation générale et les approches de recellularisation sont également en cours de développement afin de générer plusieurs organes tels que les poumons [12] ou la trachée [13]. Une approche hybride qui combine un polymère avec un revêtement de MEC naturelle pourrait fournir un produit économiquement viable. En effet, les dispositifs médicaux intégrant les propriétés mécaniques des matériaux synthétiques (comme le polypropylène) et les propriétés de remodelage tissulaire des matériaux naturels (comme la MEC ou des composants d’origine naturelle - collagène, glycosaminoglycanes, élastine, fibrine, soie, alginate, etc.) peuvent avoir des applications cliniques. S. Badylack a récemment publié une étude évaluant, à long terme, dans un modèle de blessure musculaire abdominale, les effets d’un revêtement constitué de MEC sur la réponse du tissu hôte après implantation de maille de polypropylène [14]. Ils ont ainsi constaté qu’un revêtement d’hydrogel et de MEC permettait d’atténuer la réponse inflammatoire chronique induite par la maille de polypropylène. Une meilleure intégration des mailles de polypropylène, lorsqu’elles sont incorporées dans un hydrogel de polysaccharide, a également été mise en évidence [15]. |
Dans les maladies cardiovasculaires, première cause de décès dans les pays développés, les pathologies d’origine athérosclérotique sont liées à des complications dues à l’épaississement de la paroi des vaisseaux sanguins. Malgré le développement de techniques endovasculaires peu invasives telles que l’angioplastie (technique chirurgicale utilisant des petits ballonnets gonflables pour dilater l’artère à l’endroit du rétrécissement) et la pose de stents (tuteur métallique tubulaire glissé dans l’artère pour la maintenir ouverte), l’implantation de substituts vasculaires par chirurgie reste nécessaire pour un nombre élevé de patients. Le remplacement vasculaire est réalisé soit de manière autologue, en employant une veine ou une artère prélevée chez le patient, soit à l’aide d’une prothèse, lorsque le patient n’a pas le capital vasculaire suffisant [16]. Quatre-vingt à 90 % de réussite à un an sont enregistrés avec les greffons veineux autologues grâce à la préservation de la surface luminale endothélialisée. À plus long terme (à 10 ans), un développement cellulaire (sténose hyperplasique), qui réduit le diamètre au niveau des jonctions avec la prothèse, apparaît cependant. Des greffes artérielles autologues sont utilisées pour les pontages coronariens, en raison de leurs meilleures propriétés mécaniques. Néanmoins, le nombre réduit des sites de prélèvement, la difficulté de dissection et leur fragilité, ou des qualités insuffisantes, réduisent leurs utilisations. Actuellement, les techniques de remplacement vasculaire par des prothèses synthétiques (composées de polytétrafluoroéthylène expansé, ou de polytéréphtalate d’éthylène) sont utilisées avec succès pour le remplacement d’artères de gros diamètre (supérieur à 6 mm). Toutefois, ces prothèses ne conviennent pas pour le remplacement d’artère de moyen ou petit calibre pour lesquelles on observe une faible compliance par rapport aux artères natives et une absence d’endothélialisation de la surface luminale de la prothèse, conduisant au développement de thromboses [17]. Depuis plusieurs années, des recherches en ingénierie tissulaire vasculaire ont pour objet le développement de prothèses comme matrices tridimensionnelles susceptibles d’être cellularisées avant d’être implantées chez le patient. Cette approche nécessite de développer de nouveaux biomatériaux qui soient adaptés à la réalisation de substituts de vaisseaux sanguins. Dans de nombreuses études, un système de culture cellulaire sous flux pulsatile est également associé. L’intérêt d’un tel système de culture est de pouvoir recréer in vitro un environnement mécanique biomimétique, proche des conditions hémodynamiques d’une artère de moyen calibre. On trouve ainsi des prothèses préexistantes cellularisées [18], des constructions basées sur des gels de constituants naturels comme le collagène, des matrices polymères biodégradables ou des feuillets cellulaires auto-assemblés en l’absence de support synthétique. Dans ce dernier cas, les travaux de N. L’heureux (Société Cytograft Tissue Engineering, aux États-Unis) ont permis de montrer la faisabilité de cette approche jusqu’à la démonstration de son application chez l’homme [19]. Dans cette nouvelle technique de fabrication de vaisseaux biologiques, les cellules du patient (il s’agit de fibroblastes cutanés prélevés par biopsie) cultivées au préalable sont roulées pour prendre la forme tubulaire d’un vaisseau. Des cellules endothéliales prélevées sur une veine superficielle du même patient, sont ensuite introduites dans cette prothèse, où elles en constituent la paroi interne, pour le contrôle des propriétés anti-thrombotiques. Comme il s’agit d’un tissu autologue, tout risque de rejet est ainsi évité. Des vaisseaux sanguins humains reconstruits par cette méthode ont été implantés avec succès comme fistule artério-veineuse4, chez des patients en dialyse [6]. Cependant, il s’agit d’un procédé qui comprend de nombreuses étapes, nécessitant plusieurs mois de réalisation avec un coût élevé. Des essais sont donc en cours avec des systèmes cultivés à partir de cellules provenant de banques cellulaires [20]. Une autre stratégie consiste à proposer un support temporaire permettant la régénération ou le remodelage du vaisseau par l’organisme, voire la croissance des assemblages biomatériaux/cellules (préparés in vitro préalablement à l’implantation) notamment pour les applications en chirurgie cardiaque pédiatrique : les travaux de Shinoka et al. [21] illustrent cette possibilité en utilisant l’association de supports résorbables à des cellules autologues de moelle osseuse. On peut également y adjoindre les techniques de tissus décellularisés ou de matrices modifiées pour capter des cellules endogènes afin de permettre la recolonisation de l’échafaudage. Lors de la phase d’application in vivo, les contraintes seront majeures car, après avoir pu insérer le tube vasculaire (sutures, colles, etc. [22, 23]), il est en effet nécessaire à la fois d’assurer la fonction de transport du sang et de favoriser la colonisation tout en conservant les propriétés mécaniques. Idéalement, le constituant initial du support doit se dégrader, et ceci sans conséquences défavorables pour les tissus comme par exemple une inflammation excessive. Il faut donc choisir des polymères biocompatibles qui ne soient pas thrombogènes. Certains des biomatériaux vasculaires sont donc conçus à partir de polymères biodégradables de type polysaccharidique (dextrane, pullulane, héparine, chitosane) et préparés sans solvant organique et peuvent prendre la forme de tubes de petits diamètres [22]. Le chitosane est ainsi largement utilisé comme hydrogel dans le domaine biomédical pour sa biorésorbabilité, sa biocompatibilité et son pouvoir bactériostatique. Les paramètres comme la masse molaire, la concentration en polymère, le degré d’acétylation, le processus de gélification dans la préparation de différents hydrogels à base de chitosane, conduisent à des réponses biologiques différentes [24]. Les hydrogels physiques préparés à partir de chitosane hautement acétylés sont en effet dégradés rapidement in vivo, et ne conviennent pas à la culture in vitro de cellules souches mésenchymateuses humaines ou de cellules endothéliales dérivées de leurs progéniteurs circulants [25]. En revanche, pour une même concentration, un chitosane présentant un degré d’acétylation bas (5 %) conduit à un matériau plus élastique et à une meilleure adhérence des cellules endothéliales à sa surface. Des essais sont en cours chez la brebis pour l’évaluation de ces prothèses vasculaires. Les prothèses vasculaires de 2 mm à base de pullulane/dextrane montrent chez le petit animal un taux élevé (75 %) de greffons fonctionnels à deux mois [22]. La nature des matériaux polysaccharidiques et l’absence de solvants organiques lors de la préparation semblent garantir une bonne tolérance de l’ensemble. Ces biomatériaux présentent de plus la capacité de colonisation cellulaire [26–28] (Figure 2).
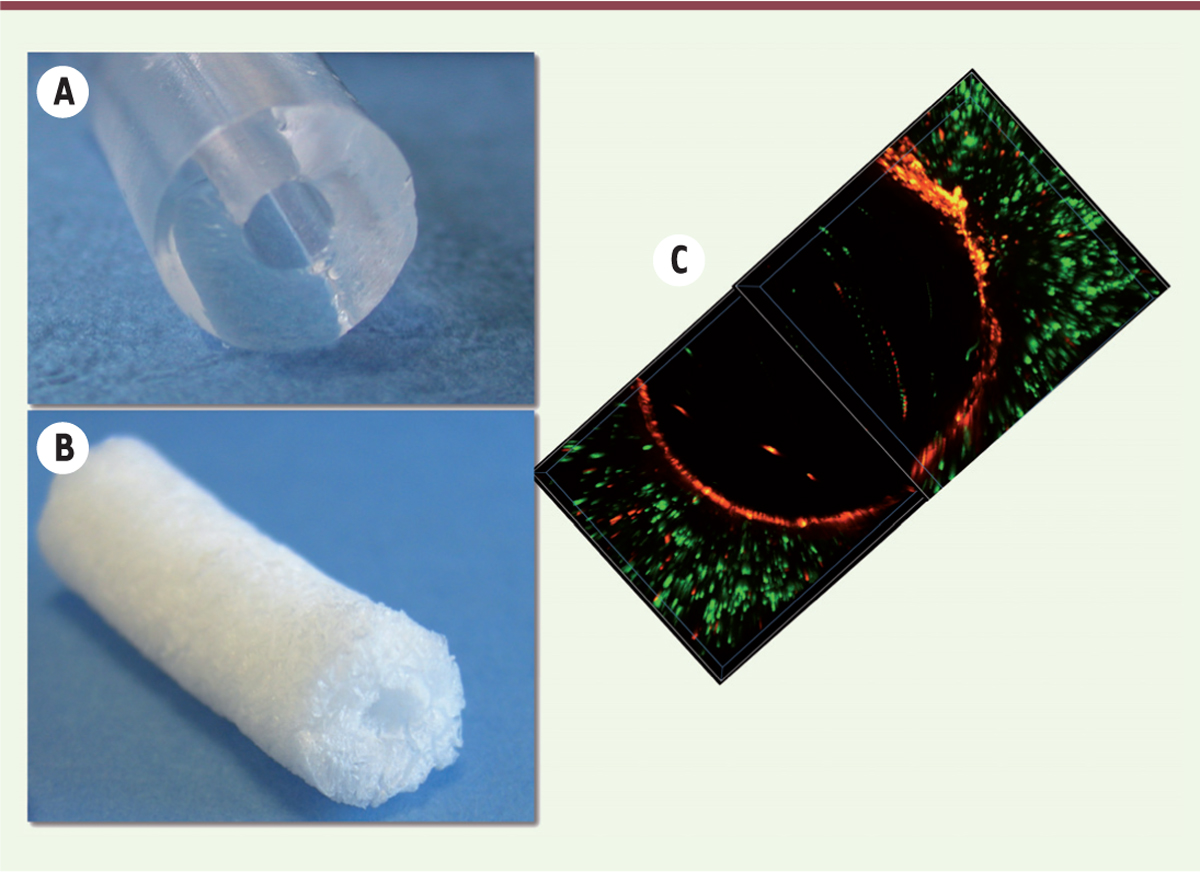
 | Figure 2.
Échafaudage à base de polysaccharide tubulaire et cellularisé. L’échafaudage tubulaire (A) est rendu poreux (B) pour l’ensemencement de cellules souches mésenchymateuses dans la structure et des progéniteurs endothéliaux dans la lumière (C). Les cellules souches mésenchymateuses ont été marquées en vert avec un composé fluorescent et de progéniteurs endothéliaux en rouge. La prolifération cellulaire pendant la culture du greffon a conduit à l’endothélialisation complète du tube (adapté de [ 28]). |
Des polymères à base d’acide polyvinylique ont également été préparés sous forme tubulaire. Ils possèdent des propriétés mécaniques adaptées pour l’implantation et une suturabilité qui permet facilement leur implantation [29]. L’ajout de gélatine dans la préparation a permis une meilleure adhérence cellulaire compatible avec une endothélialisation in situ des implants [30, 31]. Les recherches sont en cours pour savoir si ces petits vaisseaux de synthèse pourraient être utilisés chez l’homme d’ici quelques années. |
L’ingénierie tissulaire semble vouée à un fort développement. Des recherches sur de nombreux organes sont en cours. Il s’agit cependant d’une discipline qui est très récente et qui doit faire la démonstration de son intérêt chez l’homme, lorsque le choix du support et l’exploitation du matériel cellulaire auront été maîtrisés. La traduction clinique et la commercialisation sont évidemment plus accessibles pour les produits les plus simples. Même s’ils présentent un potentiel plus limité pour fournir des avancées thérapeutiques majeures, ils peuvent, paradoxalement, avoir un plus grand potentiel dans la génération d’un produit commercial et, éventuellement, une large diffusion chez les patients. Cependant, il pourrait être plus judicieux (sauf d’un point de vue financier immédiat) de trouver une solution complexe qui fonctionne et de la simplifier ultérieurement, plutôt que d’essayer de nombreuses solutions simples susceptibles d’échouer. La plupart des applications complexes pourraient nécessiter des solutions qui soient également complexes. Un long chemin reste à parcourir à la fois pour la recherche et pour le transfert vers des applications cliniques dans ce domaine récent. |
D. Letourneur déclare avoir une participation financière dans le capital de l’entreprise SILTISS et déclare être membre du conseil d’administration.
L. Bordenave déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Pietrzyk-Nivau A, Poirault-Chassac S, Gandrille S, et al. Three-dimensional environment sustains hematopoietic stem cell differentiation into platelet-producing megakaryocytes . PLoS One. 2015; ; 10 : :e0136652.. 2.
L’Heureux N, Dusserre N, Konig G, et al. Human tissue-engineered blood vessels for adult arterial revascularization . Nat Med. 2006; ; 12 : :361.–365. 3.
L’Heureux N, Letourneur D. Clinical translation of tissue-engineered constructs for severe leg injuries . Ann Transl Med. 2015; ; 3 : :134.. 4.
Ram-Liebig G, Bednarz J, Stuerzebecher B, et al. Regulatory challenges for autologous tissue engineered products on their way from bench to bedside in Europe . Adv Drug Del Rev. 2015; ; 82–83C : :181.–191. 5.
Atala A, Bauer SB, Soker S, et al. Tissue-engineered autologous bladders for patients needing cystoplasty . Lancet. 2006; ; 367 : :1241.–1246. 6.
McAllister TN, Maruszewski M, Garrido SA, et al. Effectiveness of haemodialysis access with an autologous tissue-engineered vascular graft: a multicentre cohort study . Lancet. 2009; ; 373 : :1440.–1446. 7.
Sicari BM, Rubin JP, Dearth CL, et al. An acellular biologic scaffold promotes skeletal muscle formation in mice and humans with volumetric muscle loss . Sci Transl Med. 2014; ; 6 : :234.ra258. 8.
Badylak SF, Freytes DO, Gilbert TW. Extracellular matrix as a biological scaffold material: Structure and function . Acta Biomater. 2009; ; 5 : :1.–13. 9.
Teodori L, Costa A, Marzio R, et al. Native extracellular matrix: a new scaffolding platform for repair of damaged muscle . Front Physiol. 2014; ; 5 : :218.. 10.
Chevalier F, Arnaud D, Henault E, et al. A fine structural modification of glycosaminoglycans is correlated with the progression of muscle regeneration after ischaemia: towards a matrix-based therapy? Eur Cell Mater. 2015; ; 30 : :51.–68. 11.
Corona BT, Ward CL, Baker HB, et al. Implantation of in vitro tissue engineered muscle repair constructs and bladder acellular matrices partially restore in vivo skeletal muscle function in a rat model of volumetric muscle loss injury . Tissue Eng Part A. 2014; ; 20 : :705.–715. 12.
Tsuchiya T, Sivarapatna A, Rocco K, et al. Future prospects for tissue engineered lung transplantation: decellularization and recellularization-based whole lung regeneration . Organogenesis. 2014; ; 10 : :196.–207. 13.
Martinod E, Radu DM, Chouahnia K, et al. Human transplantation of a biologic airway substitute in conservative lung cancer surgery . Ann Thorac Surg. 2011; ; 91 : :837.–842. 14.
Faulk DM, Londono R, Wolf MT, et al. ECM hydrogel coating mitigates the chronic inflammatory response to polypropylene mesh . Biomaterials. 2014; ; 35 : :8585.–8595. 15.
Abed A, Deval B, Assoul N, et al. A biocompatible polysaccharide hydrogel-embedded polypropylene mesh for enhanced tissue integration in rats . Tissue Eng Part A. 2008; ; 14 : :519.–527. 16.
Kannan RY, Salacinski HJ, Butler PE, et al. Current status of prosthetic bypass grafts: a review . J Biomed Mater Res B. 2005; ; 74 : :570.–581. 17.
Li S, Henry JJ. Nonthrombogenic approaches to cardiovascular bioengineering . Annu Rev Biomed Eng. 2011; ; 13 : :451.–475. 18.
Thebaud NB, Bareille R, Remy M, et al. Human progenitor-derived endothelial cells vs. venous endothelial cells for vascular tissue engineering: an in vitro study . J Tissue Eng Regen Med. 2010; ; 4 : :473.–484. 19.
L’Heureux N, McAllister TN, de la Fuente LM. Tissue-engineered blood vessel for adult arterial revascularization . N Engl J Med. 2007; ; 357 : :1451.–1453. 20.
Wystrychowski W, Cierpka L, Zagalski K, et al. Case study: first implantation of a frozen, devitalized tissue-engineered vascular graft for urgent hemodialysis access . J Vasc Access. 2011; ; 12 : :67.–70. 21.
Shin’oka T, Matsumura G, Hibino N, et al. Midterm clinical result of tissue-engineered vascular autografts seeded with autologous bone marrow cells . J Thorac Cardiovasc Surg. 2005; ; 129 : :1330.–1338. 22.
Chaouat M, Le Visage C, Autissier A, et al. The evaluation of a small-diameter polysaccharide-based arterial graft in rats . Biomaterials. 2006; ; 27 : :5546.–5553. 23.
Meddahi-Pelle A, Legrand A, Marcellan A, et al. Organ repair, hemostasis, and in vivo bonding of medical devices by aqueous solutions of nanoparticles . Angewandte Chemie. 2014; ; 53 : :6369.–6373. 24.
Rami L, Malaise S, Delmond S, et al. Physicochemical modulation of chitosan-based hydrogels induces different biological responses: interest for tissue engineering . J Biomed Mater Res A. 2014; ; 102 : :3666.–3676. 25.
Malaise S, Rami L, Montembault A, et al. Bioresorption mechanisms of chitosan physical hydrogels: a scanning electron microscopy study . Mater Sci Eng C Mater Biol Appl. 2014; ; 42 : :374.–384. 26.
Lavergne M, Derkaoui M, Delmau C, et al. Porous polysaccharide-based scaffolds for human endothelial progenitor cells . Macromol Biosci. 2012; ; 12 : :901.–910. 27.
Le Visage C, Gournay O, Benguirat N, et al. Mesenchymal stem cell delivery into rat infarcted myocardium using a porous polysaccharide-based scaffold: a quantitative comparison with endocardial injection . Tissue Eng Part A. 2012; ; 18 : :35.–44. 28.
Fayol D, Le Visage C, Ino J, et al. Design of Biomimetic vascular grafts with magnetic endothelial patterning . Cell Transplantation. 2013; ; 22 : :2105.–2118. 29.
Chaouat M, Le Visage C, Baille WE, et al. A novel cross-linked poly(vinyl alcohol) (PVA) for vascular grafts . Adv Funct Mater. 2008; ; 18 : :2855.–2861. 30.
Ino JM, Chevallier P, Letourneur D, et al. Plasma functionalization of poly(vinyl alcohol) hydrogel for cell adhesion enhancement . Biomatter. 2013 ; :3.. 31.
Ino JM, Sju E, Ollivier V, et al. Evaluation of hemocompatibility and endothelialization of hybrid poly(vinyl alcohol) (PVA)/gelatin polymer films . J Biomed Mater Res Part B. 2013; ; 101 : :1549.–1559. |