1.
Godfrey C, Foley AR, Clement E, et al. Dystroglycanopathies: coming into focus . Curr Opin Genet Dev. 2011; ; 21 : :278.–285.
2.
Devisme L, Bouchet C, Gonzales M, et al. Cobblestone lissencephaly: neuropathological subtypes and correlations with genes of dystroglycanopathies . Brain. 2012; ; 135 : :469.–482.
3.
Stalnaker SH, Aoki K, Lim JM, et al. Glycomic analyses of mouse models of congenital muscular dystrophy . J Biol Chem. 2011; ; 286 : :21180.–21190.
4.
Henry MD, Campbell KP. Dystroglycan: an extracellular matrix receptor linked to the cytoskeleton . Curr Opin Cell Biol. 1996; ; 8 : :625.–631.
5.
Barresi R, Campbell KP. Dystroglycan: from biosynthesis to pathogenesis of human disease . J Cell Sci. 2006; ; 119 : :199.–207.
6.
Michele DE, Barresi R, Kanagawa M, et al. Post-translational disruption of dystroglycan-ligand interactions in congenital muscular dystrophies . Nature. 2002; ; 418 : :417.–422.
7.
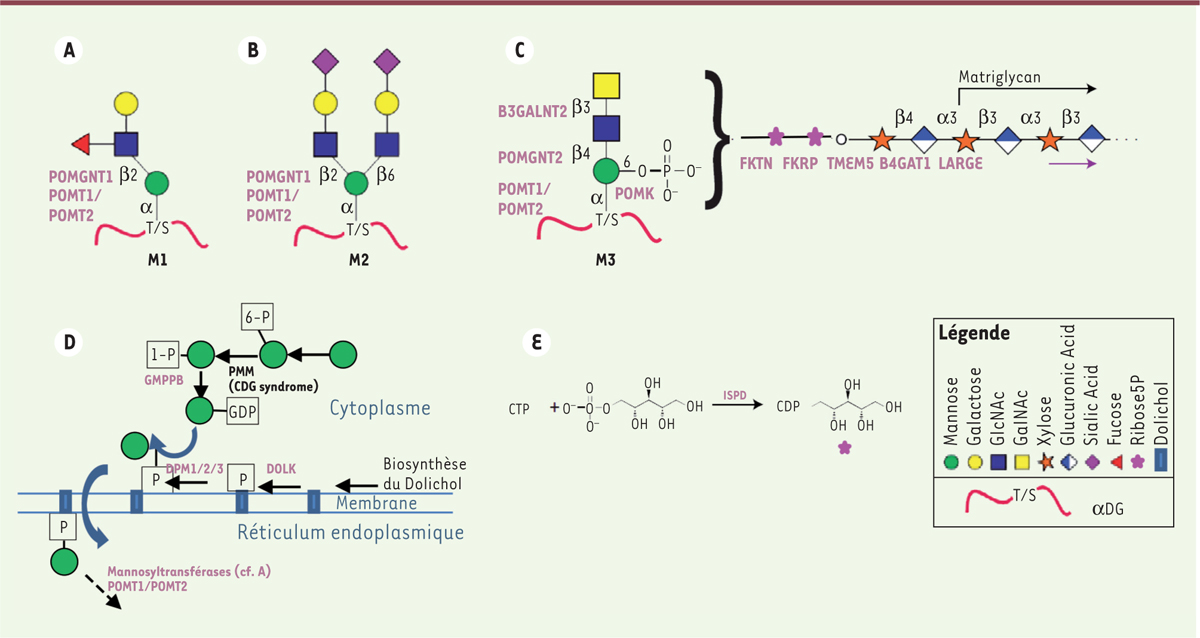
Yoshida-Moriguchi T, Willer T, Anderson ME, et al. SGK196 is a glycosylation-specific O-mannose kinase required for dystroglycan function . Science. 2013; ; 341 : :896.–899.
8.
Kanagawa M, Kobayashi K, Tajiri M, et al. Identification of a post-translational modification with ribitol-phosphate and its defect in muscular dystrophy . Cell Rep. 2016; ; 14 : :2209.–2223.
9.
Praissman JL, Willer T, Sheikh MO, et al. The functional O-mannose glycan on alpha-dystroglycan contains a phospho-ribitol primed for matriglycan addition . Elife. 2016; ; 5 : :14473..
10.
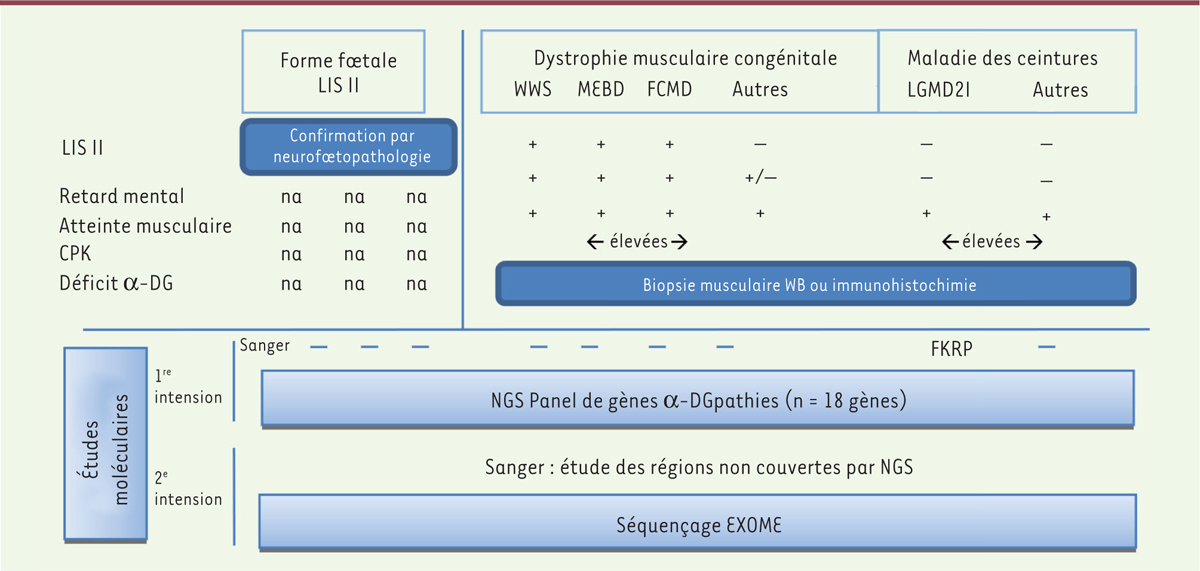
Geis T, Marquard K, Rodl T, et al. Homozygous dystroglycan mutation associated with a novel muscle-eye-brain disease-like phenotype with multicystic leucodystrophy . Neurogenetics. 2013; ; 14 : :205.–213.
11.
Hara Y, Balci-Hayta B, Yoshida-Moriguchi T, et al. A dystroglycan mutation associated with limb-girdle muscular dystrophy . N Engl J Med. 2011; ; 364 : :939.–946.
12.
Manya H, Chiba A, Yoshida A, et al. Demonstration of mammalian protein O-mannosyltransferase activity: coexpression of POMT1 and POMT2 required for enzymatic activity . Proc Natl Acad Sci USA. 2004; ; 101 : :500.–505.
13.
Beltran-Valero de Bernabe D, Currier S, Steinbrecher A, et al. Mutations in the O-mannosyltransferase gene POMT1 give rise to the severe neuronal migration disorder Walker-Warburg syndrome . Am J Hum Genet. 2002; ; 71 : :1033.–1043.
14.
Godfrey C, Clement E, Mein R, et al. Refining genotype phenotype correlations in muscular dystrophies with defective glycosylation of dystroglycan . Brain. 2007; ; 130 : :2725.–2735.
15.
Yanagisawa A, Bouchet C, Quijano-Roy S, et al. POMT2 intragenic deletions and splicing abnormalities causing congenital muscular dystrophy with mental retardation . Eur J Med Genet. 2009; ; 52 : :201.–206.
16.
Balci B, Uyanik G, Dincer P, et al. An autosomal recessive limb girdle muscular dystrophy (LGMD2) with mild mental retardation is allelic to Walker-Warburg syndrome (WWS) caused by a mutation in the POMT1 gene . Neuromuscul Disord. 2005; ; 15 : :271.–275.
17.
Yoshida A, Kobayashi K, Manya H, et al. Muscular dystrophy and neuronal migration disorder caused by mutations in a glycosyltransferase, POMGnT1 . Dev Cell. 2001; ; 1 : :717.–724.
18.
Santavuori P, Somer H, Sainio K, et al. Muscle-eye-brain disease (MEB) . Brain Dev. 1989; ; 11 : :147.–153.
19.
Manzini MC, Tambunan DE, Hill RS, et al. Exome sequencing and functional validation in zebrafish identify GTDC2 mutations as a cause of Walker-Warburg syndrome . Am J Hum Genet. 2012; ; 91 : :541.–547.
20.
Hedberg C, Oldfors A, Darin N. B3GALNT2 is a gene associated with congenital muscular dystrophy with brain malformations . Eur J Hum Genet. 2014; ; 22 : :707.–710.
21.
Stevens E, Carss KJ, Cirak S, et al. Mutations in B3GALNT2 cause congenital muscular dystrophy and hypoglycosylation of alpha-dystroglycan . Am J Hum Genet. 2013; ; 92 : :354.–365.
22.
Inamori K, Hara Y, Willer T, et al. Xylosyl- and glucuronyltransferase functions of LARGE in alpha-dystroglycan modification are conserved in LARGE2 . Glycobiology. 2013; ; 23 : :295.–302.
23.
Willer T, Inamori K, Venzke D, et al. The glucuronyltransferase B4GAT1 is required for initiation of LARGE-mediated alpha-dystroglycan functional glycosylation . Elife. 2014; ; 3 : :e14473..
24.
Inamori K, Yoshida-Moriguchi T, Hara Y, et al. Dystroglycan function requires xylosyl- and glucuronyltransferase activities of LARGE . Science. 2012; ; 335 : :93.–96.
25.
Yoshida-Moriguchi T, Yu L, Stalnaker SH, et al. O-mannosyl phosphorylation of alpha-dystroglycan is required for laminin binding . Science. 2010; ; 327 : :88.–92.
26.
Hildyard JC, Lacey E, Booler H, et al. Transgenic rescue of the LARGEmyd mouse: a LARGE therapeutic window? . PLoS One. 2016; ; 11 : :e0159853..
27.
Vuillaumier-Barrot S, Bouchet-Seraphin C, Chelbi M, et al. Intragenic rearrangements in LARGE and POMGNT1 genes in severe dystroglycanopathies . Neuromuscul Disord. 2011; ; 21 : :782.–790.
28.
Vuillaumier-Barrot S, Bouchet-Seraphin C, Chelbi M, et al. Identification of mutations in TMEM5 and ISPD as a cause of severe cobblestone lissencephaly . Am J Hum Genet. 2012; ; 91 : :1135.–1143.
29.
Astrea G, Pezzini I, Picillo E, et al. TMEM5-associated dystroglycanopathy presenting with CMD and mild limb-girdle muscle involvement . Neuromuscul Disord. 2016; ; 26 : :459.–461.
30.
Clarke NF, Maugenre S, Vandebrouck A, et al. Congenital muscular dystrophy type 1D (MDC1D) due to a large intragenic insertion/deletion, involving intron 10 of the LARGE gene . Eur J Hum Genet. 2011; ; 19 : :452.–457.
31.
Longman C, Brockington M, Torelli S, et al. Mutations in the human LARGE gene cause MDC1D, a novel form of congenital muscular dystrophy with severe mental retardation and abnormal glycosylation of alpha-dystroglycan . Hum Mol Genet. 2003; ; 12 : :2853.–2861.
32.
Meilleur KG, Zukosky K, Medne L, et al. Clinical, pathologic, and mutational spectrum of dystroglycanopathy caused by LARGE mutations . J Neuropathol Exp Neurol. 2014; ; 73 : :425.–441.
33.
Mercuri E, Messina S, Bruno C, et al. Congenital muscular dystrophies with defective glycosylation of dystroglycan: a population study . Neurology. 2009; ; 72 : :1802.–1809.
34.
Van Reeuwijk J, Grewal PK, Salih MA, et al. Intragenic deletion in the LARGE gene causes Walker-Warburg syndrome . Hum Genet. 2007; ; 121 : :685.–690.
35.
Buysse K, Riemersma M, Powell G, et al. Missense mutations in beta-1,3-N-acetylglucosaminyltransferase 1 (B3GNT1) cause Walker-Warburg syndrome . Hum Mol Genet. 2013; ; 22 : :1746.–1754.
36.
Shaheen R, Faqeih E, Ansari S, et al. A truncating mutation in B3GNT1 causes severe Walker-Warburg syndrome . Neurogenetics. 2013; ; 14 : :243.–245.
37.
Di Costanzo S, Balasubramanian A, Pond HL, et al. POMK mutations disrupt muscle development leading to a spectrum of neuromuscular presentations . Hum Mol Genet. 2014; ; 23 : :5781.–5792.
38.
von Renesse A, Petkova MV, Lutzkendorf S, et al. POMK mutation in a family with congenital muscular dystrophy with merosin deficiency, hypomyelination, mild hearing deficit and intellectual disability . J Med Genet. 2014; ; 51 : :275.–282.
39.
Kobayashi K, Nakahori Y, Miyake M, et al. An ancient retrotransposal insertion causes Fukuyama-type congenital muscular dystrophy . Nature. 1998; ; 394 : :388.–392.
40.
Vuillaumier-Barrot S, Quijano-Roy S, Bouchet-Seraphin C, et al. Four Caucasian patients with mutations in the fukutin gene and variable clinical phenotype . Neuromuscul Disord. 2009; ; 19 : :182.–188.
41.
Brockington M, Yuva Y, Prandini P, et al. Mutations in the fukutin-related protein gene (FKRP) identify limb girdle muscular dystrophy 2I as a milder allelic variant of congenital muscular dystrophy MDC1C . Hum Mol Genet. 2001; ; 10 : :2851.–2859.
42.
Walter MC, Petersen JA, Stucka R, et al. FKRP (826C>A) frequently causes limb-girdle muscular dystrophy in German patients . J Med Genet. 2004; ; 41 : :e50..
43.
Beltran-Valero de Bernabe D, Voit T, Longman C, et al. Mutations in the FKRP gene can cause muscle-eye-brain disease and Walker-Warburg syndrome . J Med Genet. 2004; ; 41 : :e61..
44.
Van Reeuwijk J, Olderode-Berends MJ, Van den Elzen C, et al. A homozygous FKRP start codon mutation is associated with Walker-Warburg syndrome, the severe end of the clinical spectrum . Clin Genet. 2010; ; 78 : :275.–281.
45.
Gerin I, Ury B, Breloy I, et al. ISPD produces CDP-ribitol used by FKTN and FKRP to transfer ribitol phosphate onto alpha-dystroglycan . Nat Commun. 2016; ; 7 : :11534..
46.
Roscioli T, Kamsteeg EJ, Buysse K, et al. Mutations in ISPD cause Walker-Warburg syndrome and defective glycosylation of alpha-dystroglycan . Nat Genet. 2012; ; 44 : :581.–585.
47.
Willer T, Lee H, Lommel M, et al. ISPD loss-of-function mutations disrupt dystroglycan O-mannosylation and cause Walker-Warburg syndrome . Nat Genet. 2012; ; 44 : :575.–580.
48.
Maeda Y, Kinoshita T. Dolichol-phosphate mannose synthase: structure, function and regulation . Biochim Biophys Acta. 2008; ; 1780 : :861.–868.
49.
Barone R, Aiello C, Race V, et al. DPM2-CDG: a muscular dystrophy-dystroglycanopathy syndrome with severe epilepsy . Ann Neurol. 2012; ; 72 : :550.–558.
50.
Lefeber DJ, de Brouwer AP, Morava E, et al. Autosomal recessive dilated cardiomyopathy due to DOLK mutations results from abnormal dystroglycan O-mannosylation . PLoS Genet. 2011; ; 7 : :e1002427..
51.
Yang AC, Ng BG, Moore SA, et al. Congenital disorder of glycosylation due to DPM1 mutations presenting with dystroglycanopathy-type congenital muscular dystrophy . Mol Genet Metab. 2013; ; 110 : :345.–351.
52.
Lefeber DJ, Schonberger J, Morava E, et al. Deficiency of Dol-P-Man synthase subunit DPM3 bridges the congenital disorders of glycosylation with the dystroglycanopathies . Am J Hum Genet. 2009; ; 85 : :76.–86.
53.
Ning B, Elbein AD. Cloning, expression and characterization of the pig liver GDP-mannose pyrophosphorylase. Evidence that GDP-mannose and GDP-Glc pyrophosphorylases are different proteins . Eur J Biochem. 2000; ; 267 : :6866.–6874.
54.
Carss KJ, Stevens E, Foley AR, et al. Mutations in GDP-mannose pyrophosphorylase B cause congenital and limb-girdle muscular dystrophies associated with hypoglycosylation of alpha-dystroglycan . Am J Hum Genet. 2013; ; 93 : :29.–41.
55.
Raphael AR, Couthouis J, Sakamuri S, et al. Congenital muscular dystrophy and generalized epilepsy caused by GMPPB mutations . Brain Res. 2014; ; 1575 : :66.–71.
56.
Inamori KI, Beedle AM, de Bernabe DB,
et al. LARGE2-dependent glycosylation confers laminin-binding ability on proteoglycans .
Glycobiology. July 22., 2016. doi:
10.1093/glycob/cww075.
57.
Varki A. Essentials of glycobiology . Glycobiology. 2015; ; 25 : :1323.–1324.