| |
| Med Sci (Paris). 32(12): 1076–1078. doi: 10.1051/medsci/20163212010.L’hormone anti-müllérienne : un nouveau régulateur des cellules gonadotropes hypophysaires Implication dans le dimorphisme sexuel de l’activité gonadotrope avant la puberté Ghislaine Garrel,1,2,3* Chrystèle Racine,1,2,3 David L’Hôte,1,2,3 Chantal Denoyelle,1,2,3 Céline J. Guigon,1,2,3 Nathalie di Clemente,1,2,3 and Joëlle Cohen-Tannoudji1,2,3 1Université Paris-Diderot, Sorbonne Paris Cité, Biologie fonctionnelle et adaptative (BFA), Bâtiment A Buffon, 4, rue MA Lagroua Weill-Hallé, F-75013Paris, France 2CNRS UMR 8251, Paris, France 3Inserm U1133, Physiologie de l’axe gonadotrope, Paris, France MeSH keywords: Animaux, Hormone antimullérienne, Femelle, Cellules gonadotropes, Humains, Mâle, Puberté, Caractères sexuels, Maturation sexuelle, pharmacologie, cytologie, effets des médicaments et substances chimiques, physiologie |
L’hormone anti-müllérienne (AMH) ou mullerian-inhibiting substance (MIS) a été identifiée par Alfred Jost dans les années 1950 comme un facteur testiculaire clé de la différenciation sexuelle mâle, responsable de la régression des canaux de Müller chez le fœtus [1]. De nombreux travaux ont depuis démontré que l’AMH est synthétisée par les gonades mâle et femelle chez de nombreuses espèces de vertébré. Elle y contrôle de manière paracrine et autocrine la stéroïdogenèse1,. L’AMH inhibe également le recrutement des follicules primordiaux dans l’ovaire de mammifères et elle est utilisée, aujourd’hui, comme un marqueur de la réserve folliculaire et de la fertilité chez la femme [1]. L’AMH appartient à la superfamille du TGFβ (transforming growth factor beta). C’est une glycoprotéine synthétisée sous la forme d’un précurseur qui se dimérise (140 kDa) et devient actif après avoir subi un clivage protéolytique. L’AMH se lie à un récepteur spécifique de type II (l’AMHR2) qui active, par l’intermédiaire d’un récepteur de type I (l’ALK[activin receptor-like kinase]2, 3 ou 6), les protéines Smad 1/5/8 qui sont impliquées dans la régulation de l’expression de gènes cibles [1]. À partir des années 2000, différents travaux ont relaté la présence du récepteur AMHR2 hors des gonades et notamment dans d’autres organes de la reproduction (glande mammaire, utérus et prostate) mais aussi dans le poumon fœtal et le cerveau. L’AMHR2 est en particulier exprimé dans les motoneurones de la moelle épinière, le cortex cérébral et l’hypothalamus, chez la souris [2–4]. Une seule étude témoigne de la présence d’AMHR2 dans l’hypophyse chez le rat mâle et femelle [5]. Le rôle physiologique de l’AMH dans ces différents organes demeure mal connu. Elle pourrait contribuer au dimorphisme sexuel du développement cérébral. Ainsi, il a été rapporté que l’invalidation du gène codant l’AMH chez la souris mâle est associée à une féminisation partielle du comportement d’exploration [6]. Très récemment, une étude effectuée chez la souris témoigne de l’expression de l’AMHR2 dans l’hippocampe ainsi que dans les neurones hypothalamiques, libérant la gonadotropin releasing hormone (GnRH) qui contrôle la fonction de reproduction [7, 13] (→).
(→) Voir la Nouvelle de S. Catteau-Jonard et al., m/s n° 5, mai 2016, page 441
|
Quel rôle pour l’AMH dans l’hypophyse ? Ces données soulèvent donc l’idée que l’AMH pourrait participer au contrôle endocrine et neuroendocrine de la reproduction en agissant sur le complexe hypothalamo-hypophysaire. Dans l’hypophyse, les cellules gonadotropes sécrètent, sous l’influence de la GnRH, deux gonadotropines : la luteinizing hormone (LH) et la follicle-stimulating hormone (FSH). Ces deux hormones sont essentielles à la fonction de reproduction. Elles contrôlent en effet l’activité des gonades. Elles sont constituées de deux sous-unités, une sous-unité α qui leur est commune et une sous-unité β qui est spécifique de chaque hormone et qui sont codées par des gènes distincts [8, 9]. Par des approches in vitro et aussi in vivo chez le rat, nous avons ainsi recherché si l’AMH pouvait réguler l’activité des cellules gonadotropes de l’hypophyse. |
Nous avons dans un premier temps analysé l’action de l’AMH sur la lignée gonadotrope murine LβT2, en testant à la fois la forme précurseur de l’AMH et la forme clivée. Nos résultats ont montré que les deux formes de l’AMH étaient capables de stimuler de manière dose-dépendante l’expression du gène Fshb (follicle stimulating hormone beta subunit). Elles agissent cependant avec des cinétiques différentes. La forme clivée agit rapidement, dès 4 h, tandis que le précurseur atteint son effet maximal après 24 h. Les cellules gonadotropes sont donc capables d’activer, par son clivage, le précurseur de l’AMH. Dans toutes les conditions testées, l’expression du gène Lhb (luteinizing hormone beta subunit) n’est pas modifiée. Ce résultat révèle que l’AMH est un des rares facteurs qui ne cible que la FSH. Elle contribuerait ainsi à la régulation différentielle des deux gonadotropines. Son action sur l’expression de Fshb est couplée à l’activation de la voie Smad. En effet, dans les cellules LβT2, l’AMH induit la phosphorylation des protéines Smad1/5/8 qui sont des activateurs puissants de l’expression de Fshb [10]. Dans les lignées GH3, AtT20 et TαT, des cellules qui sont représentatives des autres lignages hypophysaires endocrines, le niveau d’expression de l’Amhr2 est bien plus faible (plus de vingt fois moins) et aucune activation de la voie Smad n’a été observée sous l’effet de l’AMH. L’AMH agirait donc spécifiquement sur les cellules gonadotropes de l’hypophyse. L’AMH pourrait agir de concert avec d’autres facteurs régulateurs de la synthèse de FSH comme l’activine ou le BMP2 (bone morphogenetic protein-2) qui sont de puissants inducteurs de Fshb. Nous avons observé qu’elle potentialisait les effets de l’activine alors qu’elle inhibait celui du BMP2 sur l’expression de Fshb. Ceci démontre donc que l’AMH peut réguler la FSH hypophysaire via une interaction avec d’autres facteurs [10]. |
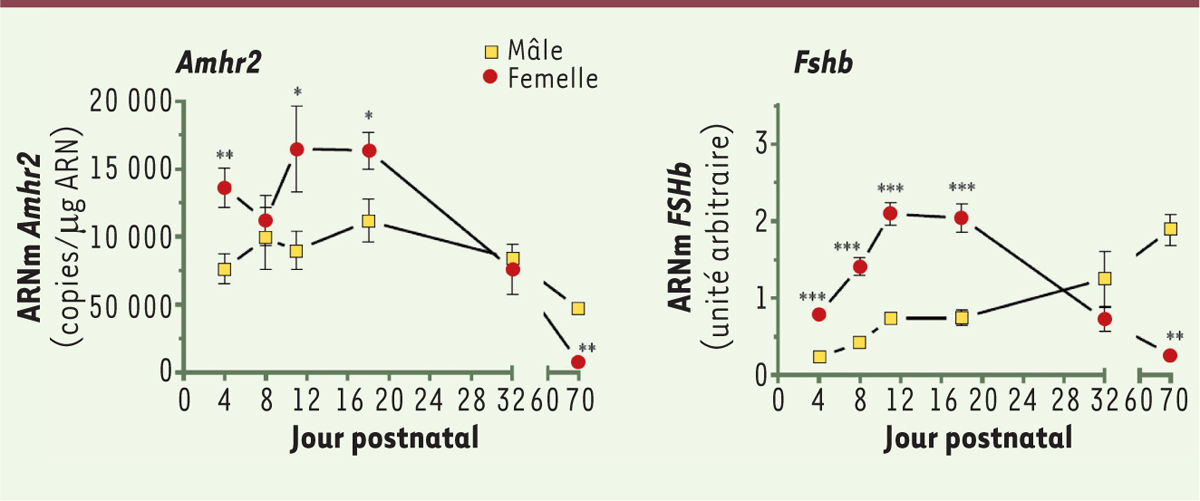
Dimorphisme sexuel de l’expression de l’ Amhr2 hypophysaire chez le rat Afin d’évaluer s’il existe une fenêtre privilégiée d’action de l’AMH dans l’hypophyse, nous avons quantifié les ARN messagers de l’Amhr2 dans l’hypophyse chez l’adulte et au cours de la période immature de rats mâle et femelle. Nous avons observé que le nombre de copies d’ARNm Amhr2 est environ deux fois plus élevé chez la femelle que chez le mâle entre le 4e et le 18e jour post-natal (jpn) excepté à 8 jpn (Figure 1). Aucune différence n’est détectable à 32 jpn. À l’âge adulte, la situation s’inverse, la quantité d’ARNm Amhr2 devient très faible chez la femelle. De façon intéressante, ce profil est en fait très proche de celui de Fshb (Figure 1). Ces résultats témoignent donc d’un dimorphisme sexuel de l’expression de l’Amhr2 au niveau de l’hypophyse et suggèrent que l’AMH pourrait jouer un rôle important, chez la femelle, dans la période prépubertaire.
 | Figure 1.
Ontogenèse postnatale de l’expression des gènes Amhr2 et Fshb dans l’antéhypophyse de rats mâles et femelles. Les antéhypophyses de rats mâles et femelles Wistar ont été collectées au 4e, 8e, 11e, 18e, 32e ou 72e jour postnatal. Les niveaux des transcrits ont été mesurés par PCR quantitative en temps réel et exprimés en nombre de copie/µg d’ARN totaux pour l’Amhr2 (méthode Taqman) et en unité arbitraire pour le gène Fshb. Chaque valeur représente la moyenne ± SEM de 6 à 13 rats. * P ≤ 0,05 ; ** P ≤ 0,01 ; *** P ≤ 0,001 par rapport aux mâles du même âge. Amhr2 : anti-Müllerian hormone receptor type 2 ; Fshb : follicle stimulating hormone beta subunit. SEM : erreur standard à la moyenne. |
Nous avons également détecté les messagers codant l’AMH dans l’hypophyse de rats et aucune différence entre le mâle et la femelle n’a été observée au cours de la période immature. Leur présence suggère que l’AMH pourrait agir de manière paracrine/autocrine dans ce tissu. À l’âge adulte, les transcrits de l’AMH deviennent indétectables dans les deux sexes. |
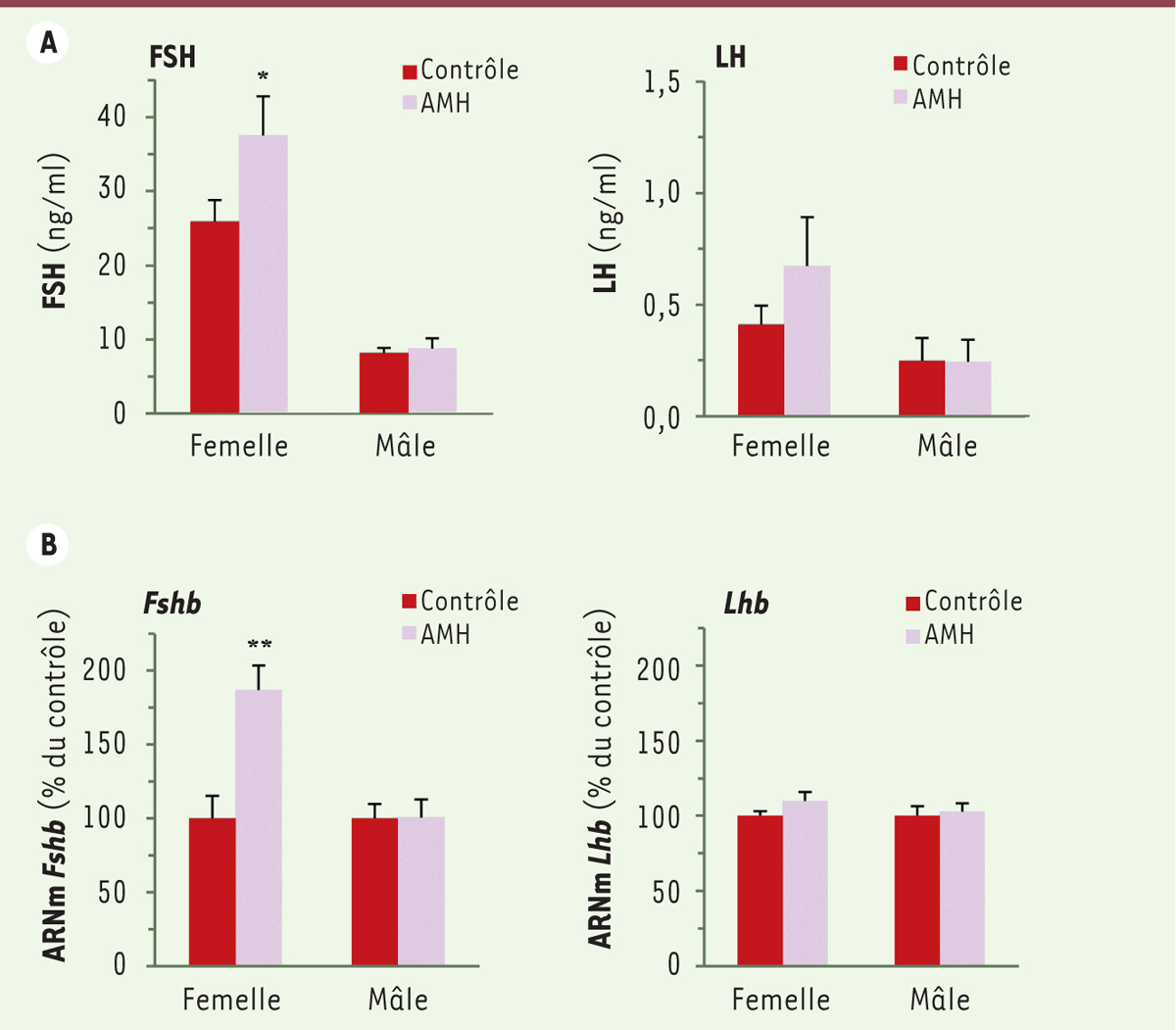
Effet in vivo de l’AMH chez le rat prépubère Pour évaluer son effet in vivo, nous avons choisi d’injecter l’AMH lors de la période immature, à un stade de fort dimorphisme sexuel de l’expression de l’Amhr2 (18 jpn). L’administration d’AMH (10 µg en injection intrapéritonéale) provoque une augmentation de l’expression du gène Fshb dans l’hypophyse et une augmentation de la concentration sérique de FSH, 18 heures après l’injection et cela uniquement chez la femelle (Figure 2A et 2B). L’expression hypophysaire du gène Lhb et le taux sanguin de LH restent inchangés chez la femelle comme chez le mâle (Figure 2A et 2B). L’administration d’AMH n’affecte pas les niveaux circulants d’oestradiol (ni de testostérone chez le mâle) suggérant que les modifications observées proviennent d’un effet direct sur l’hypophyse et ne sont pas la conséquence d’une modification de l’activité ovarienne.
 | Figure 2.
L’hormone anti-müllérienne (AMH) stimule, in vivo, la sécrétion de FSH et l’expression du gène Fshb chez le rat femelle immature mais pas chez le mâle. Une injection intrapéritonéale de 100 µl d’une solution de sérum physiologique contenant ou non le précurseur de l’AMH (10 µg) a été administrée à des rats mâles et femelles au 17e jour postnatal. Les concentrations sériques de FSH et LH (A) ainsi que les niveaux d’expression hypophysaire des gènes Fshb et Lhb
(B) ont été déterminés 18 heures après l’injection. Chaque valeur représente la moyenne ± SEM de 13 rats. * P ≤ 0,05 ; ** P ≤ 0,01 par rapport aux rats contrôles. FSH : follicle-stimulating hormone ; LH : luteinizing hormone ; Fshb : follicle stimulating hormone beta subunit ; Lhb : luteinizing hormone beta subunit ; SEM : erreur standard à la moyenne. |
Ces résultats établissent donc que l’AMH est capable d’agir in vivo sur l’activité gonadotrope hypophysaire en stimulant la synthèse de FSH chez la femelle sans affecter la LH. Cet effet pourrait être impliqué dans le dimorphisme sexuel de l’activité gonadotrope hypophysaire dans la période infantile qui se traduit par une plus forte sécrétion de FSH chez la femelle que chez le mâle [11]. Les mécanismes mis en jeu dans cette élévation de FSH, essentielle à la mise en place de la fonction de reproduction de la femelle, restent encore mal connus. En faveur d’un rôle important de l’AMH dans la fonction gonadotrope, nous avons également observé que la GnRH, régulateur majeur des cellules gonadotropes, diminue les niveaux des transcrits Amhr2 et de la protéine AMHR2, in vivo chez le rat femelle de 18 jpn ainsi qu’in vitro sur les cellules LβT2. Un réseau complexe d’interactions semble donc se mettre en place entre l’AMH, d’autres membres de la famille TGFβ et la GnRH pour réguler finement la synthèse de FSH. Le défi sera maintenant de déterminer si des altérations du système AMH dans l’hypophyse peuvent être associées à des désordres de la puberté2. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Josso N, Picard JY, Rey R, di Clemente N. Testicular anti-Mullerian hormone: history, genetics, regulation and clinical applications . Pediatr Endocrinol Rev. 2006; ; 3 : :347.–358. 2.
Lebeurrier N, Launay S, Macrez R, et al. Anti-Mullerian-hormone-dependent regulation of the brain serine-protease inhibitor neuroserpin . J Cell Sci. 2008; ; 121 : :3357.–3365. 3.
Wang PY, Koishi K, McGeachie AB, et al. Mullerian inhibiting substance acts as a motor neuron survival factor in vitro . Proc Natl Acad Sci USA. 2005; ; 102 : :16421.–16425. 4.
Wittmann W, McLennan IS. Anti-Mullerian hormone may regulate the number of calbindin-positive neurons in the sexually dimorphic nucleus of the preoptic area of male mice . Biol Sex Differ. 2013; ; 4 : :18.. 5.
Bedecarrats GY, O’Neill FH, Norwitz ER, et al. Regulation of gonadotropin gene expression by Mullerian inhibiting substance . Proc Natl Acad Sci USA. 2003; ; 100 : :9348.–9353. 6.
Wang PY, Protheroe A, Clarkson AN, et al. Mullerian inhibiting substance contributes to sex-linked biases in the brain and behavior . Proc Natl Acad Sci USA. 2009; ; 106 : :7203.–7208. 7.
Cimino I, Casoni F, Liu X, et al. Novel role for anti-Mullerian hormone in the regulation of GnRH neuron excitability and hormone secretion . Nat Commun. 2016; ; 7 : :10055.. 8.
Kim T, Do MH, Lawson MA. Translational control of gene expression in the gonadotrope . Mol Cell Endocrinol. 2014; ; 385 : :78.–87. 9.
Counis R, Laverriere JN, Garrel G, et al. Gonadotropin-releasing hormone and the control of gonadotrope function . Reprod Nutr Dev. 2005; ; 45 : :243.–254. 10.
Bernard DJ, Fortin J, Wang Y, Lamba P. Mechanisms of FSH synthesis: what we know, what we don’t, and why you should care . Fertil Steril. 2010; ; 93 : :2465.–2485. 11.
Ojeda SR, Andrews WW, Advis JP, White SS. Recent advances in the endocrinology of puberty . Endocr Rev. 1980; ; 1 : :228.–257. 12.
Garrel G, Racine C, L’Hote D, et al. Anti-Mullerian hormone: a new actor of sexual dimorphism in pituitary gonadotrope activity before puberty . Sci Rep. 2016; ; 6 : :23790.. 13.
Catteau-Jonard S, Dewailly D, Prévot V, et al. L’hormone anti-müllerienne : une hormone ovarienne exerçant une rétroaction hypothalamique ? Med Sci (Paris). 2016; ; 32 : :441.–444. |