| |
| Med Sci (Paris). 32(12): 1053–1056. doi: 10.1051/medsci/20163212003.L’antisynapse : présynapse et garde-fou de l’activation lymphocytaire ? Chloé Guedj,1a1 Nicolas Abraham,1b and Clotilde Randriamampita1c 1Institut Cochin, Inserm U1016, CNRS UMR 8104, Université Paris-Descartes, Sorbonne Paris Cité, 22, rue Méchain, 75014Paris, France MeSH keywords: Animaux, Humains, Activation des lymphocytes, Souris, Terminaisons présynaptiques, Synapses, Lymphocytes T, physiologie, immunologie |
Le lymphocyte T (LT) est un acteur majeur de la réponse immunitaire adaptative. Son activation a lieu au sein des ganglions lorsqu’il reconnaît, à la surface d’une cellule présentatrice d’antigène (CPA) comme une cellule dendritique, l’antigène dont il est spécifique. L’activation des récepteurs à l’antigène (TCR) déclenche alors la relocalisation de nombreux éléments vers la zone de contact établie entre le LT et la CPA, formant ainsi une structure appelée synapse immunologique. Cette plateforme de signalisation est composée de micro-agrégats, ou nanoclusters, organisés autour des TCR et à partir desquels sont déclenchés les signaux d’activation [1] (→).
(→) Voir la Synthèse de J. Bouchet et A. Alcover, m/s n° 6-7, juin-juillet 2014, page 665
On y retrouve de nombreuses protéines telles que les tyrosines kinases Lck (lymphocyte-specific protein tyrosine kinase) et ZAP-70 (70-kDa zeta-associated protein) ou la protéine adaptatrice LAT (linker for activation of T cells). La formation de cette synapse immunologique est généralement perçue comme la première étape de l’activation lymphocytaire. Nos travaux ont cependant mis en évidence que, préalablement à la constitution de cette synapse, une structure transitoire, l’antisynapse, se formait au pôle opposé du contact entre LT et CPA [2, 3]. |
L’antisynapse, un pôle de signalisation actif Par des expériences de vidéo-microscopie et d’immunofluorescence, nous avons montré que tous les éléments classiquement décrits au sein de la synapse s’accumulaient également au niveau de l’antisynapse. C’est le cas par exemple des kinases Lck, ZAP-70, PI3K (phosphoinositide 3-kinase), de l’adaptateur LAT (Figure 1), mais aussi des radeaux lipidiques1, et des phospholipides PIP2 (phosphatidylinositol-4,5-bisphosphate) et PIP3 (phosphatidylinositol-3,4,5-trisphosphate). Plus étonnant, la chaîne zeta du CD3 associé au TCR s’accumule également à ce pôle, mais cela de manière moins fréquente (dans 35 % des conjugués productifs2, au lieu des 70 % environ, pour les autres marqueurs). Ces observations conduisent donc à la conclusion inattendue que les différentes protéines de signalisation peuvent s’organiser en signalosomes indépendamment du CD3. Il faut noter que les tyrosines kinases ZAP-70 et Lck sont fonctionnellement actives à l’antisynapse, comme nous avons pu le montrer avec le biosenseur ROZA (reporter of Zap-70 activity) [2] ou avec des anticorps spécifiques. L’antisynapse constitue donc réellement un pôle de signalisation actif.
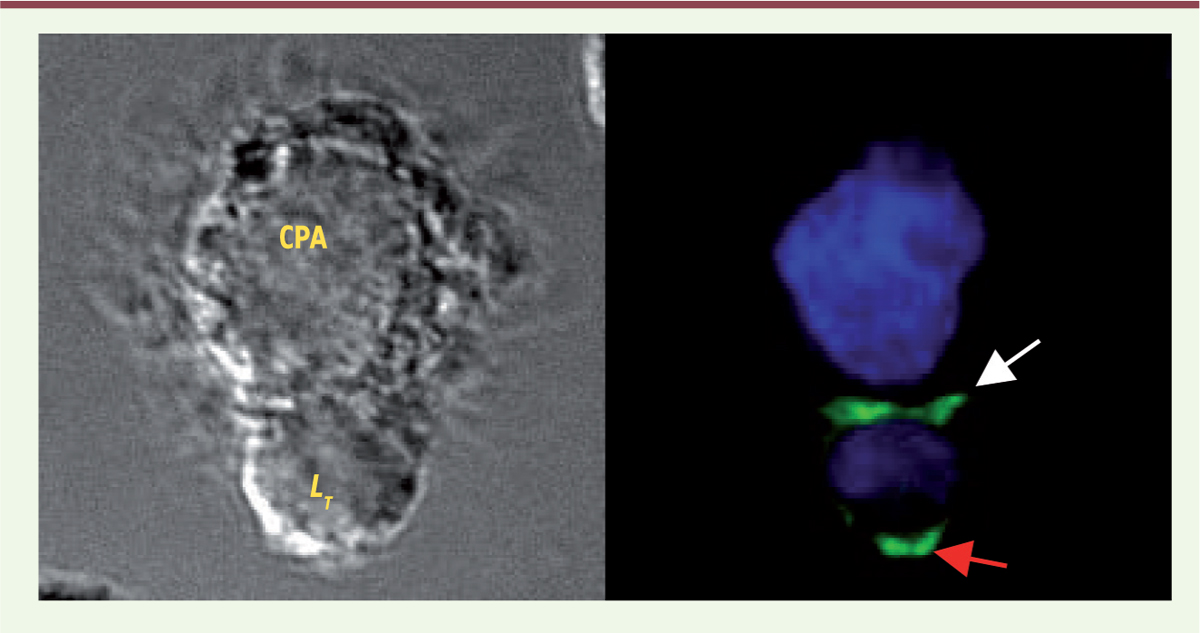
 | Figure 1.
Synapse immunologique et antisynapse. Le contact d’un lymphocyte T (LT) avec une cellule présentatrice d’antigène (CPA) présentant un antigène, induit la relocalisation de la protéine adaptatrice LAT (linker for activation of T-cells ; en vert) au niveau de la zone de contact (synapse immunologique ; flèche blanche) mais également au pôle opposé (antisynapse ; flèche rouge). |
|
L’antisynapse, une structure éphémère qui apparaît avant la synapse La distribution des protéines de Lck ou LAT, couplées à des protéines fluorescentes GFP (green fluorescent protein) afin de les localiser, a pu être suivie par vidéo-microscopie au cours du contact LT-CPA. Nous avons ainsi observé que l’antisynapse se formait très rapidement (environ 30 secondes après le premier contact physique entre une CPA et une cellule T primaire humaine) et, de façon surprenante, dans la plupart des cas, avant même que la synapse ne soit détectable. Toutefois, son existence n’est qu’éphémère : après quelques minutes, l’antisynapse a totalement disparu, ne subsiste que la synapse. Mais que sont devenues les protéines accumulées à l’antisynapse ? Se sont-elles dispersées ou ont-elles migré vers la synapse ? |
L’antisynapse, un réservoir de protéines pour la synapse Pour suivre le destin des protéines composant l’antisynapse, nous avons couplé un marqueur de l’antisynapse (la kinase Lck) à une protéine photo-convertible (Dendra2)3: après photo-conversion par un flash de lumière ultraviolette, ce fluorophore « converti » n’émet plus de fluorescence dans le vert mais dans le rouge. Nous avons photo-converti les protéines accumulées à l’antisynapse et suivi le devenir de ces protéines devenues rouges. Nous avons ainsi montré que les protéines situées initialement à l’antisynapse se retrouvent ensuite au niveau de la synapse. Par quel mécanisme ce transfert a-t-il lieu ? Une étude récente ayant montré que le cytosquelette de microtubules était essentiel pour le transport protéique lors de la formation de la synapse [4], nous avons testé l’importance de ce réseau dans le transfert des composants de l’antisynapse vers la synapse. En inhibant par du nocodazole4 la polymérisation des microtubules, nous avons montré que les protéines photo-converties restaient effectivement bloquées à l’antisynapse et que leur translocation vers la synapse était abolie. Ces résultats suggèrent donc que l’antisynapse pourrait représenter un réservoir de protéines de signalisation prêtes à être recrutées au niveau de la synapse grâce au réseau de microtubules. |
Un signal d’adhésion est suffisant pour la formation de l’antisynapse Quel signal déclenche la formation de l’antisynapse ? L’activation du TCR est-elle nécessaire ? De façon surprenante, il semble que ce ne soit pas le cas. En effet, des cellules déficientes en TCR sont tout autant capables de former des antisynapses que des cellules T présentant ce récepteur. Pour mieux caractériser le signal à l’origine de la formation de cette structure distale, nous avons utilisé des conjugués modèles en remplaçant les CPA par des billes recouvertes de différentes molécules. Des billes recouvertes d’anticorps spécifiques de LFA-1 (lymphocyte function-associated antigen 1) ou d’ICAM-1 (intercellular adhesion molecule) qui ciblent des molécules d’adhésion, ou encore du CMH-I (complexe majeur d’histocompatibilité de classe 1), induisent des antisynapses avec une fréquence similaire à celle induite par des billes recouvertes d’anticorps reconnaissant les protéines CD3/CD28 (des protéines cibles des CPA, les anticorps permettant de mimer les interactions entre des LT et CPA). En fait, le seul contact entre des LT et des billes recouvertes de polylysine suffit à déclencher la formation d’antisynapses ! Quel est donc le signal commun induit par l’adhésion des LT à ces différentes billes qui est capable de déclencher la formation de ces antisynapses ? Une des possibilités serait que ce signal soit en fait mécanique : la contrainte physique exercée sur le LT par la CPA (ou la bille) au niveau de la zone de contact pourrait en effet entraîner des variations locales de tension de la membrane cellulaire, comme c’est le cas pour les neutrophiles [5]. Certains de nos résultats apparaissent cohérents avec cette hypothèse : en induisant un contact avec une surface plane couverte d’anticorps, à la place d’une bille (présentant une surface de contact bien plus faible), et donc en changeant la contrainte mécanique induite par le contact, la fréquence des antisynapses se trouve très fortement réduite. |
Antisynapse et activation lymphocytaire Quel peut être le rôle de cette structure inattendue ? Favorise-t-elle l’activation lymphocytaire ? Il est difficile à l’heure actuelle de répondre à ces questions car nous sommes incapables de bloquer spécifiquement sa formation. Toutefois, en utilisant la réponse calcique comme un témoin de l’activation précoce du lymphocyte, nous avons pu obtenir certains résultats nous permettant de formuler des hypothèses (Figure 2). Tout d’abord, lorsque l’antisynapse est stabilisée dans le temps par l’inhibition des microtubules cellulaires, une réduction de la réponse calcique est observée, en parallèle à la diminution de la fréquence d’apparition des synapses. Ce résultat suggère que le transfert des composants de l’antisynapse vers la synapse serait nécessaire pour obtenir une activation optimale. L’antisynapse pourrait donc être considérée comme une présynapse. Nous avons, d’autre part, pu comparer les réponses calciques induites dans les LT présentant des antisynapses à celles de LT n’en présentant pas. En présence d’antigène, l’amplitude moyenne des réponses calciques observées pour les deux populations de lymphocytes est identique. En revanche, en absence d’antigène, les cellules développant une antisynapse ont une réponse calcique fortement réduite. Dans ces conditions, l’antisynapse pourrait donc avoir un effet de régulation négative sur l’activation, peut-être en séquestrant les acteurs importants, loin de la synapse, évitant ainsi qu’une activation intempestive ait lieu en absence de l’antigène.
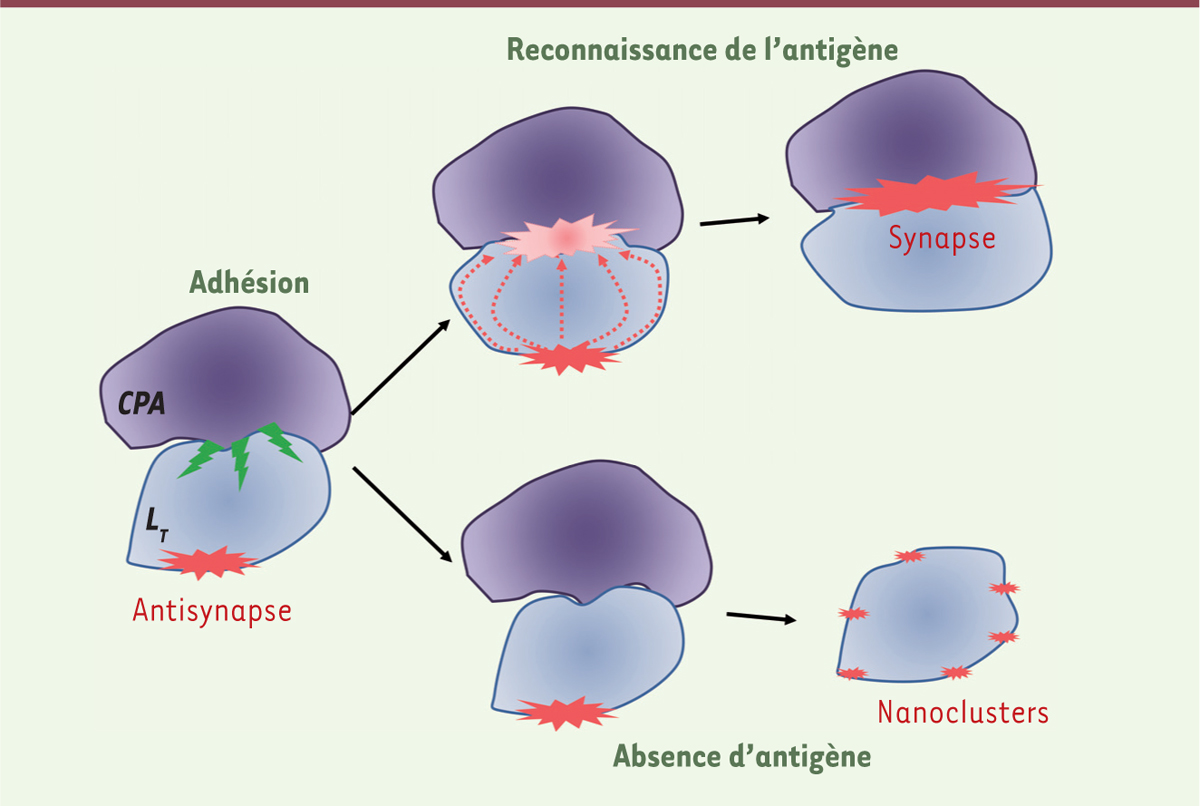
 | Figure 2.
Rôles possibles de l’antisynapse. L’adhérence d’un lymphocyte T (LT) à une cellule présentatrice d’antigène (CPA) induit la formation d’une antisynapse. Les composants de celle-ci sont capables de rejoindre la synapse, ce qui favorise l’activation du LT. En absence d’antigène, l’antisynapse pourrait au contraire séquestrer les molécules de signalisation et empêcher ainsi l’activation incontrôlée du LT. Lors de la dissociation de ce contact non productif, la dispersion de l’antisynapse pourrait conduire à la formation de nanoclusters, favorables à une activation ultérieure. |
On peut enfin imaginer que, dans le cas d’un contact non productif, les agrégats de molécules de signalisation formés au niveau de l’antisynapse ne se défont pas totalement mais restent sous la forme de « nanoclusters », ce qui favoriserait une activation ultérieure en permettant la formation plus rapide des complexes de signalisation lors d’un futur contact. |
Des structures distales (localisées au pôle opposé de la synapse) avaient été préalablement décrites lors d’un contact entre un lymphocyte T et une CPA. C’est notamment le cas du distal pole complex (DPC), structure tardive accumulant des facteurs inhibiteurs de l’activation lymphocytaire [6]. Notre étude a mis en évidence, au niveau de ce même pôle, une structure bien différente : l’antisynapse qui inclut un signalosome activateur, précoce et transitoire. Si son implication précise lors de l’activation lymphocytaire reste incertaine, nos résultats suggèrent qu’elle pourrait tout à la fois jouer un rôle de structure facilitatrice lors d’une réponse immune spécifique de l’antigène en pré-assemblant rapidement le signalosome dès le stade d’adhésion, mais également de garde-fou en attente de la confirmation d’un signal provenant du TCR activé pour former la synapse, ce qui empêcherait des activations intempestives lors des nombreux contacts qu’établissent lymphocytes T et CPA en absence d’antigène. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les auteurs remercient Alain Trautmann pour la relecture de cette nouvelle. Les travaux décrits ici ont été financés par le CNRS, l’Inserm, l’université Paris Descartes, la Fondation ARC pour la recherche sur le cancer et la Ligue contre le cancer.
|
Footnotes |
1.
Bouchet J, Alcover A. La synapse immunologique : une plate-forme de signalisation dynamique pour l’activation des lymphocytes T . Med Sci (Paris). 2014; ; 30 : :665.–670. 2.
Randriamampita C, Mouchacca P, Malissen B, et al. A novel ZAP-70 dependent FRET based biosensor reveals kinase activity at both the immunological synapse and the antisynapse . PLoS One. 2008; ; 3 : :e1521.. 3.
Guedj C, Abraham N, Jullie D, Randriamampita C. T cell adhesion triggers an early signaling pole distal to the immune synapse . J Cell Sci. 2016; ; 129 : :2526.–2537. 4.
Hashimoto-Tane A, Yokosuka T, Sakata-Sogawa K, et al. Dynein-driven transport of T cell receptor microclusters regulates immune synapse formation and T cell activation . Immunity. 2011; ; 34 : :919.–931. 5.
Houk AR, Jilkine A, Mejean CO, et al. Membrane tension maintains cell polarity by confining signals to the leading edge during neutrophil migration . Cell. 2012; ; 148 : :175.–188. 6.
Allenspach EJ, Cullinan P, Tong J, et al. ERM-dependent movement of CD43 defines a novel protein complex distal to the immunological synapse . Immunity. 2001; ; 15 : :739.–750. |