| |
| Med Sci (Paris). 32(11): 1030–1033. doi: 10.1051/medsci/20163211023.L’élimination des cellules sénescentes : vers un avenir meilleur ? Véronique Chauvet,1a Soukie Jouaville,1b Nicolas Garbez,1c and Isabelle Martins2d 1M1 Biologie Santé, Université Paris-Saclay, 91405Orsay, France 2Mort cellulaire et sénescence, Inserm U1030, Institut Gustave Roussy, 114, rue Edouard Vaillant, 94800Villejuif, France MeSH keywords: Animaux, Apoptose, Inhibiteur p16 de kinase cycline-dépendante, Humains, Longévité, Souris, Souris transgéniques, Phagocytose, Tacrolimus, effets des médicaments et substances chimiques, physiologie, génétique, analogues et dérivés, pharmacologie |
La sénescence cellulaire cause un arrêt irréversible de la croissance des cellules induit par un stress, comme le raccourcissement des télomères (sénescence réplicative) ou l’exposition à d’autres signaux de stress physiologiques comme les rayonnements ionisants. Ce stress conduit à l’activation des systèmes de réparation de l’ADN, ou celle de protéines suppresseurs de tumeurs comme p53, p21waf1, p16Ink4a ; il induit également la sécrétion de cytokines pro-inflammatoires, de chimiokines, de métallo-protéases matricielles et de facteurs de croissance, formant ce que l’on appelle un phénotype sécrétoire associé à la sénescence (SASP) [1]. Outre son rôle de défense contre le développement de tumeurs, la sénescence cellulaire intervient aussi de façon essentielle dans le développement embryonnaire, la réparation tissulaire et la prévention de la prolifération des cellules prénéoplasiques. Les mécanismes de la sénescence interviendraient également dans l’apparition des troubles métaboliques liés au vieillissement, car une élimination de cellules sénescentes chez des souris souffrant du syndrome progéroïde1 retarde l’apparition des désordres liés à l’âge [2]. Ces résultats apportaient la démonstration que les cellules sénescentes exprimant p16Ink4a participaient au vieillissement in vivo. Cependant, une augmentation des cassures chromosomiques a été observée dans ce modèle, vraisemblablement due à un dysfonctionnement du système de réparation de l’ADN. Ce modèle ne reflète donc pas le vieillissement physiologique. Une étude publiée dans la revue Nature [3] propose un nouveau modèle murin d’étude du rôle de la sénescence dans divers processus physiologiques. Dans ce modèle, l’élimination des cellules sénescentes peut être déclenchée à façon. |
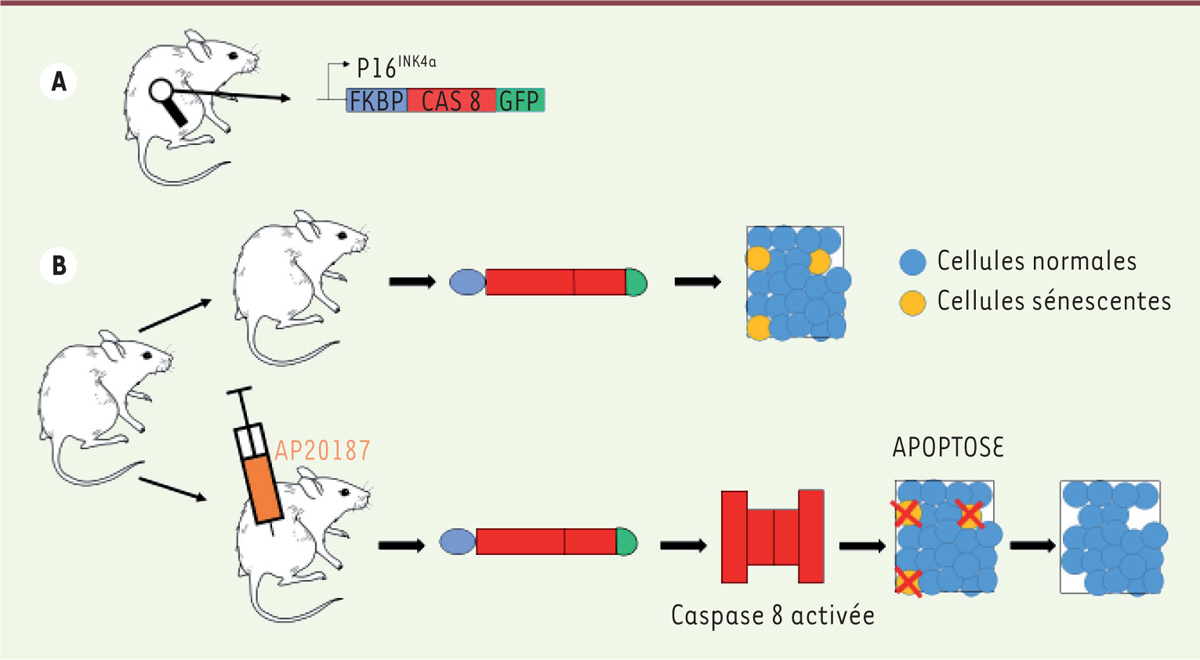
Un modèle murin transgénique d’élimination des cellules sénescentes Afin de supprimer les cellules sénescentes, des souris non progéroïdes dites INK-ATTAC (INK-linked apoptosis through targeted activation of caspase) ont été créées. La protéine de fusion FKBP-cas 8 (FK506-binding protein-caspase 8) – associant une forme activée de la caspase 8 et un fragment de la protéine liant la FK506 - est exprimée sous le contrôle du promoteur minimal Ink4a (également nommé Cdkn2a ou Ink4a/Arf), ce qui restreint l’expression du transgène aux cellules exprimant INK4a, dont les cellules sénescentes. FKBP-cas 8 est dimérisée par l’ajout d’un composé synthétique, l’AP20187 (AP), ce qui cause l’activation de la caspase 8, déclenche l’apoptose et permet l’élimination des cellules sénescentes. Le transgène contient également un gène rapporteur codant la GFP (green fluorescent protein), dont l’expression permet de repérer les cellules fluorescentes dans lesquelles le promoteur p16Ink4a
est actif (Figure 1).
 | Figure 1.
Stratégie d’élimination des cellules sénescentes chez les souris INK-ATTAC. A. Expression de la protéine de fusion FKBP-Cas 8 (FK506-binding protein-caspase 8) marquée par un rapporteur GFP (green fluorescent protein) et sous contrôle du promoteur p16ink4a
chez les souris INK-ATTAC (INK-linked apoptosis through targeted activation of caspase). B. Les souris transgéniques non traitées expriment le transgène dans les cellules exprimant p16 (sénescentes), mais il n’y a pas d’effet physiologique. L’injection d’AP20187 dans les cellules exprimant p16 et en sénescence induit la dimérisation, l’activation de la caspase 8 et l’apoptose de ces cellules. |
|
La destruction des cellules sénescentes redonne une seconde jeunesse aux organes et améliore l’espérance de vie Grâce à ce modèle INK-ATTAC, les auteurs ont analysé les conséquences d’une élimination des cellules sénescentes dans un large panel de tissus, chez des souris âgées (12 à 18 mois, à un moment où les cellules p16ink4a s’accumulent). Le vieillissement induit de nombreuses modifications métaboliques. Au niveau du tissu adipeux par exemple, on observe une atrophie des adipocytes ou une diminution de l’adipogenèse [4]. Ces altérations sont évaluées par le suivi de l’expression des facteurs de transcription PPARγ (peroxisome proliferator-activated receptor ϒ) et CEBPα (CCAAT/enhancer-binding protein α) – ce dernier jouant un rôle dans l’adipogenèse - et par la mesure du diamètre des adipocytes, et disparaissent avec l’élimination des cellules sénescentes. Dans le cœur, la sénescence mène à la perte de cellules ventriculaires cardiaques (cardiomyocytes) et induit une hypertrophie des cellules restantes [5]. Toutefois, chez les souris INK-ATTAC traitées par l’AP20187 (dimérisant FKBP-cas8), les cardiomyocytes sont plus petits et plus nombreux. La tolérance au stress, évaluée à court et à long terme par l’injection d’isoprotérénol2, suggère que la suppression des cellules sénescentes stoppe la diminution d’expression d’une sous-unité clé d’un canal potassique : le récepteur Sur2a (sulfonylurea receptor, également connu sous le nom d’Abcc9 [ATP binding cassette subfamily C member 9]), récepteur qui participe normalement à la régulation de l’activité de ces canaux potassiques. Ainsi, une élimination de ces cellules sénescentes dans le cœur permet de préserver la tolérance au stress. Avec l’âge, le développement d’une glomérulosclérose rénale conduit à une augmentation du taux d’urée dans le sang [6]. Ce dysfonctionnement affecte la filtration glomérulaire et donc les fonctions rénales. La suractivation du système rénine-angiotensine-aldostérone (RAAS) serait à l’origine de la formation de glomérulosclérose3. Ainsi, des inhibiteurs du récepteur de l’angiotensine Agtr-1a, dont la surexpression des transcrits a été détectée par RT-qPCR en cas de glomérulosclérose chez les souris âgées, permettent de diminuer ces lésions en conditions normotensives [7]. Le mécanisme de cette suractivation impliquerait la production, par les cellules épithéliales rénales en sénescence, de composés qui activeraient de façon excessive le système rénine-angiotensine-aldostérone local du rein ; l’élimination de ces cellules conduit à l’abolition de la maladie. Par contraste, l’expression d’Agtr-1a n’est pas augmentée chez les souris INK-ATTAC traitées par l’AP20187, et la glomérulosclérose y est beaucoup moins prononcée, confirmant l’implication des cellules sénescentes dans cette pathologie. Le vieillissement s’accompagne également de pathologies oculaires telles que la cataracte, qui entraînent une baisse de l’acuité visuelle. L’induction de la mort cellulaire des cellules sénescentes retarde l’apparition de cette pathologie. De plus, l’élimination des cellules sénescentes chez les souris âgées de 12 mois permet d’augmenter de façon significative la durée de vie moyenne des souris, mais on note des variations selon le sexe et le fond génétique des animaux. Le délai de développement de tumeurs est accru, même si l’incidence et le type de tumeurs observés à l’autopsie ne sont pas modifiés chez les souris traitées par l’AP20187 par comparaison avec les souris non traitées. Ainsi, les cellules sénescentes favoriseraient la création d’un microenvironnement tumoral qui promeut la progression des tumeurs. La suppression des cellules en sénescence permet aussi d’augmenter l’espérance de vie moyenne, qui a été mesurée en suivant les recommandations d’une étude préalable sur l’étude des espérances de vie maximum [8]. De plus, l’élimination des cellules sénescentes n’aurait pas d’effet sur la coordination motrice, la mémoire, la force musculaire, les troubles métaboliques (absorption du glucose), et les paramètres hématologiques, cibles habituelles du vieillissement. |
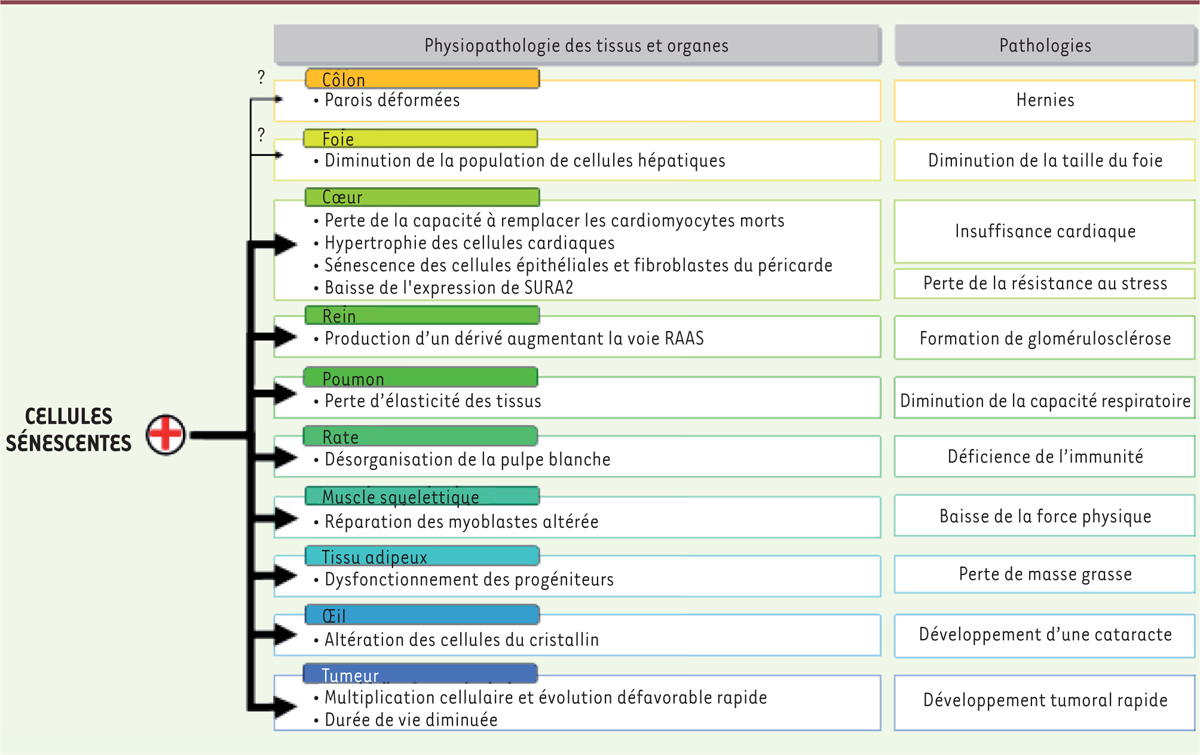
Faudrait-il donc supprimer les cellules sénescentes ? L’accumulation de cellules sénescentes est à l’origine de nombreuses maladies liées à l’âge (Figure 2) ainsi que de la diminution de l’espérance de vie moyenne. Chez les souris non progéroïdes exprimant le transgène INK-ATTAC, l’élimination (via l’administration d’AP20187) des cellules exprimant des marqueurs de sénescence, ici p16ink4, permet de retarder la progression de maladies liées à l’âge et de préserver les fonctions des organes. Mais, le revers de la médaille est que cela induit également un retard dans le phénomène de cicatrisation qui survient cependant normalement si le traitement par l’AP20187 est interrompu.
 | Figure 2.
Conséquences physiopathologiques de la sénescence au niveau des tissus/organes et pathologies associées au vieillissement. Le + indique une stimulation des effets physiologiques observés lors du vieillissement. L’épaisseur des flèches traduit la démonstration établie (épaisse) ou encore supposée (fine avec un point d’interrogation) des liens. |
Malgré tout, le choix de p16Ink4a en tant que marqueur de sénescence reste discutable car toutes les cellules exprimant p16Ink4a ne sont pas forcément en sénescence. D’autre part, certains tissus - foie et côlon - ne sont pas affectés dans ce modèle, et l’induction de la sénescence n’est que partielle. Les auteurs évoquent pour expliquer ces observations une limitation de la biodisponibilité, un seuil transcriptionnel ou un effet dose. En dépit de ces limitations, cette approche peut se révéler utile pour étudier les dysfonctionnements et les maladies liées à l’âge, et évaluer l’intérêt de thérapies ciblant la sénescence cellulaire. De plus, il serait intéressant de savoir si les effets physiologiques et/ou pathologiques de la présence de cellules sénescentes sont directs ou indirects, et favorisés notamment par les SASP. Dans ce cas, peut-être la seule modification de ce phénotype sécrétoire suffirait-elle à réduire les effets négatifs constatés ? À ce jour, le rôle des SASP sur les fonctions physiologiques de l’organisme et sur l’espérance de vie reste mal connu. L’évaluation est compliquée par les différences importantes qui existent entre un contexte physiologique et un contexte pathologique, notamment via la modification des différentes voies de signalisation. À l’heure actuelle, il reste encore de nombreux points à éclaircir ; citons-en deux particulièrement importants en termes d’applications médicales : identifier de manière spécifique une cellule sénescente par un marqueur unique, et identifier des molécules pouvant cibler spécifiquement les cellules sénescentes. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Van Deursen JM The role of senescent cells in ageing . Nature. 2014; ; 509 : :439.–446. 2.
Baker DJl, Wijshake T, Tchkonia T, et al. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders . Nature. 2011;; 479 : :232.–6. 3.
Baker DJ, Childs BG, Durik M, et al. Naturally occurring p16(Ink4a)-positive cells shorten healthy lifespan . Nature. 2016; ; 530 : :184.–189. 4.
Tchkonia T, Morbeck DE, Von Zglinicki T, et al. Fat tissue, aging, and cellular senescence . Aging Cell. 2010; ; 9 : :667.–684. 5.
Bernhard D, Laufer G The aging cardiomyocyte: a mini-review . Gerontology. 2008; ; 54 : :24.–31. 6.
Razzaque MS Does renal ageing affect survival? . Ageing Res Rev. 2007; ; 6 : :211.–222. 7.
Ferder LF, Inserra F, Basso N Effects of renin-angiotensin system blockade in the aging kidney . Exp Gerontol. 2003; ; 38 : :237.–244. 8.
Wang C, Li Q, Redden DT, Weindruch R, Allison DB Statistical methods for testing effects on maximum lifespan . Mech Ageing Dev. 2004; ; 125 : :629.–632. |