| |
| Med Sci (Paris). 32(11): 1019–1022. doi: 10.1051/medsci/20163211020.L’asporine : une nouvelle défense naturelle contre le cancer du sein Arnaud Blomme,1 Pino Cusumano,1,2 Olivier Peulen,1 Akeila Bellahcène,1 Vincent Castronovo,1 and Andrei Turtoi1,3* 1Metastasis Research Laboratory, GIGA-Cancer, University of Liege, avenue de l’Hôpital 3, 4000Liege, Belgique 2Department of senology, university hospital (CHU), University of Liège, Liège, Belgique 3Institut de Recherche en Cancérologie de Montpellier ; Inserm U1194, MontpellierF-34298, France MeSH keywords: Transformation cellulaire néoplasique, Protéines de la matrice extracellulaire, Femelle, Régulation de l'expression des gènes tumoraux, Humains, Interleukine-1 bêta, Tumeurs du sein triple-négatives, effets des médicaments et substances chimiques, génétique, physiologie, pharmacologie, sécrétion, prévention et contrôle |
À l’heure actuelle, le cancer du sein est, avec plus d’1,5 millions de nouveaux cas par an au niveau mondial, le cancer le plus fréquemment diagnostiqué chez la femme. Le cancer du sein peut être subdivisé en 4 grandes catégories basées sur la présence ou non de récepteurs spécifiques : récepteur des œstrogènes (ER), récepteur de la progestérone (PR), récepteur du facteur de croissance épidermique 2 (HER2). Le cancer du sein triple négatif (TNBC) correspond à la classe de cancers du sein dépourvus de récepteurs hormonaux (ER-/PR-) et du récepteur HER2 (HER2-). À l’inverse des autres sous-types de cancers du sein (ER/PR et HER2 positifs), le TNBC ne peut donc pas être traité par l’utilisation d’antagonistes de ces hormones ou d’anticorps spécifiques du récepteur HER2. De ce fait, le TNBC est, lorsqu’il récidive, particulièrement létal et de très mauvais pronostic, aussi bien en termes de survie globale du patient que de durée de rémission. Comme pour la plupart des cancers, l’étape critique dans la progression du TNBC est la formation de métastases. Une meilleure compréhension du phénomène de dissémination métastatique et la découverte de nouveaux mécanismes régulant ce processus constituent donc les priorités de la recherche en cancérologie d’aujourd’hui [1]. Outre les cellules cancéreuses, le microenvironnement tumoral (ou stroma, comprenant notamment des fibroblastes, des cellules endothéliales ou encore des cellules immunitaires) est désormais reconnu comme un élément clé jouant un rôle majeur dans la progression tumorale (→).
(→) Voir le numéro thématique Microenvironnements tumoraux, m/s n° 4, vol. 30, avril 2014
Dès lors, il représente une cible de choix pour le développement de nouvelles thérapies anticancéreuses [2]. |
Les protéoglycanes à courts motifs riches en leucine (SLRP, small leucine rich proteoglycans) et le cancer Depuis plusieurs années, notre laboratoire étudie l’importance du rôle du stroma au cours du développement tumoral et métastatique. Nous avons développé une méthode permettant d’analyser les protéines tumorales accessibles spécifiquement surexprimées au niveau de lésions cancéreuses humaines [3]. Nous avons appliqué cette méthode à divers types de cancers dont le cancer du sein [4, 5], ce qui a conduit à la sélection de protéines systématiquement détectées et donc caractéristiques du tissu tumoral. Parmi ces protéines, on dénombre plusieurs membres de la famille des small leucine rich proteoglycans (SLRP), famille de protéines assez méconnue à ce jour. De manière intéressante, ces nouveaux marqueurs ont été validés histologiquement comme faisant partie intégrante du stroma tumoral. La famille de protéines SLRP compte à l’heure actuelle 18 membres répartis en 5 classes. Le point commun entre ces différentes protéines réside dans leur capacité à se lier à la matrice extracellulaire et à interagir avec d’autres facteurs tumoraux tels que BMP4 (bone morphogenetic protein 4), PDGF (platelet-derived growth factor), TNFα (tumor necrosis factor alpha), TGF-β1 (transforming growth factor beta 1), IGFR (insulin-like growth factor receptor), EGFR (epidermal growth factor receptor), TLR (toll-like receptor), ITGα2β1 (integrin alpha-2 beta-1) et c-MET (ou HGFR, hepatocyte growth factor receptor) [6]. De toutes les SLRP, seule la décorine, le lumicane et le biglycane ont, à ce jour, été associés au développement tumoral. Ils sont notamment impliqués dans divers processus biologiques comme l’inflammation, la survie, la prolifération, la migration et l’invasion cellulaire. Hormis ces trois représentants, la majorité des SLRP restantes, bien que fortement surexprimées dans le cancer, n’ont été que très peu étudiées, leur(s) fonction(s) restant généralement peu connue(s). Parmi ces protéines négligées figure l’asporine, dont la surexpression a été confirmée dans les cancers du pancréas, du sein, de la prostate et plus récemment dans le cancer gastrique. L’asporine a initialement été découverte dans le cartilage articulaire où elle régule la formation de cartilage en modulant la voie de signalisation du TGF-β1 [7]. Intrigués par sa localisation particulière, dans le stroma tumoral, nous avons décidé d’étudier plus en détails le rôle de cette protéine dans le contexte du cancer du sein [8]. (Figure 1)
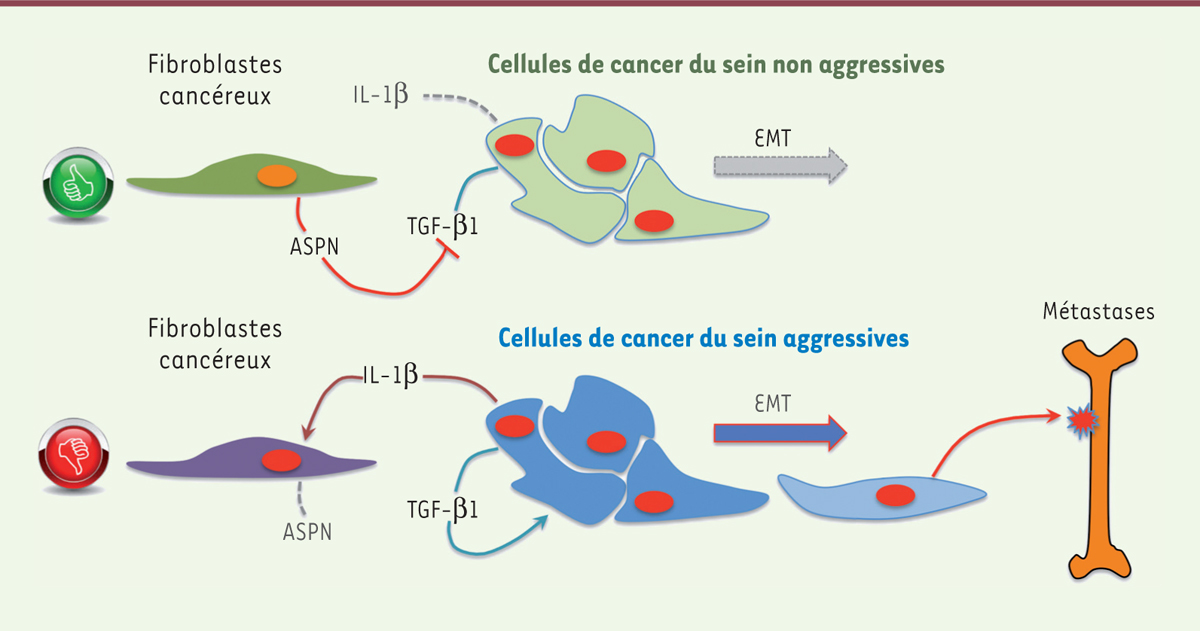
 | Figure 1.
L’asporine détermine la réponse du microenvironnement tumoral dans le cancer du sein. A. En réponse au développement d’un cancer du sein peu agressif (généralement hormono-dépendant), les fibroblastes cancéreux secrètent de l’asporine (ASPN) dans la matrice extracellulaire. Cette dernière inhibe la production de TGF-β1 (transforming growth factor beta 1) par les cellules cancéreuses, ce qui les empêche d’effectuer correctement la transition épithélio-mésenchymateuse (EMT), diminue leur potentiel d’invasion et, in fine, bloque la formation de métastases. B. Dans le cas des cancers du sein plus agressifs (triple négatifs - TNBC), les cellules cancéreuses secrètent de l’interleukine(IL)-1β qui inhibe la production d’asporine par les fibroblastes. Les cellules cancéreuses peuvent alors sécréter et utiliser le TGF-β1, leur permettant ainsi d’effectuer la transition épithélio-mésenchymateuse, de se disséminer à travers la circulation sanguine, et augmentant leur capacité à former des métastases. |
|
Rôle de l’asporine dans le cancer du sein Pour déterminer la fonction de l’asporine dans un contexte tumoral, nous avons commencé par évaluer son niveau d’expression (et sa localisation) au niveau de tissus humains de cancers du sein répartis selon les différents sous-types (ER/PR/HER2). Nous avons ainsi observé que l’expression d’asporine était détectable spécifiquement dans le stroma des tumeurs de sein de type luminal (exprimant les récepteurs des œstrogènes) mais absente des tumeurs de type TNBC. In vitro, nous avons démontré que la simple addition de milieu conditionné provenant de cellules cancéreuses de type luminal permettait d’induire sa surexpression aussi bien dans des fibroblastes obtenus à partir d’individus sains (NBF, normal breast fibroblast) que dans des fibroblastes associés au cancer (CAF, cancer associated fibroblast). Au contraire, les cellules cancéreuses de type TNBC sont capables de supprimer l’expression d’asporine dans ces différents types de fibroblastes. Sur la base du rôle joué par l’asporine dans les chondrocytes1,, nous avons ensuite tenté de découvrir si cette protéine était également capable de bloquer la voie de signalisation du TGF-β1 dans un contexte tumoral. En effet, nos résultats ont démontré que la présence d’asporine empêchait la phosphorylation de la protéine SMAD2 (mothers against decapentaplegic homolog 2) induite par le TGF-β1. La présence d’asporine empêchait également les cellules d’effectuer la transition épithélio-mésenchymateuse2 (TEM) [9] (→) et diminuait la proportion de cellules souches dans différentes lignées de cancer du sein. De plus, nous avons mis en évidence que, mécanistiquement, cet effet inhibiteur de l’asporine dépendait d’un fragment peptidique correspondant aux acides aminés 159 à 205 [8].
(→) Voir la Synthèse de C. Moyret-Lalle et al., m/s n° 8-9, août-septembre 2016, page 725
En utilisant deux modèles in vivo, nous avons également prouvé que la surexpression d’asporine dans des cellules cancéreuses de type TNBC était capable de ralentir la croissance tumorale, de réduire fortement l’invasion des cellules cancéreuses et d’empêcher la formation de métastases. Enfin, d’un point de vue clinique, nos résultats démontrent que l’expression d’asporine dans les tumeurs de sein est significativement corrélée au pronostic des patientes (n = 60, 10 ans de suivi clinique). Les patientes dont les tumeurs exprimaient un faible niveau d’asporine étaient en effet associées à un mauvais pronostic vital (et un développement accru de métastases), indépendamment du sous-type de cancer du sein diagnostiqué (aire sous la courbe [AUC]3, = 0,87 ; intervalle de confiance [CI] (95 %) : 0,78-0,96 ; p = 0,0001). Enfin, l’analyse rétrospective in silico de l’expression du gène de l’asporine dans un grand nombre de tumeurs de sein (n = 375, 25 ans de suivi clinique) a confirmé qu’une faible expression de la protéine était associée à une réduction du temps de survie des patientes (hazard ratio HR4, = 0,58 ; CI (95 %) : 0,37-0,91 ; p = 0,017) [8]. |
Les cellules cancéreuses secrètent de l’interleukine (IL)-1β pour supprimer l’expression de l’asporine par les fibroblastes tumoraux Parmi les différentes observations réalisées au cours de notre étude, le fait que les cellules cancéreuses de type TNBC soient capables de supprimer l’expression de l’asporine dans les fibroblastes nous semblait particulièrement intéressant. Cette observation était d’autant plus intrigante que nous avions préalablement démontré la capacité de l’asporine à se lier au TGF-β1, mais aussi celle du TGF-β1 à induire l’expression d’asporine dans les fibroblastes CAF. Dès lors, il nous a semblé logique de considérer l’asporine et le TGF-β1 comme des acteurs importants d’une boucle autorégulatrice, potentiellement conservée dans le développement des tissus sains. Pour cette raison, le fait que les cellules TNBC, qui elles-mêmes produisent de grandes quantités de TGF-β1, soient capables d’inhiber l’expression d’asporine demeurait mystérieux. À l’aide d’une approche globale, comparant des cellules cancéreuses de type luminal et de type TNBC, nous avons constaté qu’un grand nombre d’interleukines étaient différentiellement sécrétées par les 2 types cellulaires [8]. Après une série d’expériences visant à exclure certaines de ces cytokines, nous sommes parvenus à identifier l’IL-1β, sécrétée par les cellules TNBC, comme l’un des facteurs responsables de l’inhibition de l’asporine dans les fibroblastes. D’un point de vue clinique, cette découverte revêt un intérêt tout particulier car elle permet d’envisager le développement d’une nouvelle voie thérapeutique intéressante pour le traitement des cancers TNBC, basée sur l’inhibition sélective d’IL-1β et la réactivation indirecte de l’asporine aux propriétés anti-tumorales. Des études préliminaires suggèrent en effet que l’administration d’une dose unique d’IL-1β suffit à augmenter significativement la formation de métastases pulmonaires dans un modèle murin de mélanome [10]. De plus, l’expression d’IL-1β est généralement élevée dans différents types de tumeurs (y compris les tumeurs de sein), et un taux anormalement élevé d’IL-1β chez les patients cancéreux est associé avec un mauvais pronostic de survie [11]. Le ciblage de l’IL-1β dans le contexte tumoral pourrait être rapidement testé, notamment via l’utilisation d’un anticorps anti-IL-1β (Canakinumab/Ilaris®), qui est actuellement approuvé pour le traitement de l’arthrite rhumatoïde. Récemment, un essai clinique de phase 1 utilisant un second anticorps spécifique de l’IL-1β (MABp1), chez des patients atteints de cancers avancés, a d’ailleurs dévoilé des résultats encourageants, aussi bien en termes de contrôle de la maladie, de tolérance au traitement que de risque d’effets secondaires [12]. En plus de l’utilisation d’inhibiteurs d’IL-1β, un autre axe de traitement pourrait inclure l’administration du peptide actif de l’asporine (acides aminés 159-205), responsable de la liaison au TGF-β1. Cette dernière approche pourrait même se révéler plus efficace que l’inhibition d’IL-1β, en raison du caractère immunosuppressif et donc potentiellement pro-tumoral de la suppression systémique de cette cytokine. À l’heure actuelle, des études complémentaires sont en cours dans notre laboratoire afin d’explorer ces nouvelles options de traitement du TNBC. |
Dans une tumeur, les composants du stroma sont reconnus comme des éléments importants du développement tumoral, fournissant à la tumeur divers facteurs de croissance, des protéines aidant à l’agencement de la matrice extracellulaire, d’autres permettant de supprimer la réponse immunitaire, et, enfin, une variété de substrats énergétiques. En particulier, le caractère oncogénique des fibroblastes du stroma semble être acquis au cours du développement tumoral, comme le suggèrent certaines études démontrant le potentiel anti-tumoral initial des fibroblastes dans le cancer du pancréas [13]. Notre étude soutient cette hypothèse et propose qu’une situation similaire advient dans le cancer du sein, où la production d’asporine par les fibroblastes agit comme une barrière naturelle contre la dissémination métastatique. Néanmoins, les cellules de cancers TNBC ont trouvé le moyen d’outrepasser cette barrière : en produisant de l’IL-1β, elles sont capables d’inhiber la production d’asporine par les fibroblastes, et donc de réduire la concentration de cet inhibiteur naturel du TGF-β1 au niveau de la tumeur. La découverte de ce mécanisme permet de proposer de nouvelles thérapies visant à restaurer l’expression d’asporine dans les fibroblastes et décupler ainsi leurs propriétés anti-tumorales. Enfin, il est important de rappeler que cette voie de signalisation complexe, impliquant l’IL-1β, l’asporine et le TGF-β1, n’est probablement pas unique, et que notre étude est loin d’être exhaustive. Dans le futur, la découverte des molécules responsables des interactions entre cellules cancéreuses et cellules stromales, ainsi que leur caractérisation, se révéleront primordiales et ouvriront la porte à une nouvelle génération de composés permettant la mise au point de thérapies anti-cancéreuses ciblées de plus en plus efficaces. |
Les auteurs déclarent n’avoir aucun conflit d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Weigelt B, Peterse JL, van’t Veer LJ. Breast cancer metastasis: markers and models . Nat Rev Cancer. 2005; ; 5 : :591.–602. 2.
Junttila MR, de Sauvage FJ. Influence of tumour micro-environment heterogeneity on therapeutic response . Nature. 2013; ; 501 : :346.–354. 3.
Turtoi A, De Pauw E, Castronovo V. Innovative proteomics for the discovery of systemically accessible cancer biomarkers suitable for imaging and targeted therapies . Am J Pathol. 2011; ; 178 : :12.–18. 4.
Turtoi A, Dumont B, Greffe Y, et al. Novel comprehensive approach for accessible biomarker identification and absolute quantification from precious human tissues . J Proteome Res. 2011; ; 10 : :3160.–3182. 5.
Dumont B, Castronovo V, Peulen O, et al. Differential proteomic analysis of a human breast tumor and its matched bone metastasis identifies cell membrane and extracellular proteins associated with bone metastasis . J Proteome Res. 2012; ; 11 : :2247.–2260. 6.
Merline R, Schaefer RM, Schaefer L. The matricellular functions of small leucine-rich proteoglycans (SLRPs) . J Cell Commun Signal. 2009; ; 3 : :323.–335. 7.
Kou I, Nakajima M, Ikegawa S. Expression and regulation of the osteoarthritis-associated protein asporin . J Biol Chem. 2007; ; 282 : :32193.–32199. 8.
Maris P, Blomme A, Palacios AP, et al. Asporin is a fibroblast-derived TGF-β1 inhibitor and a tumor suppressor associated with good prognosis in breast cancer . PLoS Med. 2015; ; 12 : :e1001871.. 9.
Moyret-Lalle C, Pommier R, Bouard C, et al. Plasticité des cellules cancéreuses et dissémination métastatique . Med Sci (Paris). 2016; ; 32 : :725.–731. 10.
Giavazzi R, Garofalo A, Bani MR, et al. Interleukin 1-induced augmentation of experimental metastases from a human melanoma in nude mice . Cancer Res. 1990; ; 50 : :4771.–4775. 11.
Reed JR, Leon RP, Hall MK, Schwertfeger KL. Interleukin-1beta and fibroblast growth factor receptor 1 cooperate to induce cyclooxygenase-2 during early mammary tumourigenesis . Breast Cancer Res. 2009; ; 11 : :R21.. 12.
Hong DS, Hui D, Bruera E, et al. MABp1, a first-in-class true human antibody targeting interleukin-1α in refractory cancers: an open-label, phase 1 dose-escalation and expansion study . Lancet Oncol. 2014; ; 15 : :656.–666. 13.
Özdemir BC, Pentcheva-Hoang T, Carstens JL, et al. Depletion of carcinoma-associated fibroblasts and fibrosis induces immunosuppression and accelerates pancreas cancer with reduced survival . Cancer Cell. 2014; ; 25 : :719.–734. |