| |
| Med Sci (Paris). 32(10): 833–835. doi: 10.1051/medsci/20163210014.Agent double dans l’inflammation ? Magali Dupont,1a Alice Ouachée,1b Juliette Royer,1c and Corinne Dupuy2d 1M1 Biologie Santé, Université Paris-Saclay, 91405Orsay, France 2UMR8200 CNRS, pavillon de recherche 2, Institut Gustave Roussy, 114, rue Édouard Vaillant, 94805Villejuif, France MeSH keywords: Animaux, Cytokines, Facteur de stimulation des colonies de granulocytes, Granulomatose septique chronique, Humains, Immunité, Inflammation, Interleukine-1 alpha, Macrophages, Mutation, Granulocytes neutrophiles, Phagocytes, Espèces réactives de l'oxygène, métabolisme, génétique, immunologie, physiologie, enzymologie |
NADPH oxydase et immunité innée La NADPH oxydase des cellules phagocytaires est une oxydoréductase dont l’unique fonction est de catalyser la production de ROS (reactive oxygen species) via l’oxydation du NADPH selon la réaction suivante : NADPH + 2O2 → NADP+ + H+ + 2O2∙ (pour une revue sur les NADPH oxydases, voir [1]) (→).
(→) Voir la Synthèse de M.V. Chuong Nguyen et al., m/s n° 1, janvier 2015, page 43
Cette NADPH oxydase possède deux sous-unités membranaires qui assurent le transfert des électrons du NADPH à l’oxygène, la gp91phox, appelée dorénavant Nox2, et la p22phox, ainsi que des composants cytosoliques : la p40phox, la p67phox, la p47phox, et la petite protéine G Rac1 (ou Rac2). À l’état de repos, les sous-unités membranaires et cytosoliques sont séparées, rendant impossible l’oxydation du NADPH. L’activation de certaines voies de signalisation permet la translocation des sous-unités cytosoliques à la membrane et l’activation du complexe [2, 3]. La NADPH oxydase est nécessaire à l’immunité innée dans la lutte contre les agents infectieux, car, via la production des ROS qu’elle catalyse dans les phagolysosomes des cellules, elle contribue à la destruction des pathogènes en oxydant leurs composants structuraux. Mais les ROS produites par la NADPH oxydase sont aussi impliquées dans des voies de signalisation. En effet, elles activent l’inflammasome NLRP3 (NACHT, LRR and PYD domains-containing protein 3), qui induit le clivage de la pro-IL-1β (interleukine-1β) en IL-1β et sa sécrétion [4, 5], et confère ainsi un rôle pro-inflammatoire à cette enzyme. |
Granulomatose septique chronique ( chronic granulomatous disease - CGD) La granulomatose septique chronique est une maladie héréditaire rare ; dans les deux-tiers des cas, une mutation est présente dans le gène CYBB codant gp91phox, localisé sur le chromosome X, ce qui explique que l’on parle de patients X-CGD [6] (→).
(→) Voir la Synthèse de Marie-José Stasia, m/s n° 5, mai 2007, page 526
Pour le tiers restant, les mutations sont autosomiques et touchent les gènes qui codent les autres sous-unités du complexe. La maladie se caractérise ainsi par une perte de l’activité génératrice de ROS dans les cellules phagocytaires comme les neutrophiles et les macrophages. La destruction des pathogènes phagocytés et la signalisation pro-inflammatoire induite par les ROS sont alors altérées, ce qui conduit à des infections récurrentes et une accumulation excessive de cellules immunitaires agrégées (granulomes) chez les patients. On constate chez ces patients un état inflammatoire intense et prolongé [7], qu’il soit ou non dû à une infection. Lorsque l’inflammation n’a pas pour origine une infection, elle est qualifiée d’inflammation stérile : elle est induite par des signaux de danger (danger associated molecular pattern ou DAMP) provenant du soi. À l’heure actuelle, le lien entre la voie NADPH oxydase et cette inflammation stérile prolongée n’est pas clairement compris ; son étude permettrait le développement de thérapies ciblées plus efficaces pour les patients souffrant de désordres inflammatoires sans infection (dans le cadre de la CGD, mais aussi de lupus érythémateux disséminé, ou de maladies inflammatoires chroniques de l’intestin [MICI]), ainsi qu’une meilleure compréhension du rôle de la NADPH oxydase dans ces processus inflammatoires. |
La NADPH oxydase : un rôle régulateur dans l’inflammation ? Dans un article publié récemment dans Blood [8], Bagaitkar et al. identifient les événements et les acteurs moléculaires qui relient, dans le modèle des souris X-CG, la perte de Nox2 à l’inflammation stérile, excessive et prolongée observée dans cette maladie. Pour créer un modèle expérimental d’inflammation stérile, les chercheurs induisent une péritonite (inflammation du péritoine, tissu mince qui tapisse la paroi interne de l’abdomen) chez des souris, sauvages ou X-CGD, et axéniques, c’est-à-dire dépourvues de tout germe (y compris du microbiote), par injection intrapéritonéale, soit de periodate de sodium, soit de lysats de lymphocytes nécrotiques ou de cristaux d’urate de sodium (MSU). À la suite de la lésion, ils observent, chez les souris X-CGD comparées aux souris sauvages, une augmentation du recrutement des neutrophiles accompagnée d’une augmentation du taux de certaines cytokines dans le péritoine (IL-1, IL-6, G-CSF [granulocyte colony-stimulating factor]). Cette accumulation de neutrophiles ne résulte pas pour autant de la déficience en NADPH oxydase. En effet, chez les souris femelles X-CGD hétérozygotes, où seule la moitié des cellules expriment une Nox2 fonctionnelle en raison de l’inactivation aléatoire d’un des chromosomes X, le nombre de neutrophiles recrutés au site inflammatoire est équivalent, qu’ils expriment ou non une NADPH oxydase fonctionnelle. En revanche, l’expression de la lysophosphatidylsérine, qui, normalement, favorise l’efférocytose1 [9] est ici réduite, mais uniquement dans les neutrophiles X-CGD, altérant l’efficacité de la phagocytose des neutrophiles apoptotiques ou nécrotiques par les macrophages, ce qui participe de façon limitée à leur accumulation. L’efférocytose n’est pas un mécanisme essentiel, ce qui explique la similitude des taux de neutrophiles Nox2+ et Nox2-. Les chercheurs se sont alors intéressés à l’IL-1, une cytokine connue pour ses propriétés pro-inflammatoires. La mesure de la production d’IL-1α et d’IL-1β par les cellules dendritiques et les macrophages issus de la moelle osseuse de souris X-CGD et sauvages, et par les macrophages résidents du péritoine, révèle que les cellules hématopoïétiques déficientes en NADPH oxydase produisent plus d’IL-1 en réponse à différents agonistes [10]. Toujours dans ce modèle d’inflammation stérile chez des souris axéniques, la neutralisation par des anticorps de la cytokine IL-1α – mais pas celle de l’IL-1β – abolit le recrutement massif des neutrophiles en inhibant notamment l’augmentation de la sécrétion du G-CSF, lequel peut être produit par des cellules d’origine hématopoïétique (macrophages) ou non (cellules mésothéliales péritonéales, fibroblastes, etc.) au site de l’inflammation. La comparaison des taux sériques de G-CSF chez les souris contrôles et les souris X-CGD fait apparaître chez ces dernières un taux bien plus élevé, qui est à l’origine de la mobilisation des neutrophiles. La déficience en NADPH oxydase n’affecte pas la sensibilité des neutrophiles au G-CSF puisqu’une injection par voie intraveineuse de cette cytokine induit une augmentation similaire du taux sanguin de neutrophiles chez les souris contrôles et les souris X-CGD. C’est donc bien la production accrue de G-CSF induite localement par l’inflammation du péritoine et la sécrétion d’IL-1α qui est responsable de l’augmentation de la neutrophilie observée chez les animaux X-CGD. Dans une dernière étape, les auteurs ont montré que l’inhibition de la phase précoce de l’inflammation chez les souris X-CGD grâce à des anticorps bloquants ciblant les cytokines IL-1α, IL-1β ou G-CSF, ou grâce à la déplétion des neutrophiles via un anticorps dirigé contre une protéine spécifique, la protéine LY6G, permet sa résolution au troisième jour [11]. Ceci se traduit notamment par le retour des taux des macrophages et des neutrophiles péritonéaux aux valeurs observées chez les souris contrôles. La neutralisation de l’IL-1β n’a, quant à elle, qu’un effet minime sur la phase précoce. Cette cytokine semble intervenir dans la phase tardive, indépendamment de l’IL-1α. La baisse de l’efférocytose n’est pas approfondie dans l’article. Dans la discussion, il est mentionné qu’elle n’est pas le mécanisme prédominant. |
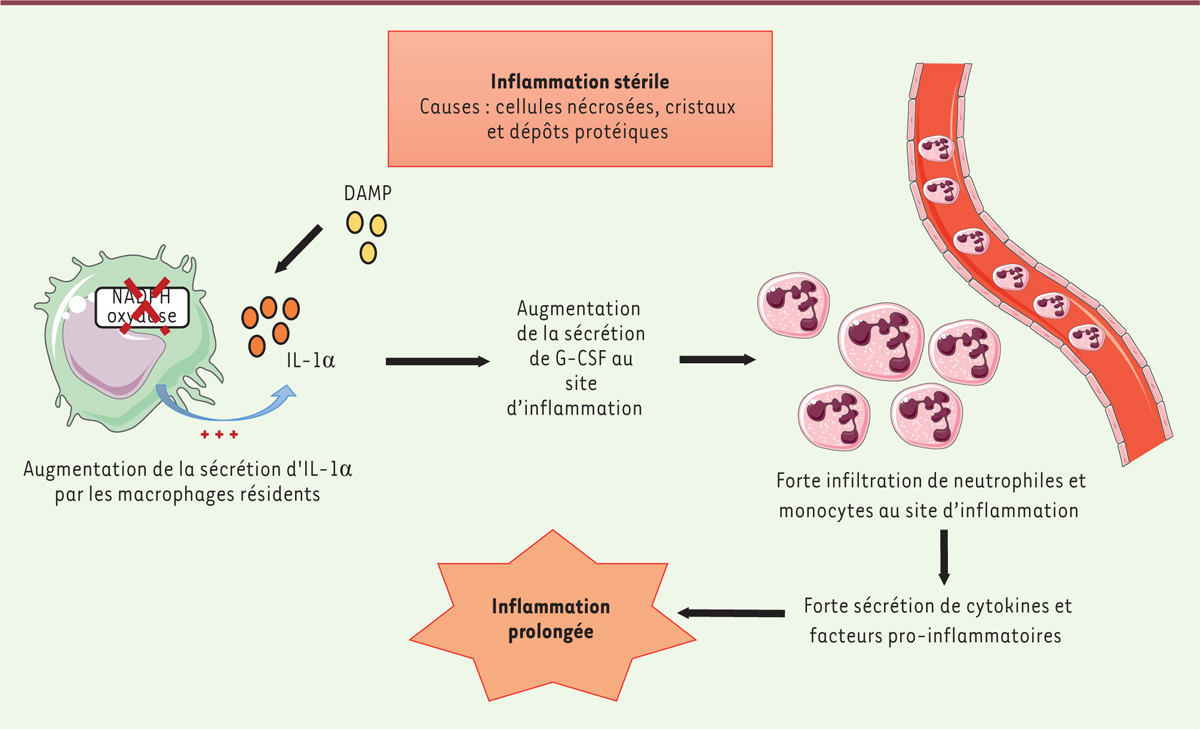
Cette étude met en lumière un rôle anti-inflammatoire de la NADPH oxydase dans l’inflammation stérile. Celle-ci intervient principalement au niveau de l’axe IL-1α/G-CSF qui enclenche la mobilisation des neutrophiles dans les lésions tissulaires (Figure 1). Une baisse de l’activité enzymatique entraîne une surproduction locale et précoce d’IL-1α dans les tissus lésés. Celle-ci induit alors la production de G-CSF par les cellules du péritoine, qui représente le foyer inflammatoire dans cette étude, contribuant au recrutement des neutrophiles et, in fine, à une inflammation prolongée. Une question reste toutefois sans réponse : de quelle manière l’absence de ROS influence-t-elle la sécrétion d’IL-1α ? Il est intéressant également de noter que cette publication renforce l’idée selon laquelle l’IL1-α et l’IL-1β ont des rôles non redondants et séquentiels dans l’inflammation.
 | Figure 1.
Mécanisme de l’inflammation en l’absence de NADPH oxydase. Les motifs moléculaires (DAMP, danger associated molecular pattern) associés à des cellules nécrosées, des cristaux ou des dépôts protéiques, responsables d’une inflammation stérile, sont reconnus par des PRR (récepteurs de reconnaissance de motifs moléculaires) situés sur les cellules phagocytaires, lesquelles contribuent à leur élimination. Chez les souris X-CGD (chronic granulomatous disease), l’absence de NADPH oxydase fonctionnelle conduit à une surproduction d’IL-1α (interleukine-1α) par les macrophages résidant dans les tissus lésés. Cette augmentation d’IL-1α favorise une production locale de G-CSF (granulocyte colony-stimulating factor), qui induit une infiltration excessive de neutrophiles et monocytes au site d’inflammation. Cette agrégation de cellules immunitaires amplifie le phénomène : la sécrétion importante de cytokines et de facteurs pro-inflammatoires pérennise l’inflammation et entraîne des dommages tissulaires (figure réalisée grâce à Servier Medical Art, selon les termes de la licence Creative Commons Attribution 3.0 France). |
Ces résultats fournissent de nouvelles pistes pour lutter contre l’excès d’inflammation stérile chez les patients CGD. L’IL-1 peut être considérée comme une cible dans des approches thérapeutiques, notamment pour soulager ces patients lorsqu’ils souffrent de complications inflammatoires telles que des colites ou des maladies pulmonaires chroniques. L’administration d’un antagoniste du récepteur de l’IL-1 (ANAKINRA) - déjà utilisé dans les cas de polyarthrite rhumatoïde - pourrait s’avérer bénéfique chez ces patients. Les prochaines études visent à déterminer plus précisément les rôles respectifs des deux types d’IL-1, en particulier celui de l’IL-1β dont les cibles ne sont pas encore clairement identifiées, ceci dans le but d’affiner la sélectivité des agents thérapeutiques et de déterminer précisément en quoi l’absence de la NADPH dérégule la production de ces cytokines. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Chuong Nguyen MV, Lardy B, Paclet MH, et al. Les NADPH oxydases, Nox : une nouvelle famille d’isoenzymes . Med Sci (Paris). 2015; ; 31 : :43.–52. 2.
Pick E. Role of the Rho GTPase Rac in the activation of the phagocyte NADPH oxidase . Small GTPases. 2014; ; 5 : :e27952.. 3.
Sarfstein R, Gorzalczany Y, Mizrahi A, et al. Dual role of Rac in the assembly of NADPH oxidase, tethering to the membrane and activation of p67phox: a study based on mutagenesis of p67phox-rac1 chimeras . J Biol Chem. 2004; ; 279 : :16007.–16016. 4.
Martinon F. Signaling by ROS drives inflammasome activation . Eur J Immunol. 2010; ; 40 : :616.–619. 5.
Dostert C, Petrilli V, Van Bruggen R, et al. Innate immune activation through Nalp3 inflammasome sensing of asbestos and silica . Science. 2008; ; 320 : :674.–677. 6.
Stasia MJ La granulomatose septique chronique X+ un fabuleux modèle d’étude de l’activation du complexe NADPH oxydase . Med Sci (Paris). 2007; ; 23 : :526.–532. 7.
Chiriaco M, Salfa I, Matteo G, et al. Chronic granulomatous disease: clinical, molecular and therapeutic aspects . Pediatr Allergy Immunol. 2016; ; 27 : :242.–253. 8.
Bagaitkar J, Pech NK, Stoyan Ivanov S, et al. NADPH oxidase controls neutrophilic response to sterile inflammation in mice by regulating the IL-1a/G-CSF axis . Blood. 2015; ; 126 : :2724.–2733. 9.
Frasch S, Bratton D Emerging roles for lysophosphatidylserine in resolution of inflammation . Prog Lipid Res. 2012; ; 51 : :199.–207. 10.
Day R, Link D Regulation of neutrophil trafficking from the bone marrow . Cell Mol Life Sci. 2011; ; 69 : :1415.–1423. 11.
Daley J, Thomay A, Connolly M, Reichner J, et al. Use of Ly6G-specific monoclonal antibody to deplete neutrophils in mice . J Leukoc Biol. 2007; ; 83 : :64.–70. |