| |
| Med Sci (Paris). 32(8-9): 732–738. doi: 10.1051/medsci/20163208021.Les prothèses de hanche au cobalt sont-elles dangereuses ? Virginie Mistretta,1a William Kurth,2b and Corinne Charlier1c 1Service de toxicologie clinique, médico-légale, de l’environnement et en entreprise, CHU Sart-Tilman, 1 avenue de l’Hôpital, 4000Liège, Belgique 2Service de chirurgie de l’appareil locomoteur, CHU Sart-Tilman, 1 avenue de l’Hôpital, 4000Liège, Belgique |

L’arthroplastie1 de la hanche fait partie des interventions chirurgicales les plus fréquentes en orthopédie [1]. Elle est indiquée dans deux situations, la fracture du col du fémur et la coxarthrose2. Depuis plus d’un siècle, les prothèses de hanche ont beaucoup évolué. À l’heure actuelle, elles se distinguent essentiellement selon le matériau de fabrication (métal, céramique ou polyéthylène). Les arthroplasties réalisées avec des prothèses de hanche à couple métal-métal (PHMM), c’est-à-dire constituées d’une tête et d’un insert en métal, sont nombreuses et donnent très souvent entière satisfaction. Néanmoins, beaucoup d’études rapportent que les teneurs sanguines en cobalt (cobaltémies) observées chez certains patients porteurs de ces PHMM sont élevées par rapport aux valeurs mesurées dans la population générale. La question des conséquences de cette observation sur la santé des patients ayant subi une arthroplastie se pose donc. Dans cette revue, nous aborderons successivement les différents types de prothèses de hanche existants, la toxicité du métal employé, en l’occurrence celle du cobalt, et l’intérêt de son dosage chez le patient orthopédique. Nous illustrerons notre propos par les résultats que nous avons obtenus dans une étude ciblant la cobaltémie chez les patients. |
Plusieurs types de prothèses de hanche dont la prothèse totale (Figure 1) et la prothèse de resurfaçage (Figure 2) existent à l’heure actuelle. La prothèse totale est composée de deux éléments principaux constituant le couple de frottement : un implant fémoral et un implant cotyloïdien (insert au niveau du cotyle ou cavité articulaire de l’os iliaque). Le resurfaçage permet une arthroplastie moins invasive que la prothèse totale. Il consiste à remplacer les surfaces altérées de la tête fémorale et de l’acétabulum3 par deux implants en métal. Il préserve ainsi le centre de la tête fémorale, le col et l’extrémité supérieure du fémur. En raison de ces caractéristiques, le resurfaçage s’adresse à des sujets jeunes et/ou actifs qui seront plus à risque de subir une reprise chirurgicale [2, 3]. Selon le type de matériau de fabrication, les prothèses peuvent être qualifiées de prothèses « dur-dur » (si le couple de frottement est en métal ou en céramique) ou « dur-mou » (si le couple de frottement est en céramique-polyéthylène ou métal-polyéthylène) (Figure 3). Le choix du type de prothèse va dépendre du patient (âge, qualité osseuse, morphologie de l’articulation coxo-fémorale) et des habitudes du chirurgien [4]. Les prothèses de hanche en métal-métal sont très répandues. D’après l’American academy of orthopaedic surgeons, plus d’1 million de prothèses de hanche à couple métal-métal (PHMM) ont été implantées dans le monde depuis 1996 [5]. Étant soumises à l’usure et à la corrosion, les PHMM présentent l’inconvénient de libérer des particules métalliques capables de part leur petite taille, de se disséminer dans l’organisme du porteur par l’intermédiaire de la lymphe et du système vasculaire [1, 4, 6]. La quantité d’éléments libérés est très variable. Elle dépend de nombreux facteurs comme la technique de fabrication, la qualité du revêtement de surface, le diamètre des couples de frottement, la technique chirurgicale, le patient, etc. [7]. Le cobalt qui est le composant majoritaire de l’alliage prothétique (à raison de 60 %) est l’un des principaux métaux retrouvés dans l’organisme. D’autres particules métalliques peuvent également être libérées comme le chrome (qui constitue l’alliage à 30 %), le molybdène (constituant l’alliage à 7 %), le manganèse, le nickel, le fer, le silicium, le vanadium, l’aluminium, ou le titane [8, 9].
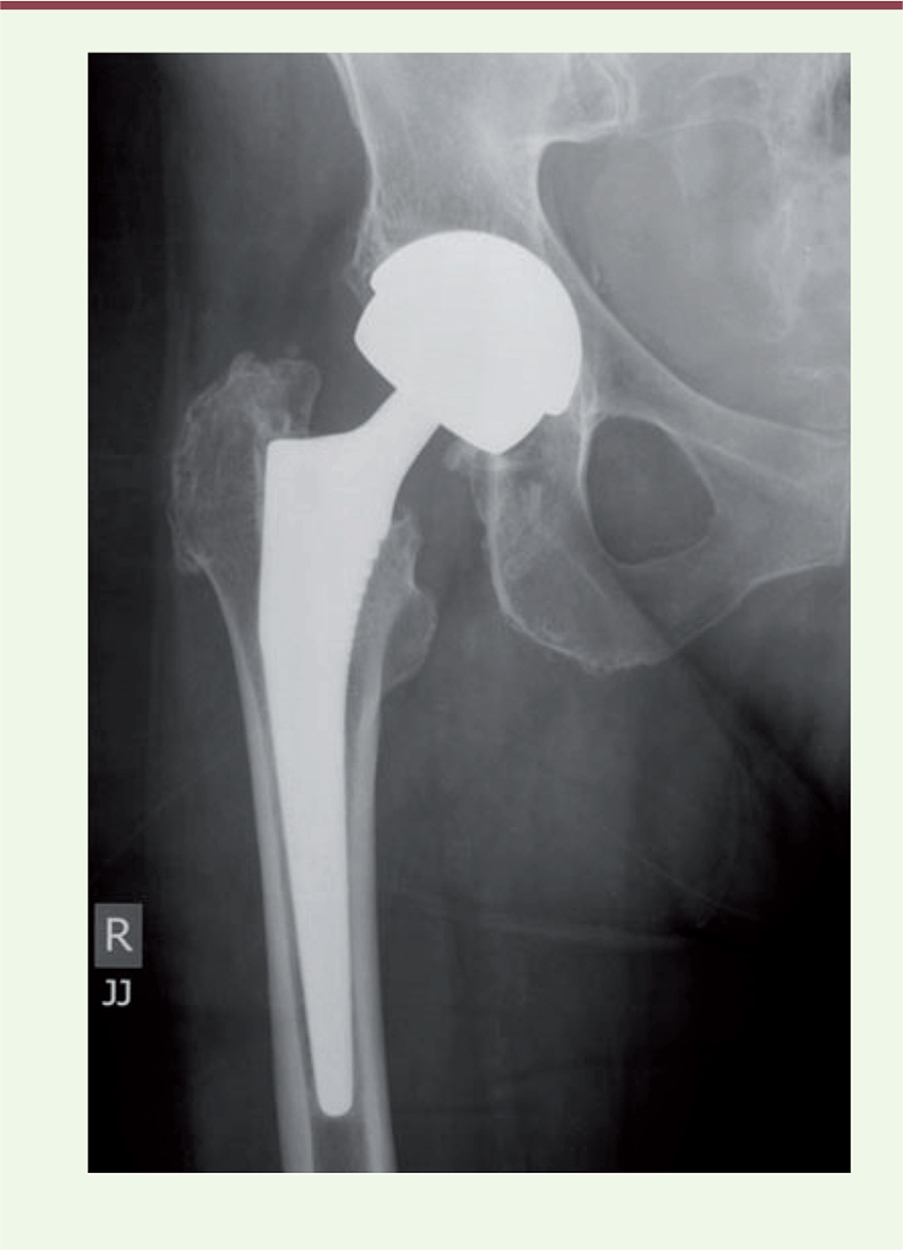
 | Figure 1.
Radiographie de bassin avec une prothèse totale de hanche à couple métal-métal (d’après [ 41]). |
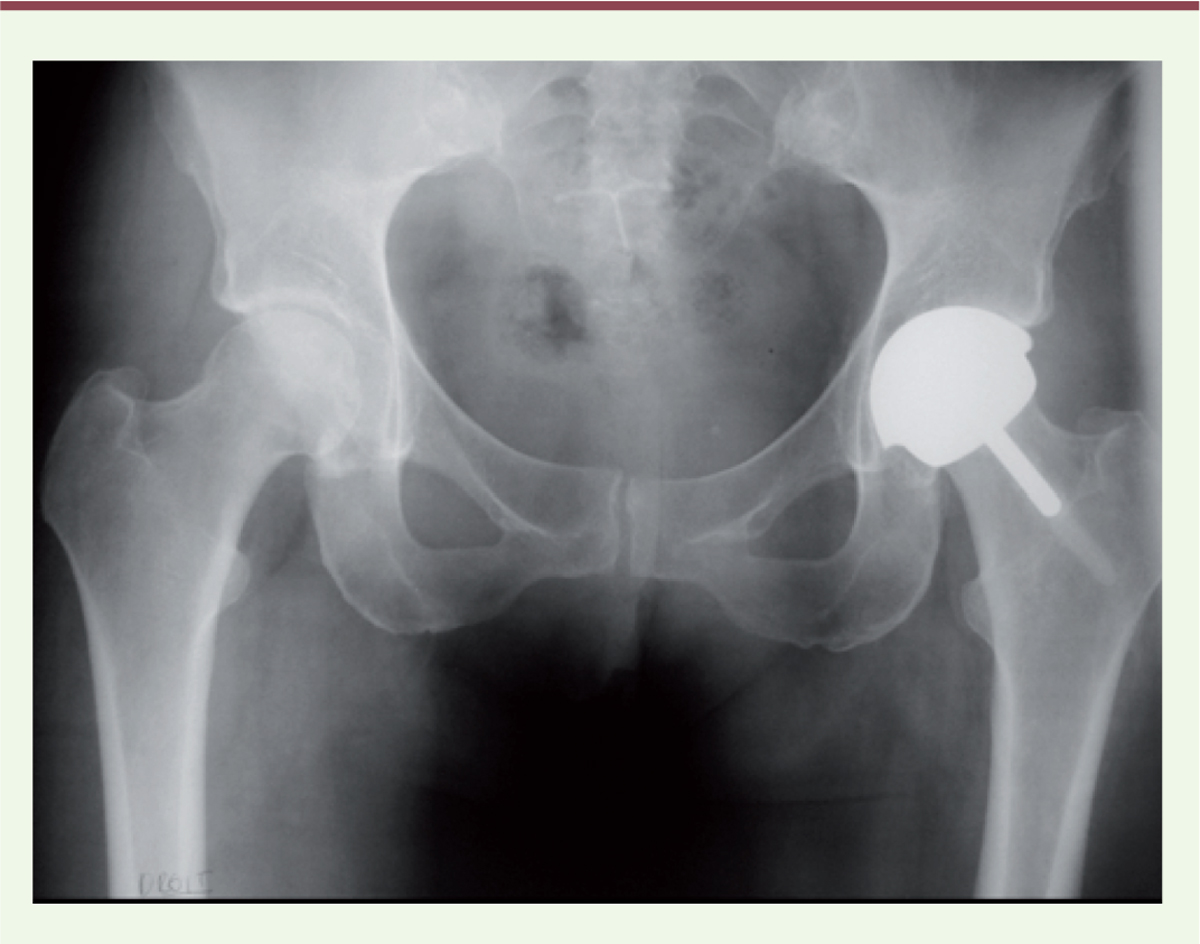
 | Figure 2.
Radiographie de bassin avec un resurfaçage de hanche (d’après [ 2]). |
 | Figure 3.
Couples de frottement de prothèses totales de hanche.
|
|
Sources et usages Le cobalt est un métal naturellement présent dans certains minerais et dans notre alimentation. Constituant de la vitamine B12 (aussi appelée hydroxocobalamine), le cobalt est un oligo-élément essentiel, dont la quantité ingérée chaque jour varie de 2 à 100 µg. Il est également très répandu au niveau industriel. Il entre dans la composition de plus de 5 000 alliages (dont celui des prothèses métalliques) et ses usages sont très diversifiés : fertilisants, biocides, piles rechargeables, additifs alimentaires pour animaux, produits pharmaceutiques, boissons énergétiques, bijoux et objets métalliques, etc. [ 10– 12]. À noter que certains athlètes utilisent les sels de cobalt comme agent dopant, en raison de son effet sur l’érythropoïèse [ 13]. Toxicocinétique Après son absorption par l’organisme, le cobalt est distribué dans tous les tissus, spécialement dans le foie et les reins. Dans le sang, il circule principalement sous forme liée à l’albumine, la fraction libre représentant entre 5 et 10 % du cobalt total présent dans le sang. La majorité du cobalt résorbé dans l’organisme est éliminée par voie rénale en deux phases : une phase majoritaire rapide avec une demi-vie de quelques jours, et une phase minoritaire lente avec une demi-vie de quelques années. Le reste du cobalt est éliminé par voie fécale [ 10, 11, 14]. Mode d’action Le cobalt présente plusieurs activités biologiques [ 11, 14] :
-
Il modifie directement ou indirectement l’activité de diverses enzymes, soit en se fixant aux groupements thiols d’acides aminés de l’enzyme elle-même ou de protéines liées à son activité, soit en remplaçant des cofacteurs enzymatiques, des cations divalents comme le zinc ou le magnésium.
-
Il induit la synthèse hépatique des métallothionéines, des protéines ubiquitaires à haute affinité pour les métaux divalents qui jouent un rôle dans la biodisponibilité et la détoxification cellulaires de ces métaux.
-
Il se fixe aux acides nucléiques.
-
Il stimule la production d’érythropoïétine en induisant une hypoxie tissulaire ayant pour origine l’inhibition d’enzymes impliquées dans le métabolisme oxydatif. Ce mécanisme d’action n’est cependant pas totalement élucidé à l’heure actuelle.
-
Il diminue la synthèse de l’hème (et indirectement de l’hémoglobine) par inhibition de l’acide δ-aminolévulinique synthétase et de la porphobilinogène synthétase.
-
Il augmente le turn-over de l’ATP, active l’arginase et agit sur la fonction monooxygénase hépatique.
Toxicité du cobalt La toxicité du cobalt a principalement été décrite chez les travailleurs exposés de par leur profession, et dans quelques cas d’ingestion non professionnelle. La toxicité aiguë du cobalt est rarement observée et, en cas d’inhalation de hautes doses de métal, elle se manifeste par des troubles gastro-intestinaux (nausées, vomissements, diarrhées, douleurs épigastriques) et respiratoires (toux, dyspnée, éternuements, conjonctivite) [14, 15]. La toxicité chronique, plus fréquente, se caractérise par différents symptômes : rhinite, asthme, dermite allergique (le cobalt est en effet un allergène reconnu), alvéolite et fibrose pulmonaires (caractéristiques de la maladie des « métaux lourds »), cardiomyopathie, polycythémie4,, hypothyroïdie et, exceptionnellement, troubles neurologiques (atrophie du nerf optique, rétinopathie, surdité). Dans les années 1960, du chlorure ou du sulfate de cobalt était ajouté à la bière comme stabilisateur de mousse. Ceci entraîna le syndrome des « cardiomyopathies des buveurs de bière » associé à un épanchement péricardique, une hémoglobine augmentée et une insuffisance cardiaque congestive [11, 14–16]. La toxicité cardiaque du cobalt découlerait de son action sur la consommation d’oxygène dans les mitochondries myocardiques ou sur le transport transmembranaire du calcium intracellulaire ou encore sur le tonus sympathique [12]. Sa thyréotoxicité serait due à l’inhibition de la tyrosine iodinase associée à une diminution de la production des hormones thyroïdiennes [17]. Des cas d’hypothyroïdie ont notamment été décrits chez des enfants anémiques traités par sels de cobalt pendant plusieurs mois, à une époque où l’érythropoiétine humaine recombinante n’était pas encore disponible [11, 14]. Les études épidémiologiques consacrées au risque cancérogène du cobalt sont rares. Elles concernent la survenue de cancers broncho-pulmonaires chez des travailleurs dans des industries de production de carbures métalliques frittés5,. Cependant, dans ces industries, le cobalt n’est pas le seul métal présent et son rôle exact est difficile à préciser. Ainsi, dans une usine électrochimique produisant du cobalt et du sodium, aucune augmentation de mortalité par cancers broncho-pulmonaires n’a été mise en évidence [12, 14]. Cependant, en Belgique, le Centre international de recherche contre le cancer (CIRC) considère le cobalt comme un agent potentiellement cancérogène chez l’homme (groupe 2B) et l’American conference of governmental industrial hygienists (ACGIH) le classe comme cancérogène confirmé chez l’animal, mais dont la transposition à l’humain reste inconnue (groupe A3) [15]. L’utilisation d’alliages en métal pour les implants orthopédiques a ainsi introduit une nouvelle source d’exposition au cobalt. Sa libération à partir des prothèses de hanche en métal (PHM) peut provoquer une toxicité locale que l’on nomme ARMD (adverse reactions to metal debris) et qui se manifeste principalement par une métallose, une réaction d’hypersensibilité ou une tumeur bénigne. La métallose est une accumulation de débris métalliques dans les tissus proches de la prothèse. Ce phénomène, causé par une usure anormale de l’implant, est détectable par imagerie médicale. La réaction d’hypersensibilité, quant à elle, se manifeste par des ulcérations de surface, menant à une inflammation tissulaire, de la douleur, un abcès, etc. Elle résulte d’une activation par les nanoparticules métalliques de lymphocytes périvasculaires et de macrophages. Cette réaction est nommée ALVAL (atypical lymphocytic vasculitis associated lesion). En cas de débris d’usure, de descellement ou d’infection, une tumeur – qualifiée de pseudotumeur, d’aspect kystique et de caractère inflammatoire – peut apparaître, mais ce risque existe également pour les prothèses non métalliques. D’autres manifestations indésirables peuvent survenir comme, par exemple, une ostéolyse, un épanchement articulaire, une nécrose des tissus environnant la prothèse [6, 7]. Ces effets toxiques à court terme ne sont mis en évidence qu’en cas de cobaltémie supérieure à 10 µg/l [18]. À long terme, les conséquences biologiques du cobalt chez le patient porteur de PHM ne sont pas encore entièrement connues. Les risques soupçonnés sont une toxicité organique, un risque carcinologique et un risque pour la descendance [1, 4, 7, 19]. Les symptômes de toxicité systémique, parfois qualifiés de « cobaltisme arthroprothétique », sont rarement décrits dans la littérature. Ils sont similaires à ceux décrits chez les professionnels exposés au cobalt, à savoir : cardiomyopathie, polycythémie, hypothyroïdie et troubles neurologiques (neuropathie périphérique, tremblements de la main, incoordination, déclin cognitif, dépression, vertiges, cécité et surdité) [16, 20]. Des cas d’hypersensibilités cutanées systémiques ont également été rapportés [21]. Selon une revue de la littérature effectuée entre 2001 et 2014 [22], on dénombre 25 patients porteurs de PHM présentant des symptômes de toxicité systémique avec des troubles cardiaques (60 %), auditifs (52 %), thyroïdiens (48 %) et visuels (32 %). La cardiotoxicité peut être prédominante et, parfois, le seul symptôme présent en raison d’un dépôt préférentiel du cobalt dans les tissus myocardiques et le liquide péricardique. Ces effets indésirables ont été constatés en moyenne 41 mois après l’implantation de la prothèse et étaient associés à une cobaltémie moyenne de 324 µg/l, bien que quatre patients présentaient un taux de cobalt inférieur à 20 µg/l [22]. Les manifestations de toxicité systémique qui ne surviennent généralement pas au-dessous de 100 µg/l, voire 300 µg/l de cobalt sanguin, apparaissent d’abord sous forme de troubles hématologiques et thyroïdiens [23, 24]. Si la cobaltémie est supérieure à 700 µg/l, le risque d’effets systémiques neurologiques et cardiaques augmente [25]. Après le retrait de la prothèse chez les patients intoxiqués par le cobalt, l’état clinique s’améliore même si certains symptômes peuvent persister [22, 24]. Plusieurs études ont démontré que le risque cancérogène n’est pas significativement différent de celui de la population générale [7, 26]. En raison du passage transplacentaire du cobalt au cours de la grossesse, le risque pour la descendance est suspecté même s’il n’est pas prouvé. Aucune étude à ce jour n’a mis en évidence d’effets indésirables chez des nouveau-nés de mères porteuses de PHM [6, 12, 19, 27]. Chez les insuffisants rénaux, une accumulation du cobalt pourrait survenir en raison de son défaut d’élimination par les reins. Ce risque n’a cependant jamais été observé [7]. La diminution physiologique de la clairance rénale à partir d’un certain âge, pourrait de même expliquer les taux sanguins de cobalt élevés observés chez des patients âgés porteurs d’une PHM [22]. D’après une étude récente sur les allergies aux métaux chez des patients porteurs de prothèse depuis 5 ans, la prévalence de ces hypersensibilités chez les porteurs de PHMM n’est pas différente de celle observée chez les porteurs de prothèse de hanche à couple métal-polyéthylène [28]. Néanmoins, en raison du principe de précaution, les prothèses métalliques sont à éviter chez les insuffisants rénaux, ainsi que chez les femmes en âge de procréer et chez les patients allergiques aux métaux [19]. |
Dosage du cobalt et recommandations La détermination de la cobaltémie permet d’évaluer le risque toxique attaché aux patients porteurs de PHM. Ce dosage permet aussi de surveiller la performance de l’implant [29–31]. Par exemple, une prothèse mal positionnée ou présentant un défaut de conception s’usera anormalement entraînant une libération accrue d’éléments métalliques mis en évidence par le dosage du cobalt dans le sang circulant. Une usure anormale est généralement associée à une concentration sanguine de cobalt supérieure à 4,5 µg/l [30, 32]. Le dosage du cobalt peut également indiquer un risque d’ostéolyse qui ne serait pas détectable à l’examen clinique ou à la radiographie. Ainsi, sur 14 patients ayant subi une reprise chirurgicale de leur PHMM, 7 présentaient une ostéolyse sévère accompagnée d’un taux de cobalt sanguin moyen égal à 147 µg/l. Parmi ces 7 patients, 5 étaient asymptomatiques et la radiographie était sans anomalie chez 6 d’entre eux [33]. Le dosage du cobalt dans le sang peut être envisagé de deux façons différentes, par spectrométrie de masse avec source d’ionisation par plasma induit haute fréquence (ICP-MS), une méthode considérée comme la référence, qui présente une meilleure sensibilité et un temps d’analyse plus court, et par spectrométrie d’absorption atomique électrothermique (SAA-four). Le milieu recommandé pour le dosage du cobalt est le sang total. En effet, la concentration sanguine est plus stable que la concentration sérique ou plasmatique, ce qui permet une meilleure estimation de l’exposition systémique [3, 11]. Le cobalt peut aussi être dosé dans des milieux comme l’urine, le liquide céphalo-rachidien, le liquide articulaire, ou les globules rouges. Dans certaines études, une augmentation a été constatée dans le liquide synovial et les tissus de patients porteurs de PHM [3]. Dans les liquides biologiques, le taux de cobalt augmente en fait proportionnellement au temps post-implantation. En raison du rodage articulaire qui peut s’étendre jusqu’à 12 mois, il atteindrait un pic sanguin environ 6 mois après l’opération et diminuerait progressivement au cours des 15 mois suivants, pour se stabiliser après environ 3 ans [3, 7, 34]. Selon le premier consensus européen et multidisciplinaire consacré en 2012 aux patients porteurs de PHMM, il n’y a pas de risque clinique pour des valeurs de cobaltémie inférieures à 2 µg/l. Un risque de réaction indésirable localisée aux tissus mous ne peut être écarté pour des valeurs comprises entre 2 et 7 µg/l (le seuil exact n’est pas établi) [35] mais certains auteurs ont démontré qu’un taux sanguin de cobalt égal à 7 µg/l était un indicateur peu prédictif de dommages des tissus mous, avec respectivement une spécificité et une sensibilité de 58 % et 61 % [32]. Selon le consensus européen de 2012, les risques d’ostéolyse, de nécrose tissulaire et d’effets à long terme sur la santé s’observent à partir d’une cobaltémie de 20 µg/l. Au-delà de ce seuil, il est recommandé d’envisager une reprise chirurgicale de la prothèse [35]. La Medicines and healthcare products regulatory agency (MHRA) au Royaume-Uni et l’Agence fédérale des médicaments et des produits de santé (AFMPS) en Belgique, préconisent une valeur seuil de 7 µg/l de cobalt sanguin pour les patients porteurs de PHMM [9]. Ce seuil est donc plus élevé que ceux établis pour la population générale et pour les travailleurs exposés qui sont respectivement de 0,63 µg/l et 1 µg/l de cobalt sanguin [14]. La différence entre la valeur du seuil proposé pour les porteurs de PHM et celle définie dans le milieu industriel repose sur le risque de toxicité respiratoire, notamment celui de cancer bronchopulmonaire, présent uniquement chez les individus qui sont exposés au cobalt de par leur profession. Selon certains auteurs, le taux de cobalt urinaire ajusté à la créatinine serait bien corrélé au taux sanguin. Le seuil urinaire correspondant au seuil sanguin de 7 µg/l a été établi à 30 µg de cobalt par gramme de créatinine [36]. Chez les patients porteurs de deux PHMM, ou ceux présentant une insuffisance rénale, le dosage du cobalt dans le liquide articulaire peut être utile pour évaluer l’usure de l’implant ou sa toxicité locale [37]. Les recommandations actuelles s’accordent pour conseiller un contrôle régulier du patient porteur de PHMM qui consiste en un examen clinique et radiologique et un dosage du cobalt sanguin. Si une de ces trois investigations s’avère anormale, des examens complémentaires doivent être effectués, par exemple une échographie, et des visites de contrôle supplémentaires doivent être programmées [9, 35]. Le taux de cobalt circulant est donc un critère unanimement reconnu pour le suivi des patients porteurs de PHMM, même si à lui seul il ne permet pas de décider d’une reprise chirurgicale [31, 33]. Nous avons réalisé sur une période de 4 ans, 411 dosages de cobalt à partir des prélèvements sanguins de 251 patients (140 hommes et 111 femmes), âgés en moyenne de 61 ans et porteurs d’une prothèse totale de hanche à couple métal-métal (surtout CLS® Spotorno® avec tête Metasul® et cupule DUROM® [ZIMMER, États-Unis]). Les diamètres de tête essentiellement utilisés étaient de 28, 32 et 36 mm. Pour les patients ayant bénéficié de plusieurs dosages de cobalt sanguin, des délais de 1 an, en moyenne, ont été respectés entre chaque prélèvement. Aucun n’a été réalisé pendant la période de rodage des implants, c’est-à-dire moins d’un an après la pose de la prothèse. La méthode utilisée pour la mesure de la cobaltémie est celle recommandée, par spectrométrie de masse avec source d’ionisation par plasma induit haute fréquence (ICP-MS) [38]. La concentration sanguine moyenne de cobalt a été estimée à 2,51 µg/l ; la valeur médiane de la cobaltémie à 1,80 µg/l. Dans 18,7 % des cas, des résultats supérieurs à la valeur seuil de 7 µg/l, avec des extrêmes allant de 7,01 à 1 400 µg/l ont été observés (Tableau I). La moyenne estimée dans la population que nous avons étudiée est donc inférieure au seuil recommandé et fixé à 7 µg/l de cobalt sanguin [9], ce qui correspond aux observations réalisées chez des patients porteurs de PHM pour lesquels le taux de cobalt sanguin se situait au-dessous de 10 µg/l [23]. Également, le pourcentage de résultats supérieurs au seuil recommandé (18,7 %) que nous avons obtenu est équivalent à celui rapporté dans une étude similaire [39]. En comparaison, chez 106 volontaires sains ne portant pas de prothèse [40], la valeur de la cobaltémie a été estimée entre 0,20 µg/l (5e percentile) et 0,63 µg/l (95e percentile), confirmant ainsi que la concentration sanguine de cobalt est significativement plus basse dans la population générale que dans la population des patients avec PHM.
Tableau I.
|
Concentration sanguine de cobalt (µg/l)
|
|
Pour tous les prélèvements(n = 411) |
Pour les prélèvements dont la concentration dépasse le seuil recommandé de 7 µg/l (n = 77) |
| Moyenne géométrique |
2,51 |
24 |
|
| Médiane |
1,80 |
15 |
|
| Minimum – maximum |
< 0,5 – 1 400 |
7,01 – 1 400 |
|
| Nombre de patients : 251 ; âge moyen : 61 ans ; ratio hommes/femmes : 140/111 |
Concentrations sanguines de cobalt mesurées sur une période de 4 ans chez des patients porteurs de PHM.
|
|
Les PHMM sont de plus en plus utilisées depuis les années 1990. Cependant, en raison des risques associés à la libération de débris métalliques dans l’organisme du patient, on peut s’attendre à une utilisation de plus en plus rare, en faveur des implants non métalliques [3]. Les risques les plus fréquents sont l’apparition de métallose ou de réaction d’hypersensibilité, témoins d’une toxicité locale des métaux libérés dans les tissus environnant l’implant. Le risque de toxicité systémique est avéré mais sa fréquence est rare. Ces effets toxiques à court et à long terme ne surviennent généralement pas pour des taux de cobalt sanguin respectivement au-dessous de 10 µg/l et 100 µg/l (voire 300 µg/l). Les symptômes rencontrés sont pour la plupart réversibles après retrait de l’implant. Le dosage du cobalt sanguin associé à un examen clinique et radiologique est recommandé pour le suivi des patients porteurs de PHM. Son intérêt est double : il permet d’évaluer d’abord le risque toxique et ensuite la performance de l’implant. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Caton J, Papin P. Typologie et épidémiologie des prothèses totales de hanche en France . E-mémoires de l’Académie Nationale de Chirurgie. 2012; ; 11 : :1.–7. 2.
Chiron P. Le resurfaçage total de la hanche : le retour du passé ou une arthroplastie moderne ? E-mémoires de l’Académie Nationale de Chirurgie. 2008; ; 7 : :07.–12. 3.
Estey MP, Diamandis EP, Van Der Straeten C, et al. Cobalt and chromium measurement in patients with metal hip prostheses . Clin Chem. 2013; ; 59 : :880.–886. 4.
Christofilopoulos P, Lübbeke A, Peter R, Hoffmeyer P. Le point sur la prothèse totale de hanche . Rev Med Suisse. 2010; ; 6 : :2454.–2458. 5.
American Academy of Orthopaedic Surgeons . Information statement 2012, current concerns with metal-on-metal hip arthroplasty . Available at: www.aaos.org/about/papers/advistmt/1035, consulté en octobre 2015.. 6.
Delaunay C, Petit I, Learmonth ID, et al. Metal-on-metal bearings total hip arthroplasty: the cobalt and chromium ions release concern . Orthop Traumatol Surg Res. 2010; ; 96 : :894.–904. 7.
Valcu CA, Perdreau A, Wouters A, Gillet P. Les inquiétudes liées au couple métal-métal dans les prothèses totales de hanche sont-elles fondées en 2012 ? Rev Méd Liège. 2013; ; 68 : :32.–37. 8.
Hart AJ, Quinn PD, Lali F, et al. Cobalt from metal-on-metal hip replacements may be the clinically relevant active agent responsible for periprosthetic tissue reactions . Acta Biomaterialia. 2012; ; 8 : :3865.–3873. 9.
Agence fédérale des médicaments et des produits de santé . Available at: www.afmps.be, consulté en octobre 2015. 10.
Lauwerys R. Toxicologie industrielle et intoxications professionnelles . Paris: : Masson; , 2007 : :1142. p. 11.
Simonsen LO, Harbak H, Bennekou P. Cobalt metabolism and toxicology:a brief update . Sci Total Environ. 2012; ; 432 : :210.–215. 12.
Barceloux DG. Cobalt . J Toxicol Clin Toxicol. 1999; ; 37 : :201.–206. 13.
Lippi G, Franchini M, Guidi GC. Cobalt chloride administration in athletes: a new perspective in blood doping? Br J Sports Med. 2005; ; 39 : :872.–873. 14.
Institut national de recherche et de sécurité . Available at: www.inrs.fr, consulté en octobre 2015. 16.
Apostoli P, Catalani S, Zaghini A, et al. High doses of cobalt induce optic and auditory neuropathy . Exp Toxicol Pathol. 2013; ; 65 : :719.–727. 17.
Lauwerys R, Lison D. Health risks associated with cobalt exposure: an overview . Sci Total Environ. 1994; ; 150 : :1.–6. 18.
Langton DJ, Sidaginamale RP, Joyce TJ, et al. The clinical implications of elevated blood metal ion concentrations in asymptomatic patients with MoM hip resurfacings: a cohort study . BMJ Open. 2013; ; 3 : :e001541.. 19.
Triclot P. Leçons à tirer de l’étude toxicologique d’une série continue de prothèses totales de hanche à couple métal-métal . Rev Chir Orthop Traumatol. 2011; ; 97S : :9.–12. 20.
Catalani S, Rizzetti MC, Padovani A, Apostoli P. Neurotoxicity of cobalt . Hum Exp Toxicol. 2012; ; 31 : :421.–437. 21.
Wong CC, Nixon RL. Systemic allergic dermatitis caused by cobalt and cobalt toxicity from a metal on a metal hip replacement . Contact Derm. 2014; ; 71 : :113.–114. 22.
Gessner BD, Steck T, Woelber E, Tower SS. A systematic review of systemic cobaltism after wear or corrosion of chrome-cobalt hip implants . J Patient Saf. 2016 (sous presse). 23.
Paustenbach DJ, Galbraith DA, Finley BL. Interpreting cobalt blood concentrations in hip implant patients . Clin Toxicol (Phila). 2014; ; 52 : :98.–112. 24.
Bradberry SM, Wilkinson JM, Ferner RE. Systemic toxicity related to metal hip prostheses . Clin Toxicol (Phila). 2014; ; 52 : :837.–847. 25.
Finley BL, Monnot AD, Gaffney SH, Paustenbach DJ. Dose-response relationships for blood cobalt concentrations and health effects: a review of the literature and application of a biokinetic model . J Toxicol Environ Health B Crit Rev. 2012; ; 15 : :493.–523. 26.
Christian WV, Oliver LD, Paustenbach DJ, et al. Toxicology-based cancer causation analysis of CoCr-containing hip implants: a quantitative assessment of genotoxicity and tumorigenicity studies . J Appl Toxicol. 2014; ; 34 : :939.–967. 27.
DeSouza RM, Wallace D, Costa ML, Krikler SJ. Transplacental passage of metal ions in women with hip resurfacing: no teratogenic effects observed . Hip Int. 2012; ; 22 : :96.–99. 28.
Gustafson K, Jakobsen SS, Lorenzen ND, et al. Metal release and metal allergy after total hip replacement with resurfacing versus conventional hybrid prosthesis: 5-year follow-up of 52 patients . Acta Orthop. 2014; ; 85 : :348.–354. 29.
Hartmann A, Hannemann F, Lützner J, et al. Metal ion concentrations in body fluids after implantation of hip replacements with metal-on-metal bearing–systematic review of clinical and epidemiological studies . PLoS One. 2013; ; 8 : :e70359.. 30.
Sidaginamale RP, Joyce TJ, Lord JK, et al. Blood metal ion testing is an effective screening tool to identify poorly performing metal-on-metal bearing surfaces . Bone Joint Res. 2013; ; 2 : :84.–95. 31.
Hart AJ, Sabah SA, Sampson B, et al. Surveillance of patients with metal-on-metal hip resurfacing and total hip prostheses . J Bone Joint Surg Am. 2014; ; 96 : :1091.–1099. 32.
Griffin WL. Metal ion levels: how can they help us? J Arthroplasty. 2014; ; 29 : :659.–660. 33.
Randelli F, Banci L, Favilla S, et al. Radiographically undetectable periprosthetic osteolysis with ASR implants: the implication of blood metal ions . J Arthroplasty. 2013; ; 28 : :1259.–1264. 34.
Back DL, Young DA, Shimmin AJ. How do serum cobalt and chromium levels change after metal-on-metal hip resurfacing? Clin Orthop Relat Res. 2005; ; 438 : :177.–181. 35.
Hannemann F, Hartmann A, Schmitt J, et al. European multidisciplinary consensus statement on the use and monitoring of metal-on-metal bearings for total hip replacement and hip resurfacing . Orthop Traumatol Surg Res. 2013; ; 99 : :263.–271. 36.
Nicolli A, Bisinella G, Padovani G, et al. Predictivity and fate of metal ion release from metal-on-metal total hip prostheses . J Arthroplasty. 2014; ; 29 : :1763.–1767. 37.
Lass R, Grübl A, Kolb A, et al. Comparison of synovial fluid, urine, and serum ion levels in metal-on-metal total hip arthroplasty at a minimum follow-up of 18 years . J Orthop Res. 2014; ; 32 : :1234.–1240. 38.
Mistretta V, Charlier C. Le dosage du cobalt dans le sang par ICP-MS : application aux patients porteurs de prothèses de hanche en métal . Toxicol Anal Clin. 2015; ; 27 : :91.–98. 39.
Cohen D. How safe are metal-on-metal hip implants? BMJ. 2012; ; 344 : :1410.–1417. 40.
Cesbron A, Saussereau E, Mahieu L, et al. Metallic profile of whole blood and plasma in a series of 106 healthy volunteers . J Anal Toxicol. 2013; ; 37 : :401.–405. 41.
Mao X, Wong AA, Crawford RW. Cobalt toxicity: an emerging clinical problem in patients with metal-on-metal hip prostheses? Med J Aust. 2011; ; 194 : :649.–651. |