| |
| Med Sci (Paris). 32(8-9): 716–718. doi: 10.1051/medsci/20163208018.La sphingosine kinase 1 : rôle dans la stéatose hépatique
Roxane Pruvost1** and Hervé Le Stunff2* 1M1 Biologie Santé, Université Paris-Saclay, 91405Orsay, France 2Université Paris-Saclay, I2BC (Institut de biologie intégrative de la cellule), CNRS UMR 9198, Gif-sur-Yvette, France; Université Paris Diderot, unité BFA (unité de biologie fonctionnelle et adaptative) - CNRS UMR 8251, Paris, France MeSH keywords: Animaux, Hépatocytes, Humains, Foie, Lysophospholipides, Souris, Stéatose hépatique non alcoolique, Récepteur PPAR gamma, Transduction du signal, Sphingosine, métabolisme, étiologie, génétique, physiologie, analogues et dérivés |
La stéatose hépatique non alcoolique La stéatose hépatique non alcoolique désigne un ensemble de pathologies hépatiques survenant en l’absence d’une consommation abusive d’alcool [1]. Ces pathologies ont une forte prévalence dans les pays occidentaux : 20 à 30 % de la population. La stéatose hépatique correspond à l’accumulation anormale de lipides dans le foie [2], essentiellement due à : (1) une augmentation de la synthèse de novo des acides gras non estérifiés ; (2) une diminution de la β-oxydation mitochondriale ; (3) une augmentation du stockage des lipides ; (4) une diminution de la sécrétion des lipides dans la circulation sanguine. Cette accumulation de lipides est contrôlée en particulier par un récepteur nucléaire, PPARγ (peroxisome proliferator-activated receptor gamma).Ce récepteur est surexprimé au niveau du foie, chez les patients atteints de stéatose hépatique et dans plusieurs modèles animaux d’obésité. L’activation de ce récepteur nucléaire favorise la stéatose hépatique, alors que sa délétion au niveau du foie en empêche le développement [3]. Or, récemment, un lien a aussi été établi entre stéatose non alcoolique et métabolisme des sphingolipides, en particulier la sphingosine-1-phosphate (S1P). La question se posait donc de l’interaction possible entre ces deux voies, celle de PPARγ et celle de la S1P. |
La voie SphK1/S1P et la stéatose hépatique non alcoolique Chez les mammifères, la formation de la S1P à partir de sphingosine est catalysée par des sphingosine kinases. Il existe deux types de sphingosine kinases : SphK1 et SphK2 [4]. La SphK1 est retrouvée dans le cytosol et migre à la membrane plasmique après activation, alors que la SphK2 est localisée dans le noyau. La perte de la SphK1 prédispose au diabète, en entraînant la mort des cellules β pancréatiques [5], suggérant que l’axe SphK1/S1P joue un rôle protecteur dans le développement du diabète de type 2. En revanche, le rôle de la SphK1 dans la progression et le développement de la stéatose hépatique est encore imprécis. En effet, si l’accumulation de lipides dans des hépatocytes surexprimant une sphingomyélinase acide est bloquée par l’inhibition de la SphK1 [6], la surexpression de cette même SphK1 dans le foie est incapable de réduire l’accumulation de triglycérides induite par l’obésité [7]. Cette divergence peut provenir du modèle expérimental, fondé sur la surexpression d’enzymes dans le foie, ce qui ne reflète pas l’effet endogène de la SphK1. Récemment, le groupe de Xia a ré-exploré le rôle endogène de la SphK1 dans la stéatose hépatique, à la fois in vitro et in vivo [8]. Il apparaît ainsi que la SphK1 endogène contribue à l’induction de la stéatose hépatique via un mécanisme qui dépend de PPARγ. |
Interactions entre l’axe SphK1/S1P et PPARγ dans le développement de la stéatose hépatique La S1P promeut la stéatose hépatique par l’intermédiaire de ses récepteurs Pour mimer la stéatose hépatique in vitro, les hépatocytes de souris sont traités avec de l’acide palmitique (PA). L’acide palmitique augmente l’expression de la SphK1 dans le muscle et les cellules β pancréatiques [ 9]. Plus le taux d’acide palmitique augmente dans ces cellules et plus la quantité de SphK1 augmente de façon proportionnelle (Figure 1). L’accumulation de triglycérides est plus importante dans les hépatocytes de souris sauvages que dans ceux de souris SphK1-/- après une exposition à l’acide palmitique. Au contraire, la surexpression de la SphK1 potentialise l’accumulation de triglycérides. Ces résultats confirment un rôle de la SphK1 endogène dans l’accumulation de lipides dans les hépatocytes.
 | Figure 1.
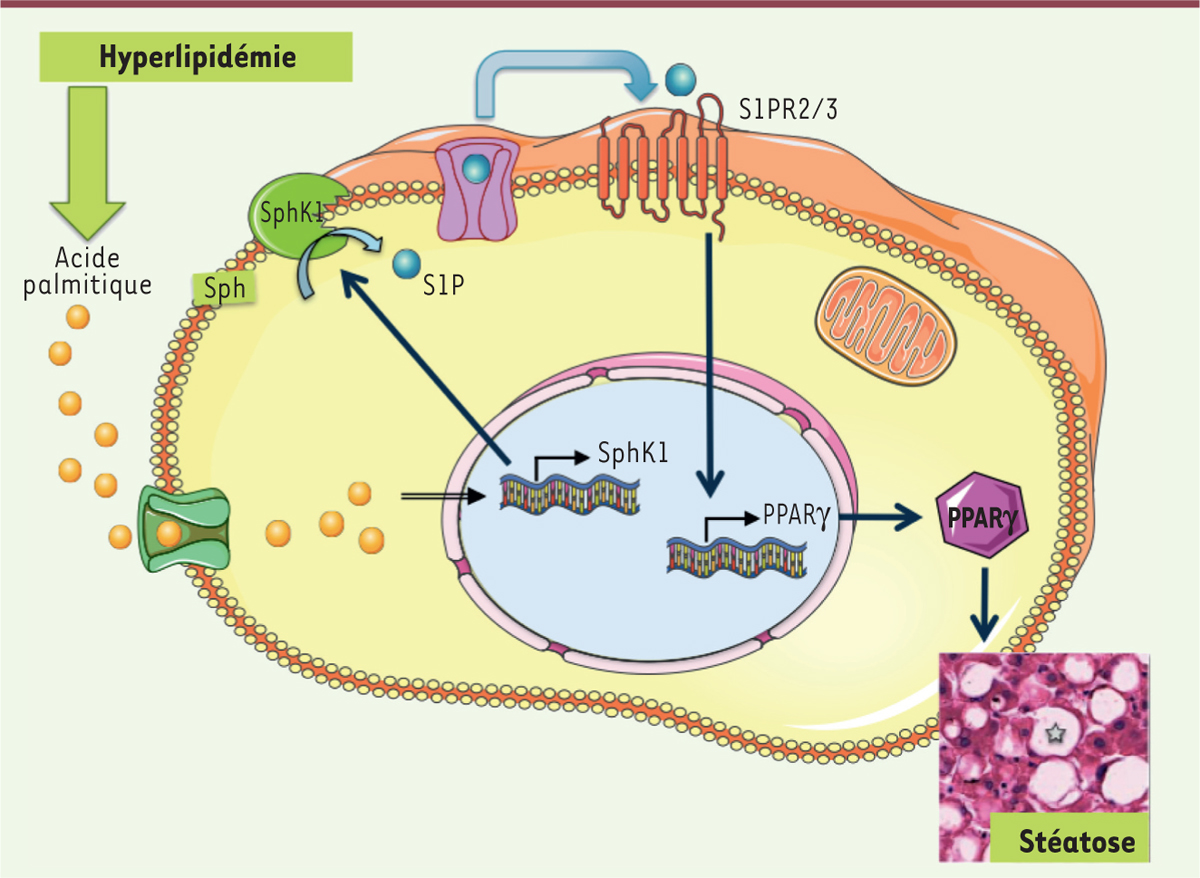
Rôle de la SphK1 dans la mise en place de la stéatose hépatique non alcoolique. La stéatose hépatique est une pathologie caractérisée par l’accumulation anormale de lipides dans le foie. Xia et ses collègues [ 5] ont montré que les acides gras saturés, comme le palmitate, stimule l’expression de la SphK1 dans des hépatocytes. La SphK1, localisée au niveau de la membrane plasmique, catalyse la production de S1P. La S1P sécrétée à l’extérieur par des transporteurs va activer ses récepteurs couplés aux protéines G, S1P 2 et S1P 3. L’activation de ces récepteurs stimule l’expression de PPARγ. Ce facteur de transcription agit comme activateur transcriptionnel sur un ensemble de gènes impliqués dans l’accumulation anormale de lipides dans les hépatocytes, ce qui favorise l’apparition de la stéatose hépatique. Sph : sphingosine ; SphK1 : sphingosine kinase 1 ; S1P : sphingosine-1-phosphate ; S1PR 2/3 : récepteurs de la sphingosine 1 phosphate 2 et 3 ; PPARγ : peroxisome proliferator-activated receptor gamma. |
La S1P – dont la formation est catalysée par SphK1 – agit via la stimulation de récepteurs couplés aux protéines G, les S1PR [10, 11] (→). L’addition de S1P en présence d’acide palmitique induit une accumulation de triglycérides dans les hépatocytes. Cet effet passe par les récepteurs S1P2 et S1P3, comme le montre l’effet de l’inhibition des récepteurs par une approche siARN ou pharmacologique (Figure 1). Néanmoins, il reste à préciser le rôle de ces récepteurs dans l’accumulation de triglycérides induite par la surexpression de la SphK1 dans les hépatocytes.
(→) Voir la Synthèse de O. Cuvillier, m/s n° 11, novembre 2014, page 951
L’axe SphK1/S1P stimule l’expression de PPARγ dans les hépatocytes L’augmentation de l’expression de PPARγ, ainsi que celle de ses gènes cibles, dans les hépatocytes de souris soumises à un régime riche en lipides n’est pas observée chez des souris SphK1-/-. L’expression de PPARγ dans les hépatocytes est également accrue par l’acide palmitique et la S1P. Dans ce dernier cas, l’augmentation de PPARγ est dépendante des récepteurs S1P 2 et S1P 3, et la régulation est transcriptionnelle (Figure 1). La mise en place de la stéatose hépatique induite par la S1P semble donc se faire via l’augmentation de l’expression de PPARγ. L’inhibition de l’expression de PPARγ bloque l’accumulation de triglycérides induite par la S1P, mais également la surexpression de la SphK1 dans les hépatocytes. En accord avec ces résultats, le développement de la stéatose hépatique, caractérisée par l’accumulation de triglycérides hépatiques, est significativement réduit chez des souris SphK1-/- soumises à un régime riche en graisse. |
Conclusions et perspectives L’ensemble de ces résultats suggèrent un rôle de la SphK1 dans la stéatose hépatique via un mécanisme dépendant des récepteurs S1P2 et S1P3 et de l’activation de PPARγ (Figure 1). Dans le foie, PPARγ est exprimé dans les cellules de Kupffer (macrophages spécialisés) et les hépatocytes, mais l’activation de PPARγ dans les cellules de Kupffer n’est pas essentielle au développement initial de la stéatose hépatique [12], suggérant que la régulation de PPARγ par la SphK1 se fait au niveau des hépatocytes. Néanmoins, le rôle de la SphK1 dans les cellules de Kupffer, elles-mêmes impliquées dans la stéatose hépatique, reste encore à déterminer, et en particulier son rôle pro-inflammatoire [13]. Il semble nécessaire, dans de prochaines études, de clarifier le rôle de la SphK1 dans le développement du syndrome métabolique. En effet, Xia et ses collègues ont montré précédemment que les souris SphK1-/- sont prédisposées à développer un diabète de type 2 dû à l’apoptose des cellules β pancréatiques [5]. Il apparaît donc que le développement de la stéatose hépatique est dissocié de celui du diabète chez les souris SphK1-/-. Il reste également à éclaircir le rôle de la SphK1 dans l’insulinorésistance hépatique et son rôle dans le développement de la stéatose hépatique. En effet, l’ablation de la SphK1 n’abroge pas l’insulinorésistance induite par l’obésité [5], alors que la S1P est un médiateur de l’insulinorésistance hépatique induite par l’acide palmitique [14]. Enfin, il est important de déterminer les mécanismes impliqués dans les effets de la SphK1 sur la stéatose hépatique. Il faudra également déterminer la pertinence du rôle de la SphK1 chez l’homme. Récemment, il a été montré que l’expression de la SphK1 hépatique était augmentée chez des patients souffrant de stéatose hépatique [13]. À terme, ces avancées pourraient permettre d’envisager la SphK1 comme une cible thérapeutique potentielle dans le traitement de la stéatose hépatique. |
1.
Lewis JR, Mohanty SR. Nonalcoholic fatty liver disease: a review and update . Dig Dis Sci. 2010; ; 55 : :560.–578. 2.
Ferré P, Foufelle F. Hepatic steatosis: a role for de novo lipogenesis and the transcription factor SREBP-1c . Diabetes Obes Metab. 2010; ; (Suppl 2) : :83.–92. 3.
Tontonoz P, Spiegelman BM. Fat and beyond: the diverse biology of PPARγ . Annu Rev Biochem. 2008; ; 77 : :289.–312. 4.
Maceyka M, Harikumar KB, Milstien S, et al. Sphingosine-1-phosphate signaling and its role in disease . Trends Cell Biol. 2012; ; 221 : :50.–60. 5.
Qi Y, Chen J, Lay A, Don A, et al. Loss of sphingosine kinase 1 predisposes to the onset of diabetes via promoting pancreatic a-cell death in diet-induced obese mice . FASEB J. 2013; ; 27 : :4294.–4204. 6.
Osawa Y, Seki E, Kodama Y, et al. Acid sphingomyelinase regulates glucose and lipid metabolism in hepatocytes through AKT activation and AMP-activated protein kinase suppression . FASEB J. 2011; ; 25 : :1345.–1353. 7.
Kowalski GM, Kloehn J, Burch ML, et al. Overexpression of sphingosine kinase 1 in liver reduces triglyceride content in mice fed a low but not high-fat diet . Biochim Biophys Acta. 2015; ; 1851 : :210.–219. 8.
Chen J, Wang W, Qi Y, et al. Deletion of sphingosine kinase 1 ameliorates hepatic steatosis in diet-induced obese mice: Role of PPARg . Biochim Biophys Acta. 2016; ; 861 : :138.–147. 9.
Bellini L, Campana M, Mahfouz R, et al. Targeting sphingolipid metabolism in the treatment of obesity/type 2 diabetes . Expert Opin Ther Targets. 2015; ; 19 : :1037.–1050. 10.
Spiegel S, Milstien S. The outs and the ins of sphingosine-1-phosphate in immunity . Nat Rev Immunol. 2011; ; 11 : :403.–415. 11.
Cuvillier O. Les récepteurs de la sphingosine 1-phosphate. De la biologie à la physiopathologie . Med Sci (Paris). 2012; ; 28 : :951.–957. 12.
Moran-Salvador E, Lopez-Parra M, Garcia-Alonso V, et al. Role for PPARg in obesity-induced hepatic steatosis as determined by hepatocyte and macrophage-specific conditional knockouts . FASEB J. 2011; ; 25 : :2538.–2550. 13.
Geng T, Sutter A, Harland MD, et al. SphK1 mediates hepatic inflammation in a mouse model of NASH induced by high saturated fat feeding and initiates proinflammatory signaling in hepatocytes . J Lipid Res. 2015; ; 56 : :2359.–2371. 14.
Fayyaz S, Henkel J, Japtok L, et al. Involvement of sphingosine 1-phosphate in palmitate-induced insulin resistance of hepatocytes via the S1P2 receptor subtype . Diabetologia. 2014; ; 57 : :373.–382. |