| |
| Med Sci (Paris). 32(8-9): 710–713. doi: 10.1051/medsci/20163208016.EGFR, régénération et carcinogenèse hépatiques : quelle responsabilité ?
Julia Giraud,1b Mathurin Fatou,1c and Olivier Dellis2a 1M1 Biologie Santé, Université Paris-Saclay, 91405Orsay, France 2Inserm UMR-S 1174, équipe signalisation calcique, bâtiment443, rue des Adèles, 91405Orsay, France MeSH keywords: Animaux, Carcinogenèse, Carcinome hépatocellulaire, Humains, Tumeurs du foie, Régénération hépatique, Souris, Récepteur du facteur de croissance épidermique, génétique, anatomopathologie, physiologie |
Le carcinome hépatocellulaire est le septième cancer le plus répandu dans le monde. Plusieurs facteurs environnementaux, comme la consommation d’alcool ou les infections par les virus des hépatites B ou C, favorisent son apparition, ce qui en fait une priorité de santé publique. En effet, une régénération prolongée des hépatocytes, souvent en relation avec une hépatopathie chronique, engendre des lésions génétiques et épigénétiques des cellules et un déséquilibre de la balance apoptose – prolifération des hépatocytes qui facilitent l’émergence d’une tumeur. |
Quel rôle pour l’EGFR dans la régénération et la carcinogenèse hépatiques ? Un nombre abondant de publications montrent que la voie de l’EGFR (epidermal growth factor receptor) intervient dans la régénération du foie [1–4]. Cependant, les mécanismes l’impliquant dans la carcinogenèse restent largement méconnus. Une des inconnues réside dans le rôle respectif de la voie EGFR, d’une part sur la survie cellulaire, d’autre part sur la prolifération cellulaire [1]. Une seconde inconnue est celle de l’importance d’autres acteurs moléculaires – tels que le HGF (hepatocyte growth factor) et son récepteur c-Met – dans ces deux fonctions de survie et de prolifération, car leur mode d’action n’est que partiellement caractérisé [5]. C’est à ces deux questions qu’une équipe de Barcelone apporte des réponses nouvelles en exploitant un modèle animal original d’étude de la voie EGFR in vivo [6]. |
Un nouveau modèle de souris inactivant sélectivement l’activité catalytique du récepteur de l’EGF Pour étudier le rôle de l’EGFR dans la régénération et la carcinogenèse hépatiques, un nouveau modèle de souris transgénique a été développé [6]. L’ADNc codant l’EGFR, tronqué de son domaine intracellulaire kinase (∆EGFR), a été introduit dans un chromosome bactérien (RP23-279P6) sous le contrôle du promoteur de l’albumine, ce qui permet son expression spécifiquement dans les hépatocytes. Ce chromosome a été ensuite injecté dans les pronucléus d’un œuf fécondé d’une souris, puis l’embryon transféré dans l’utérus d’une souris pseudogestante. Les souris transgéniques ainsi obtenues ont été croisées avec des souris sauvages, produisant des descendants F1 hétérozygotes. Contrairement aux techniques précédemment utilisées (par exemple l’invalidation du gène), cette stratégie permet d’explorer spécifiquement le rôle de l’activité catalytique : en effet, ∆EGFR agit comme un dominant négatif en se combinant aux récepteurs EGFR endogènes sans modifier leur expression, ni leur capacité de fixer le ligand endogène. |
L’inactivation de l’EGFR induit un retard de prolifération, mais n’empêche pas la régénération du foie Les effets de ∆EGFR ont été évalués chez des animaux ayant subi une hépatectomie partielle et chez des animaux sauvages. Cette ablation des 2/3 du foie induit la prolifération des hépatocytes. Dès 6 h après l’hépatectomie, et contrairement à ce qui est observé chez les animaux sauvages, la phosphorylation des protéines AKT et ERK (extracellular signal-regulated kinase) est réduite dans les hépatocytes ∆EGFR, démontrant la perturbation de la voie de signalisation correspondante. Il existe un retard de prolifération, qui se traduit par une diminution du nombre d’hépatocytes deux jours après hépatectomie chez les souris ∆EGFR, retard qui se corrige après trois jours. Ce retard témoigne du fait que si la voie EGFR intervient dans la prolifération cellulaire des hépatocytes, elle n’est pas la seule. L’EGF jouant un rôle important dans l’atténuation des effets négatifs du TGFβ (transforming growth factor) sur la prolifération [7], les auteurs se sont intéressés à certaines protéines intervenant dans cette voie. Dans les cellules du foie des souris ∆EGFR, la phosphorylation de la protéine Smad3, témoin de l’activation de la voie TGFβ, est accrue par rapport aux cellules du foie de souris sauvages, de même que les transcrits TGFβ. En revanche, les taux d’ARNm de l’α2-macroglobuline, molécule inhibant les effets de TGFβ, sont faibles. Ces résultats confirment des résultats antérieurs suggérant que la voie EGFR inhibe les actions de la voie TGFβ et augmente par conséquent la réponse proliférative après hépatectomie partielle. Une apoptose accrue n’explique pas le délai de prolifération chez les souris ∆EGFR : la protéine pro-apoptotique Bim (Bcl-2-like protein 1) n’est pas surexprimée chez ces souris, et la protéine anti-apoptotique BclxL (B-cell lymphoma extra large) n’est pas non plus sous exprimée. L’EGFR serait exclusivement impliqué dans la prolifération cellulaire hépatique via la modulation de l’activation de l’expression des gènes régulateurs du cycle cellulaire induite par la voie TGFβ. Cette hypothèse a pu être confirmée par l’observation d’une expression élevée des gènes Cdkn2b et Cdkn1a, codant respectivement p15 et p21, protéines inhibitrices de l’entrée en phase S du cycle cellulaire, ce qui peut expliquer le retard de prolifération des hépatocytes (Figure 1).
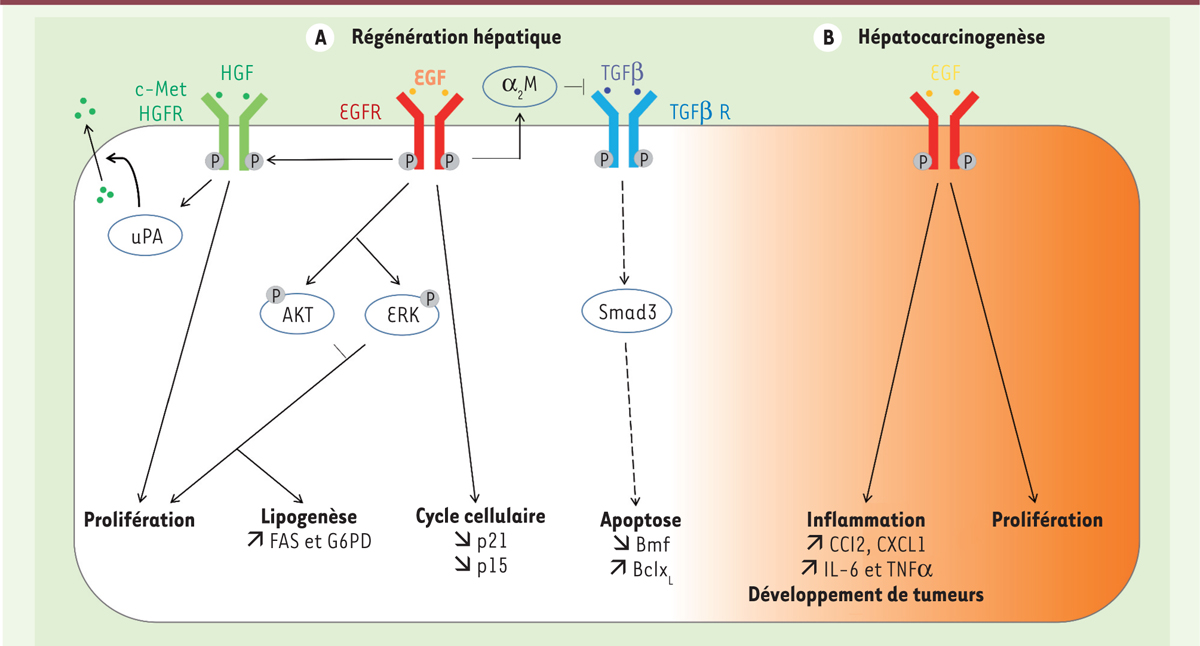
 | Figure 1.
Vue d’ensemble des rôles de l’EGFR dans la régénération et la carcinogenèse hépatiques. A. En situation physiologique lors de la régénération hépatique, l’EGFR permet la prolifération cellulaire via l’activation de la voie HGF/c-Met, des voies AKT et ERK (extracellular signal-regulated kinase) et via la diminution du taux de p21 et de p15 inhibitrices de l’entrée en phase S du cycle cellulaire. De plus, l’activation de ces kinases stimule l’expression des gènes intervenant dans la biosynthèse des acides gras, soit FAS (fatty acid synthase) et G6PD (glucose-6-phosphate déshydrogénase). Enfin, l’EGFR aurait un rôle antiapoptotique via l’α2-macroglobuline (a2M) inhibitrice de la signalisation de la voie TGFβ, qui induirait une expression accrue de la protéine antiapoptotique BclxL et une baisse du taux de la protéine proapoptotique Bmf. B. En situation pathologique lors d’une hépatocarcinogenèse, l’EGFR a une action proinflammatoire en induisant le recrutement des chimiokines CCL2 et CXCL1 et des cytokines IL-6 (interleukine-6) et TNFα (tumor necrosis facor alpha), ce qui contribue à induire le développement de tumeurs. EGFR : epidermal growth factor receptor ; HGF : hepatocyte growth factor ; HGFR : récepteur de l’HGF : TGFβ : transforming growth factor beta ; TGFβ R : récepteur du TGFβ ; uPA : urokinase-type plasminogen ; a2M : alpha-2-macroglobuline ; Smad3 : mothers against decapentaplegic homolog 3 ; Bmf : Bcl-2-like protein 1 ; BclxL : B-cell lymphoma-extra large ; CCL2 : chemokine ligand 2 ; CXCL1 : chemokine [C-X-C motif] ligand 1. |
Le fait que la prolifération cellulaire soit simplement retardée, mais pas abolie, chez les souris ∆EGFR hépatectomisées, signifie que la voie EGFR est nécessaire à la réponse à l’hépatectomie étant donné qu’elle libère des signaux mitogènes. Néanmoins, la récupération au bout de 3 jours suggère l’intervention d’autres molécules. C’est effectivement le cas : les ARNm codant le facteur de croissance hépatique HGF et l’uPA (urokinase-type plasminogen) – qui permet la libération de l’HGF de la matrice extracellulaire – sont fortement exprimés chez les souris ∆EGFR, et le taux de phosphorylation du récepteur c-Met l’est également. Cette suractivation de la voie HGF-cMet compense ainsi la défaillance de la voie EGFR chez les souris ∆EGFR. La cinétique de récupération de la masse du foie après hépatectomie partielle est la même chez les souris transgéniques sauvages et ∆EGFR, ce qui renforce l’hypothèse de l’intervention compensatrice d’autres voies de signalisation impliquées dans la prolifération. Ce retard de prolifération induit par l’inactivation de l’EGFR n’empêche donc pas la récupération de la masse totale du foie. |
L’inactivation de l’EGFR retarde l’apparition de tumeurs L’injection de diéthyl-nitrosamine (DEN, carcinogène chimique) chez les souris nouveau-nés sauvages ou ∆EGFR induit le développement ultérieur d’un carcinome hépatique. Si le nombre de tumeurs et de lésions prénéoplasiques chez les souris ∆EGFR est inférieur à celui chez des souris sauvages 9 mois après le traitement par la DEN, cette différence disparaît après 12 mois. L’inactivation de l’EGFR ne fait donc que retarder l’apparition des tumeurs, mais n’en abolit pas le développement. L’inflammation jouant un rôle dans l’hépatocarcinogenèse, les auteurs ont étudié certains marqueurs inflammatoires chez ces souris. Après traitement par le DEN, et en comparaison des souris sauvages, les souris ∆EGFR n’expriment aucun marqueur fort de macrophages dans le foie, et les taux d’ARNm codant les cytokines pro-inflammatoires IL-6 (interleukine-6) et TNFα (tumor necrosis factor α) dans le stroma péritumoral, et les chimiokines CCL2 (chemokine ligand 2) et CXCL1 (chemokine ligand 1) sont faibles. De plus, aucune fibrose ne se développe. Si ces observations distinguent le foie des souris sauvages de celui des souris ∆EGFR initialement, aucune différence n’est plus perceptible après 12 mois, démontrant, comme pour la prolifération cellulaire et l’émergence des tumeurs, que le déclenchement de l’inflammation n’est que retardé chez les souris ∆EGFR. |
L’ensemble de ces résultats montre qu’au cours des phases initiales de la régénération hépatique, le rôle de l’EGFR serait de privilégier la prolifération cellulaire et non d’empêcher la mort cellulaire, ce qui précise des résultats précédemment obtenus [8]. Ce processus se ferait via la régulation de la voie TGFβ et des kinases impliquées dans le cycle cellulaire. Cependant, le nombre de protéines pro- et antiapoptotiques testé est faible, ce qui ne permet pas d’exclure totalement un rôle dans la survie. L’absence de récepteur de l’EGF dont l’activité catalytique est fonctionnelle certes cause un retard dans la régénération et la carcinogenèse hépatocellulaires, probablement rapidement compensé par l’intervention d’autres voies de signalisation, telle que celle de l’HGF/Met, comme en témoigne l’augmentation de la phosphorylation de c-Met chez les souris ∆EGFR. Cependant, le ou les mécanismes associés à une absence initiale de carcinogenèse (s’agit-il d’un dysfonctionnement de l’apoptose ou du processus de néoangiogenèse dans l’environnement de la tumeur ?) n’ont pas été étudiés. Au-delà de la caractérisation des acteurs moléculaires des voies EGFR et HGF/c-Met intervenant dans la prolifération cellulaire, ce modèle de souris transgénique ΔEGFR pourrait aider au développement d’une stratégie thérapeutique utile dans les maladies hépatiques chroniques et la carcinogenèse du foie. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Berasain C, Avila MA. The EGFR signalling system in the liver: from hepatoprotection to hepatocarcinogenesis . J Gastroenterol. 2014; ; 40 : :9.–23. 2.
Michalopoulos GK. Liver Regeneration after partial hepatectomy . Am J Pathol. 2010; ; 176 : :2.–13. 3.
Riehle KJ, Dan YY, Campbell JS, Fausto N. New concepts in liver regeneration . J Gastroenterol Hepatol. 2011; ; 26 ((suppl 1)) : :203.–212. 4.
Fausto N, Campbell JS, Riehle KJ. Liver regeneration . J Hepatol. 2012; ; 57 : :692.–694. 5.
Factor VM, Seo D, Ishikawa T, et al. Loss of c-Met disrupts gene expression program required for G2/M progression during liver regeneration in mice . PLoS One. 2010; ; 5 : :e12739.. 6.
López-Luque J, Caballero-Díaz D, Martinez-Palacián A, et al. Dissecting the role of epidermal growth factor receptor catalytic activity during liver regeneration and hepatocarcinogenesis . Hepatology. 2016; ; 63 : :604.–619. 7.
Carmona-Cuenca I, Herrera B, Ventura JJ, et al. EGF blocks NADPH oxidase activation by TGF-beta in fetal rat hepatocytes, impairing oxidative stress, and cell death . J Cell Physiol. 2006; ; 207 : :322.–330. 8.
Natarajan A, Wagner B, Sibilia M. The EGF receptor is required for efficient liver regeneration . Proc Natl Acad Sci USA. 2007; ; 104 : :17081.–17086. |