| |
| Med Sci (Paris). 32(6): 585–587. doi: 10.1051/medsci/20163206020.La prolifération des cholangiocytes induite par les acides biliaires : place du récepteur TGR5
Caroline Barichon,1a Caroline Correia,1b and Thierry Tordjmann2c 1M1 Biologie Santé, Université Paris-Saclay, 91405Orsay, France 2ICPH (interactions cellulaires et physiopathologie hépatique), Inserm, UMR S1174, Université Paris-Saclay (Université Paris-Sud), bâtiments 440-443, rue des Adèles, 91400Orsay, France MeSH keywords: Animaux, Acides et sels biliaires, Conduits biliaires, Prolifération cellulaire, Humains, Souris, Souris knockout, Récepteurs couplés aux protéines G, Régulation positive, pharmacologie, effets des médicaments et substances chimiques, physiologie, génétique |
Les cholestases chroniques sont des maladies hépatiques associées à une altération de la sécrétion biliaire résultant en une augmentation de la concentration plasmatique en acides biliaires et l’observation de lésions des voies biliaires [1–3]. Au cours de ces maladies, on constate une prolifération excessive des cellules épithéliales bordant les canaux biliaires : les cholangiocytes. Les acides biliaires, constituants essentiels de la bile, sont connus pour être indispensables à la digestion des lipides du fait de leurs propriétés détergentes. Depuis quelques années, ils sont considérés comme des molécules de signalisation dont les fonctions sont assurées par l’activation de divers récepteurs, nucléaires ou membranaires. Parmi les récepteurs membranaires, TGR5 – ou Gpbar1 (G protein-coupled bile acid receptor 1) – est le plus étudié. C’est un récepteur à sept domaines transmembranaires couplé aux protéines G et classiquement à la production d’AMPc (→).
(→) Voir à ce propos le numéro thématique Récepteurs couplés aux protéines G, m/s n° 10, octobre 2012
Dans le foie, TGR5 est principalement exprimé dans les cholangiocytes [4, 5] et pourrait ainsi représenter une cible thérapeutique d’intérêt dans des pathologies biliaires. Par ailleurs, il a été rapporté que la stimulation de TGR5 induisait une prolifération des cholangiocytes [6], mais les mécanismes sous-jacents restaient inconnus. Or, récemment, une équipe de l’université Heinrich Heine de Düsseldorf (Allemagne) a identifié les voies de signalisation impliquées dans la prolifération cholangiocytaire dépendante de TGR5 [7]. |
L’agent TGR5 en charge de la signalisation Dans ce travail [7], l’impact régulateur de TGR5 sur la prolifération des cholangiocytes a été étudié in vivo et in vitro. Des modèles de cholestase conduisant à une surcharge en acides biliaires ont été utilisés chez la souris sauvage (wild type, WT) ou génétiquement invalidée pour TGR5 (knock-out, KO). Les rongeurs ont été soumis soit à un régime alimentaire supplémenté en acide cholique (un acide biliaire), soit à une ligature de la voie biliaire principale. Dans ces modèles, l’expression de marqueurs de prolifération (Ki67, PCNA [proliferation cell nuclear antigen]) ainsi que l’incorporation de bromodéoxyuridine (BrdU) dans l’ADN lors de sa réplication, ont été suivies par immunohistochimie. In vitro, dans des cultures de cholangiocytes ou de lignées de cholangiocarcinomes (cancer des voies biliaires), les voies de signalisation impliquées ont été déduites de l’utilisation d’agents pharmacologiques spécifiques de TGR5 et d’inhibiteurs de divers intermédiaires de la signalisation. Les résultats montrent que in vivo, la prolifération des cholangiocytes était significativement réduite chez les souris TGR5-KO en comparaison des souris sauvages après l’induction d’une cholestase. In vitro, la prolifération induite après stimulation des cellules par le TLCA (acide taurolithocholique, un acide biliaire et ligand de TGR5), ou par un agoniste spécifique de TGR5, implique Map/Erk kinase-1 et engendre la phosphorylation d’ERK1/2 (extracellular signal-regulated kinase 1/2) dans les cholangiocytes des souris sauvages uniquement. La voie MAPK (mitogen-activated protein kinase) est en fait sollicitée en réponse à la transactivation du récepteur EGFR (epithelium growth factor receptor). Cette transactivation se fait via la production de RNOS (reactive nitrogen oxide species), l’activation de c-Src (cellular rous sarcoma oncogene), la stimulation des ADAM/MMP (métalloprotéases) induisant le clivage de pro-EGF membranaire et donc la sécrétion d’EGF activant l’EGFR. Ce mécanisme a été observé uniquement chez les souris sauvages, suggérant que l’intervention de TGR5 est essentielle à cette voie. |
Le côté obscur de l’agent TGR5 Dans les cholangiocytes sauvages, l’expression de TGR5 est localisée à la membrane apicale. Dans les cholangiocarcinomes, TGR5 est exprimé à la membrane apicale mais aussi dans des vésicules intracellulaires, ce qui est compatible avec une surexpression du récepteur en conditions pathologiques. Le rôle de TGR5 dans la survie des cholangiocytes sains et tumoraux a été notamment montré à l’aide de deux techniques. D’une part, l’immunoprécipitation du récepteur de mort CD95-R avec des anticorps spécifiques met en évidence la phosphorylation de ce récepteur, témoignant de son activation [8]. D’autre part, le test TUNEL (terminal deoxynucleotidyl transferase dUTP nick end labeling), qui permet un marquage fluorescent de l’ADN fragmenté, détecte une apoptose à un stade avancé. Le traitement des cholangiocytes issus de souris TGR5-KO par CD95-L (ligand de CD95 qui induit l’apoptose en se fixant à ce récepteur) a engendré une diminution de la survie, traduisant l’activation effective de CD95-R. En revanche, la survie était augmentée dans les cholangiocytes sauvages et dans les cholangiocarcinomes. En effet, l’activation de TGR5 entraîne une augmentation de l’AMPc ainsi que l’activation de la PKA, engendrant la phosphorylation de CD95-R. Ce dernier est alors internalisé, ce qui explique sa détection dans des vésicules intracellulaires, et ne peut plus être activé par CD95-L. La stimulation de TGR5 engendre donc des effets anti-apoptotiques à l’origine de la survie des cholangiocytes sains et tumoraux
Figure 1).
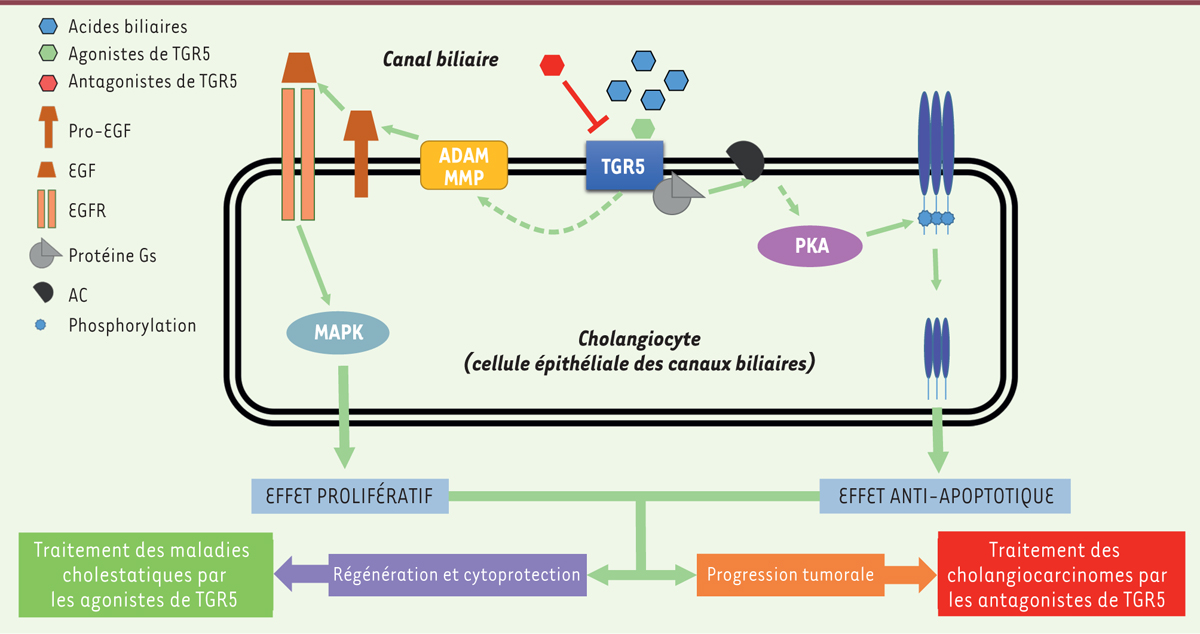
 | Figure 1.
TGR5 et ses prétendants. La liaison des acides biliaires ou des agonistes spécifiques de TGR5 (ou Gpbar 1, G protein-coupled bile acid receptor 1) entraîne la stimulation de la voie MAPK (mitogen-activated protein kinase) par l’intermédiaire de la sécrétion d’EGF en réponse au clivage de pro-EGF membranaire par les métalloprotéases ADAM/MMP. L’EGF libéré se lie à l’EGFR (epithelium growth factor receptor) et permet sa transactivation, stimulant la prolifération cellulaire. Indépendamment de cette voie, la protéine Gs couplée à TGR5 va activer l’adénylate cyclase (AC) et induire l’activation de la PKA (protéine kinase A). Cette dernière permet la séquestration intracellulaire de CD95-R, conduisant à un effet anti-apoptotique. Ces deux effets combinés sont à l’origine de la régénération et de la cytoprotection des cholangiocytes sains, mais également de la progression tumorale. En se fondant sur ces observations, le traitement des maladies cholestatiques pourrait bénéficier des agonistes de TGR5, tandis que celui des cholangiocarcinomes pourrait utiliser des antagonistes. |
|
Les maladies du foie se font de la bile TGR5 apparaît donc comme un médiateur important de la prolifération et de la survie des cholangiocytes. Son niveau d’expression pourrait par conséquent être crucial pour l’homéostasie biliaire, et donc pour la physiopathologie de nombreuses maladies du foie. De plus, un polymorphisme SNP (single nucleotide polymorphism), commun chez les patients atteints de cholangite sclérosante primitive1, a été trouvé dans le gène codant pour TGR5 et diminue son expression [9]. Ainsi, dans des conditions de surcharge en acides biliaires, TGR5 aurait un rôle cytoprotecteur des cholangiocytes sains, alors qu’il pourrait contribuer à la progression tumorale des cellules malignes. TGR5 peut donc s’avérer particulièrement intéressant en tant que cible pharmacologique dans le traitement des maladies cholestatiques ainsi que dans celui des cholangiocarcinomes. Des agonistes du récepteur pourraient, dans ce cadre, être utilisés pour lutter contre des maladies cholestatiques telles que la cholangite sclérosante primitive. Cependant, l’effet prolifératif de l’activation de TGR5 doit conduire à la plus grande prudence, et suggère de n’utiliser des agonistes TGR5 qu’à des doses adaptées et de manière ponctuelle. Par ailleurs, les résultats obtenus incitent à envisager l’utilisation d’antagonistes TGR5 dans un but antitumoral, ce d’autant que les traitements conventionnels des cholangiocarcinomes sont très limités. Toutefois, les effets potentiels de ces antagonistes sur les voies impliquées dans les effets prolifératifs et anti-apoptotiques restent à être élucidés. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Poupon R. Cholestasis and cholestatic liver diseases . Gastroenterol Clin Biol. 2009; ; 33 : :778.–788. 2.
Magyar I, Loi HG, Fehér T Plasma bile acid levels and liver disease . Acta Med Acad Sci Hung. 1981; ; 38 : :109.–115. 3.
McRae M, Rezk NL, Bridges AS, et al. Plasma bile acid concentrations in patients with HIV infection receiving protease inhibitor therapy: possible implications for hepatotoxicity . Pharmacotherapy. 2010; ; 30 : :17.–24. 4.
Masyuk TV, Masyuk AI, LaRusso NF TGR5 in the cholangiociliopathies . Dig Dis. 2015; ; 33 : :420.–425. 5.
Jones H, Alpini G, Francis H Bile acid signaling and biliary functions . Acta Pharm Sin B. 2015; ; 5 : :123.–128. 6.
Rodrigues CM, Moshage H Targeting TGR5 in cholangiocyte proliferation: default topic . Gut. 2016; ; 65 : :369.–370. 7.
Reich M, Deutschmann K, Sommerfeld A, et al. TGR5 is essential for bile acid-dependent cholangiocyte proliferation in vivo and in vitro . Gut. 2016; ; 65 : :487.–501. 8.
Reinehr R, Häussinger D Inhibition of bile salt-induced apoptosis by cyclic AMP involves serine/threonine phosphorylation of CD95 . Gastroenterology. 2004; ; 126 : :249.–262. 9.
Hov JR, Keitel V, Laerdahl JK, et al. Mutational characterization of the bile acid receptor TGR5 in primary sclerosing cholangitis . PLoS One. 2010; ; 5 : :e12403.. |