| |
| Med Sci (Paris). 32(6): 582–584. doi: 10.1051/medsci/20163206019.
Crystal Wars : la nécroptose contre-attaque
Diana García García,1c Charlotte Duwat,1b and Pierre Bobé2a 1M1 Biologie Santé, Université Paris-Saclay, 91405Orsay, France 2Inserm UMR S 1174, Interactions cellulaires et physiopathologie hépatique, bâtiment 440-443, université Paris Sud, rue des Adèles, 91405Orsay, France MeSH keywords: Atteinte rénale aigüe, Animaux, Apoptose, Mort cellulaire, Cristallisation, Diabète de type 2, Néphropathies diabétiques, Humains, Souris, Thérapie moléculaire ciblée, Nécrose, Néphrolithiase, Protein kinases, Transduction du signal, étiologie, métabolisme, physiologie, complications, anatomopathologie, tendances |
Une étude récente portant sur des patients atteints de diabète de type II a révélé chez trois d’entre eux une insuffisance rénale aiguë (IRA) secondaire à une néphropathie aiguë à oxalate, caractérisée par la présence de dépôts tubulo-interstitiels d’oxalate, accompagnés d’une réaction inflammatoire [1]. Cette étude montre que les cristallopathies – comme la néphropathie aiguë à oxalates – devraient être plus souvent recherchées comme étiologie d’une insuffisance rénale aiguë. Les cristallopathies sont des maladies caractérisées par la présence de cristaux dans différents organes1. Ces cristaux sont de tailles et formes variables, composés d’ions ou encore de molécules produites par l’organisme (comme l’urée). La formation des dépôts commence par un processus de nucléation – qui correspond à l’apparition des premiers germes cristallins dans les tissus – suivi par la croissance de ces germes jusqu’à former des cristaux. De nombreuses recherches ont déjà montré que la nucléation, la formation et la présence des cristaux dans les tissus cibles des cristallopathies sont la cause des lésions, de l’inflammation et du remodelage tissulaires. Cependant, il reste encore une part d’inconnu dans ce type de maladie. En effet, il n’a pas encore été déterminé quelle est la part, dans les lésions, de l’inflammation (effet indirect) et des cristaux eux-mêmes (effet direct) et, dans ce dernier cas, s’il s’agit d’un effet purement mécanique ou d’un processus régulé. L’équipe de H.J. Anders de l’université de Munich [2] explore l’hypothèse d’un processus régulé à l’origine des lésions, et permet de mieux comprendre les voies de signalisation impliquées dans ce type de pathologie. |
Comment les cristallopathies sont-elles produites ? Les cristaux sont reconnus par le système immunitaire inné comme des « signaux de danger » capables d’activer les récepteurs cytosoliques NLR (NOD like receptor) exprimés de façon constitutive par les cellules phagocytaires. L’activation de ces récepteurs intervient dans les processus d’inflammation et d’apoptose via la voie de l’inflammasome NLRP3 [3, 4] (→), un complexe cytosolique multiprotéique qui favorise l’activation autocatalytique des caspases inflammatoires. Ces enzymes, comme la caspase 1, sont responsables de la maturation et sécrétion des cytokines IL(interleukine)-1β et IL-18 et de la mort cellulaire par pyroptose [5–7] (→).
(→) Voir la Synthèse de Y. Jamilloux et T. Henry, m/s n° 11, novembre 2013, page 675
(→) Voir la Synthèse de L. Cabon et al., m/s n° 12, décembre 2013, page 1117
Néanmoins, diverses études ont montré que les effets cytotoxiques des cristaux conduisent à la mort cellulaire plus probablement par nécrose que par apoptose ou pyroptose [7–9]. Ces observations indiquent que beaucoup d’inconnues subsistent concernant les mécanismes responsables de la mort cellulaire induite par les cristaux. Est-elle vraiment de type nécrotique et, dans ce cas, les mécanismes impliqués sont-ils passifs (effet mécanique) ou régulés par un processus de type nécroptose ? Si tel est le cas, les molécules impliquées dans cette nécrose pourraient-elles être des cibles thérapeutiques utiles dans ces maladies ? |
Les dépôts de cristaux entraînent une mort cellulaire de type nécrotique Pour déterminer le type de mort cellulaire associé aux cristallopathies, les auteurs ont utilisé des souris de différents génotypes (souris sauvages et souris invalidées génétiquement pour Ripk3 et Mlkl) ainsi que diverses lignées cellulaires, généralement épithéliales tubulaires rénales, cultivées dans un milieu supplémenté en cristaux. Dans les deux systèmes, la formation de dépôts de cristaux a été induite par exposition in vivo ou in vitro à l’oxalate de sodium – et les lésions produites par ces cristaux évaluées. Dans un premier temps, les auteurs ont montré par des techniques de microscopie électronique et de cytométrie en flux que les cristaux entraînent une mort cellulaire indépendante des caspases, éliminant ainsi la responsabilité d’un processus d’apoptose ou de pyroptose, et suggérant un mécanisme de nécrose primaire. |
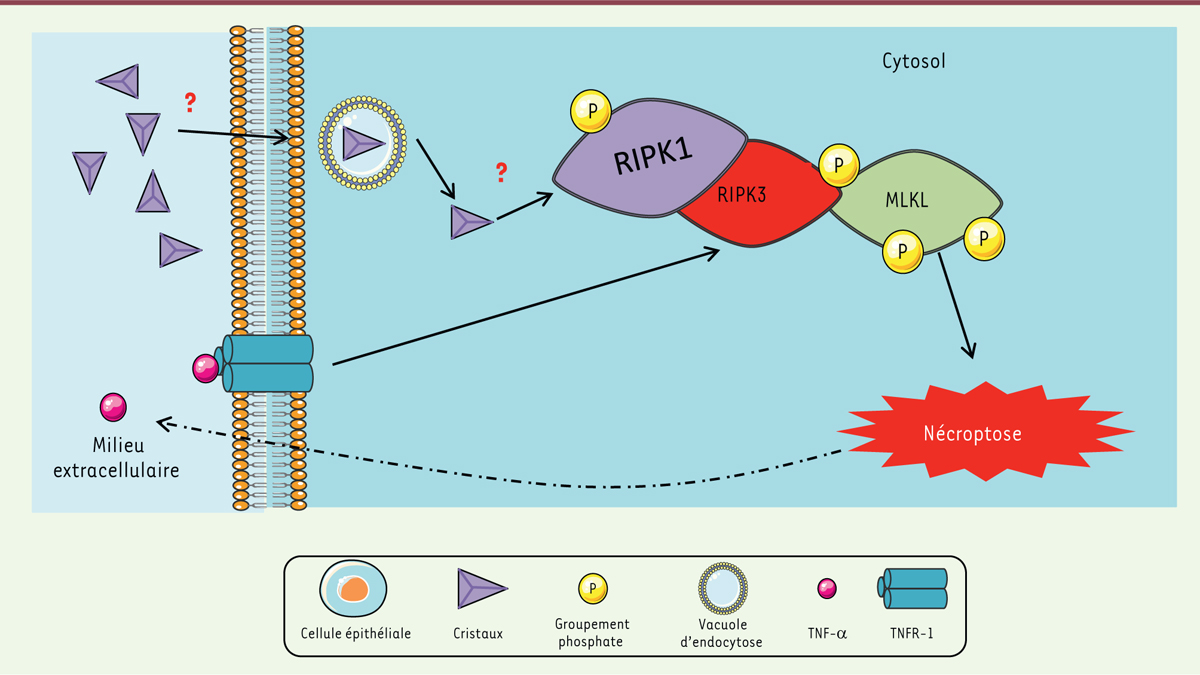
À la recherche des mécanismes responsables de la mort cellulaire À l’aide de différents siARN (small interfering RNA) in vitro et de lignées de souris génétiquement déficientes (Tnfr1-/-, Tnfr2-/-, Ripk3-/-, Mlkl-/-), les auteurs ont montré que la nécrose primaire induite par des cristaux implique la kinase RIPK3 (receptor interacting protein kinase 3) et son substrat MLKL (mixed lineage kinase domain-like). La voie de signalisation classique impliquant ces protéines commence par l’activation de la kinase RIPKI qui va favoriser l’oligomérisation et l’autoactivation de RIPK3. RIPK3 activée conduit à la phosphorylation de MLKL, une protéine capable de s’attacher à la membrane plasmique et de favoriser la libération du contenu intracellulaire (Figure 1) [10, 11].
 | Figure 1.
Les cristaux induisent une mort cellulaire dépendante de RPIK3/MLKL. Les cristaux formés lors des cristallopathies entrent dans la cellule par un mécanisme encore inconnu. Une fois dans le cytosol, les cristaux induisent une cascade de phosphorylations sur les acteurs de la voie nécroptotique dépendante de RIPK1, RIPK3 et MLKL. Une fois la voie nécroptotique engagée, la libération du contenu cellulaire (TNF-α) enclenche la voie de TNFR-1 qui, à son tour, amplifie la réponse aux cristaux et provoque les néphropathies (réalisée à l’aide des figures Servier Medical Art [http://creativecommons.org/licenses/by/3.0/fr/]). |
D’autre part, ces auteurs ont montré qu’in vitro, la nécroptose induite par les cristaux ne passe pas par un récepteur membranaire de mort comme le TNFRI (tumor necrosis factor receptor type I). En revanche, in vivo, même si la nécroptose directe induite par les cristaux ne met pas en jeu le TNFRI, cette voie est engagée via l’activité inflammatoire induite par la libération du contenu intracellulaire lors de la nécrose, et notamment via le TNF-α. Ceci renforce cette voie de signalisation, amplifiant la nécroptose et contribuant à l’apparition des néphropathies. |
Nouvelles cibles thérapeutiques, fantaisie ou réalité ? Ces découvertes ont amené les auteurs à rechercher, parmi les acteurs impliqués dans cette voie TNFRI/RIPKI/RIPK3/MLKL, ceux qui pourraient être des cibles thérapeutiques potentielles. En combinant une approche pharmacologique et différentes techniques d’analyse (RT-qPCR, immunoblot ou immunohis-tochimie), ils se sont intéressés, dans un premier temps, aux effets sur la nécroptose liée aux cristaux de l’inhibition de la signalisation cellulaire induite par le TNF-α, le TNFR1 ou RIPKI. Plusieurs inhibiteurs ont été utilisés : l’étanercept2, un inhibiteur de la liaison du TNF-α à son récepteur de surface, l’inhibiteur R-7059, impliqué dans le blocage de l’internalisation du récepteur, ou encore un inhibiteur de la kinase RIPK1, la nécrostatine-1. Cette approche pharmacologique d’inhibition, réalisée in vivo chez la souris C57BL/6N, a montré une diminution des altérations fonctionnelles et des lésions structurales rénales associées à un type de cristallopathie, la néphropathie cristalline, induite par l’oxalate de calcium. La sécrétion du TNF-α et l’activation de la cascade RIPK1-RIPK3-MLKL peuvent donc représenter des cibles thérapeutiques et être bloquées par des molécules comme l’étanercept, R-7059 ou la nécrostatine-1. |
Ces résultats sont-ils applicables aux patients ? Afin de valider chez l’homme les résultats obtenus dans un modèle murin de la pathologie humaine (néphropathie critalline), les auteurs ont analysé dans des progéniteurs rénaux humains (qui se différencient en cellules tubulaires épithéliales) les conséquences d’une cytotoxicité induite par les cristaux. Outre une cytotoxicité induite par les cristaux comparable dans les cellules humaines et murines, ils ont également observé la présence de MLKL phosphorylée dans des biopsies rénales issues de patients atteints de néphropathies liées aux dépôts d’oxalate de calcium. |
Ces études établissent que la cytotoxicité des cristaux implique une forme de mort cellulaire régulée, la nécroptose, ayant pour signature la pseudokinase MLKL. In vivo, l’activation de la voie du TNF-α lors de l’inflammation associée aux cristaux pourrait potentiellement renforcer la voie de nécroptose. Cette nécrose cellulaire est l’événement initial dans le déclenchement de l’activité nécro-inflammatoire induite par les cristaux. Le blocage de cette voie pourrait prévenir la nécrose tissulaire induite par les cristaux ainsi que les dysfonctionnements d’organes, et TNFRI, RIPK1, RIPK3 et MLKL sont des cibles thérapeutiques potentielles. Les résultats obtenus dans cette étude seront utiles aux cliniciens pour mieux définir certaines conditions pathologiques et élaborer des thérapies visant à limiter les dommages associés aux cristallopathies. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Muji A, Moll S, Saudan P. La néphropathie aiguë à oxalates, une cause d’insuffisance rénale aiguë à rechercher . Rev Med Suisse. 2015; ; 11 : :493.–498. 2.
Mulay SR, Desai J, Kumar SV, et al. Cytotoxicity of cristals involves RIPK3-MLKL- mediated necroptosis . Nat Commun. 2016; ; 7 : :10274.–10289. 3.
Mulay SR, Kulkarni OP, Rupanagudi KV, et al. Calcium oxalate crystals induce renal inflammation by NPLR-3 mediated IL-1beta secreation . J Clin Invest. 2013; ; 123 : :236.–246. 4.
Jamilloux Y, Henry T. Les inflammasomes : plates-formes de l’immunité innée . Med Sci (Paris). 2013; ; 29 : :975.–984. 5.
Hernández López JC, Inchima Urcuqui S. Activación y regulación del inflamosoma NLRP3 en las enfermedades infecciosas . Iatreia. 2012; ; 25 : :380.–390. 6.
Shao B, Xu Z, Han B, et al. C.NLRP3 inflammasome and its inhibitors: a review . Front Pharmacol. 2015; ; 6 : :262.. 7.
Cabon L, Martinez-Torres AC, Susin SA. La mort cellulaire programmée ne manque pas de vocabulaire . Med Sci (Paris). 2013; ; 29 : :1117.–1124. 8.
Schepers MS, Van Ballegooijen ES, Bangma CH, Verkoelen CF. Crystals cause acute necritic cell death in renal proximal tubule cells, but not in collecting tubule cells . Kidney Int. 2005; ; 68 : :1543.–1553. 9.
Schauer C, Janko C, Munoz LE, et al. Aggregated neutrophil extracellular traps limit inflammation by degrading cytokines and chemokines . Nat Med. 2014; ; 20 : :511.–517. 10.
Silke J, Rickard JA, Gerlic M. The diverse role of RIP kinases in necroptosis and inflammation . Nat Immunol. 2015; ; 16 : :689.–697. 11.
Newton K. RIPK1 and RIPK3: critical regulators of inflammation and cell death . Trends Cell Biol. 2015; ; 25 : :347.–353. |