| |
| Med Sci (Paris). 32(5): 458–460. doi: 10.1051/medsci/20163205011.Défaillances cardiaques d’origine mitochondriale Une question de régime ? Paule Bénit1 and Pierre Rustin1* 1Inserm UMR1141, Hôpital Robert Debré, 48, boulevard Sérurier, 75019Paris, France MeSH keywords: Animaux, Alimentation riche en graisse, Embryon de mammifère, Viabilité foetale, Régulation de l'expression des gènes au cours du développement, Prédisposition génétique à une maladie, Défaillance cardiaque, Metalloendopeptidases, Metalloproteases, Souris, Souris transgéniques, Mitochondries du myocarde, Dynamique mitochondriale, Protéines mitochondriales, Myocytes cardiaques, effets indésirables, génétique, étiologie, métabolisme, anatomopathologie |
La structure fluide du réseau mitochondrial permet d’assurer, de façon spécifique en tous points de la cellule, les nombreuses fonctions métaboliques et la production d’ATP. À tout moment, la structure de ce réseau dépend de l’équilibre entre phénomènes de fusion et de fission des mitochondries, contrôlés par une série de protéines dont on commence à découvrir l’importance dans divers processus physiologiques et pathologiques [1–4] (→).
(→) Voir les Synthèses de C. Sauvanet et al., m/s n° 10, octobre 2010, page 823 et de E. Sarzi et A. Rötig, m/s n° 2, février 2010, page 171
Il a ainsi été montré que la maturation anormale de la protéine OPA1 (optic atrophy 1, une guanosine triphosphatase de type dynamine) et la fragmentation mitochondriale qu’elle entraîne sont à l’origine d’une insuffisance cardiaque chez la souris [5]. Cette démonstration est basée sur l’utilisation de cinq modèles murins caractérisés par la délétion homozygote de l’un ou des deux (double mutant) gènes codant les protéases YME1L (i-AAA protease) et OMA1 (IM peptidase), toutes deux connues pour réguler la protéolyse de la protéine OPA1 [6]. Cette délétion conditionnelle est soit ubiquitaire, touchant tout l’organisme, soit spécifique du tissu cardiaque ou du muscle squelettique, soit encore simultanée dans ces deux tissus. |
Un rôle vital pour la protéase YME1L qui contrôle le devenir de la protéine OPA1, un facteur clé de la morphologie mitochondriale Initialement, grâce à l’utilisation d’une lignée de souris exprimant une Cre recombinase1, sous le contrôle du promoteur ubiquitaire de l’actine-β, une délétion homozygote soit d’Yme1l, soit d’Oma1, a été d’abord obtenue dans tous les tissus. Alors que les souris Oma1-/- naissent suivant les lois de Mendel, aucune souris Yme1l-/- n’est viable. De fait, dès le stade E 8,52, les embryons Ymel1-/- montrent un retard de croissance spectaculaire et présentent des battements cardiaques altérés. Aucune souris homozygote Yme1l-/- n’est obtenue au-delà d’E 13,5 soulignant le rôle vital d’YME1L. Afin d’étudier le rôle d’YME1L dans la fonction cardiaque, la délétion du gène codant la protéine a ensuite été obtenue spécifiquement dans les cardiomyocytes grâce à l’utilisation d’une lignée de souris où la Cre-recombinase n’est exprimée que dans les cardiomyocytes. Cette délétion induit une protéolyse accrue d’OPA1 par la peptidase OMA1, résultant en la fragmentation du réseau mitochondrial in vivo (Figure 1). Il en résulte une mortalité accélérée, les souris présentant une dysfonction cardiaque liée à une fraction d’éjection du ventricule gauche3 réduite due à une dilatation du ventricule dont la masse est respectée.
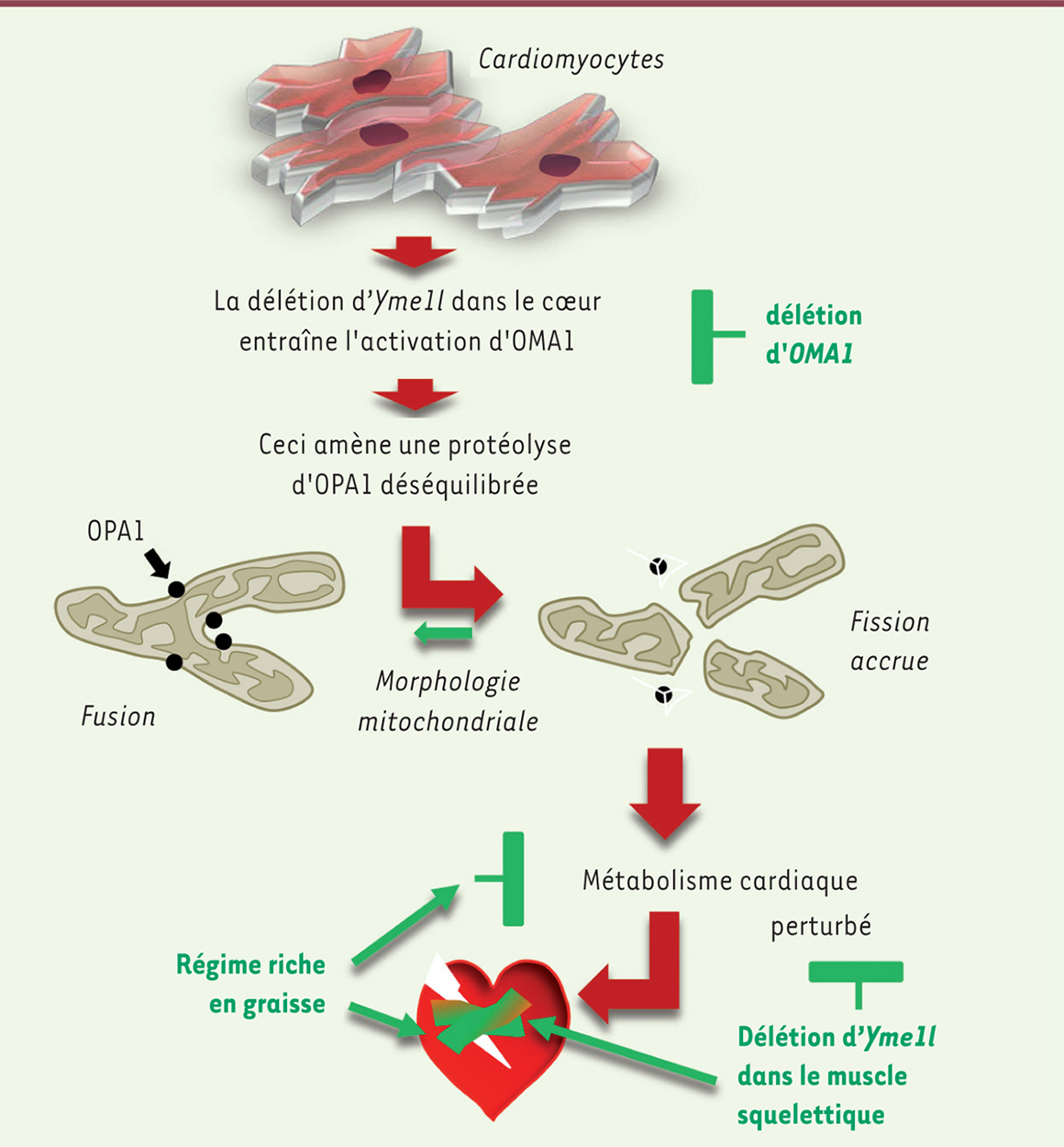
 | Figure 1.
Séquence d’événements conduisant de la délétion d’Yme1l jusqu’à la défaillance cardiaque chez la souris. La délétion du gène codant la protéase YME1L entraîne la protéolyse accélérée de la protéine OPA1 avec, pour conséquence primaire, une fission accrue du réseau mitochondrial (flèches rouges). Le métabolisme cardiaque s’en trouve perturbé, entraînant la défaillance observée chez les souris présentant une délétion d’Yme1l dans le cœur (flèches rouges). La délétion supplémentaire d’Oma1 (flèches vertes), stabilisant OPA1, corrige chez ces souris la perte d’Yme1l dans le cœur. Sans agir sur le réseau mitochondrial, une augmentation de la balance graisses/glucose fournie au cœur de ces souris permet à celui-ci d’échapper à la défaillance. Un tel changement dans la balance graisses/sucres peut être obtenu soit par une alimentation riche en graisses, soit par une délétion d’Yme1l cette fois dans le muscle (flèches vertes). YME1L : i-AAA protease ; OPA1 : optic atrophy 1 ; OMA1 : IM peptidase. |
|
Les perturbations entraînées dans le réseau mitochondrial des cardiomyocytes par la délétion d’ Ymel1 affectent profondément le métabolisme Dans les cardiomyocytes, l’absence d’YME1L entraîne une fragmentation du réseau mitochondrial qui apparaît alors ponctué. Dans ces cellules, le métabolisme est dès lors marqué par une diminution de l’oxydation des acides gras, causée par une baisse de la β-oxydation mitochondriale, comme cela est indiqué par la réduction globale des acylcarnitines4. À cela s’ajoute une augmentation simultanée de la consommation de glucose par le cœur, aboutissant au déséquilibre métabolique observé lors des défaillances cardiaques [7]. La délétion d’YME1L entraîne ainsi une altération profonde de la morphologie du réseau mitochondrial, suffisante pour affecter profondément le métabolisme cellulaire et causer une cardiomyopathie dilatée provoquant une mort précoce chez l’animal. |
La seule délétion d’ Oma1 protège des effets délétères de la délétion d’ Yme1lLa cascade délétère liée à la délétion d’Yme1l confère à la protéine OPA1 un rôle central, puisque cette dernière est déterminante pour réduire la fragmentation mitochondriale accrue par l’absence d’YME1L. La protéolyse de la protéine OPA1 étant sous la dépendance de la protéase OMA1, il a été cherché à étudier l’effet d’une double délétion d’Yme1l et d’Oma1 dans les cardiomyocytes. La délétion du second gène, Oma1, est en effet soupçonnée d’avoir la capacité de réduire les effets délétères de la délétion du premier gène, Yme1l. Un double mutant KO (knock-out), obtenu en utilisant de nouveau le système Cre-Lox affectant les deux gènes, a donc été tenté et, de façon spectaculaire, en dépit de l’absence d’YME1L, l’ablation du gène Oma1 empêche la protéolyse accrue d’OPA1 et restaure une morphologie normale du réseau mitochondrial. Dès lors, les souris montrent une fonction cardiaque associée à une résistance à l’effort qui sont toutes deux normales. Ainsi la cardiomyopathie dilatée qui résulte de la délétion d’Yme1l peut être totalement prévenue par la délétion additionnelle d’Oma1 qui bloque la protéolyse d’OPA1, restaurant ainsi une morphologie normale du réseau mitochondrial. |
Une correction génétique paradoxale, une place pour le métabolisme Il est montré par ailleurs que l’effet délétère d’une délétion du gène Yme1l peut être largement atténué par une délétion du gène… Yme1l, cela à la condition que la première délétion touche le gène normalement exprimé dans les cardiomyocytes et que la délétion « correctrice » porte sur le gène exprimé dans le muscle squelettique. Cette combinaison de délétions (obtenue par l’utilisation de lignées exprimant la recombinase Cre sous le contrôle de promoteurs tissu-spécifiques) permet d’obtenir des souris qui présentent une fonction cardiaque, ainsi qu’une durée de vie, normales. Néanmoins, ces souris présentent une altération de la fragmentation du réseau mitochondrial dans le cœur, correspondant à une protéolyse anormale d’OPA1 identique à celle que l’on observe dans les souris où la délétion d’Yme1l est réalisée dans les seuls cardiomyocytes. Il était déjà connu, par ailleurs, qu’une dysfonction mitochondriale sévère dans le muscle squelettique entraînait une perturbation majeure de la tolérance au glucose en lien avec la perturbation de la réponse du muscle squelettique à l’insuline. C’est précisément ce que l’on peut mettre en évidence : la délétion simultanée d’Yme1l induit une intolérance au glucose qui n’est pas observée lorsque la délétion d’Yme1l touche uniquement les cardiomyocytes. Ainsi, la délétion d’Yme1l semble entraîner une perturbation systémique du métabolisme du glucose. Cette conclusion est renforcée par l’observation que la délétion supplémentaire d’Oma1 (double mutant), chez les souris pour lesquelles Yme1l est délété à la fois dans le cœur et le muscle squelettique, restaure une sensibilité normale au glucose en empêchant la protéolyse d’OPA1. Une modification systémique du métabolisme du glucose liée à un dysfonctionnement mitochondrial (induit par une délétion de PGC1α5 [peroxisome proliferator-activated receptor gamma coactivator 1-alpha]) spécifiquement dans le muscle squelettique, a été montrée comme étant le résultat d’échanges entre le pancréas et le muscle squelettique qui sont modifiés sous l’action de cytokines [8]. En accord avec cette observation, il a pu être montré, dans le sérum des souris porteuses d’une délétion d’Yme1l dans le cœur et le muscle squelettique, une baisse de l’insuline libérée dans la circulation par les îlots du pancréas en réponse à un jeûne. Il apparaît ainsi que la fonction cardiaque, chez ces souris où Yme1l est délété, peut être protégée par une simple modification métabolique et ce, en dépit de la fragmentation du système mitochondrial qui est toujours observée. |
Des hamburgers ou de la tartiflette ? Pour finir, il a été montré qu’en les nourrissant par un régime riche en graisse dès 9 semaines de vie, les souris, qu’elles soient de type sauvage ou porteuses d’une délétion d’Yme1l dans les cardiomyocytes, grossissent plus que des souris recevant une nourriture équilibrée et présentent une intolérance au glucose. Des investigations plus poussées indiquent que ni l’absorption du glucose par le cœur, ni la concentration en glucose ou en acylcarnitine, ne varient dès lors que les souris sauvages et porteuses d’une délétion d’Yme1l dans les cardiomyocytes reçoivent un régime riche en graisses. De façon spectaculaire, ce régime riche en graisse protège d’une défaillance cardiaque les souris porteuses d’une délétion d’Yme1l dans les cardiomyocytes. Ces souris protégées d’une défaillance cardiaque présentent néanmoins toujours une fragmentation accrue du réseau mitochondrial indiquant que la protéolyse d’OPA1l est toujours altérée. Pour conclure, il est désormais démontré que, pour peu qu’un régime adapté soit respecté, la fonction cardiaque peut être préservée en dépit d’une structure du réseau mitochondrial anormale. Ce qui est vrai ici pour le cœur, pourrait bien se vérifier pour d’autres organes, une hypothèse qu’il reste à étudier. Ceci est particulièrement notable pour les maladies mitochondriales multiformes, devant lesquelles nous sommes actuellement totalement désarmés [9]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Friedman JR, Nunnari J. Mitochondrial form and function . Nature. 2014; ; 505 : :335.–343. 2.
Mishra P, Chan DC. Mitochondrial dynamics and inheritance during cell division, development and disease . Nat Rev Mol Cell Biol. 2014; ; 15 : :634.–646. 3.
Sauvanet C, Arnauné-Pelloquin L, David C, et al. Dynamique et morphologie mitochondriales : Acteurs, mécanismes et pertinence fonctionnelle . Med Sci (Paris). 2010; ; 26 : :823.–829. 4.
Sarzi E, Rötig A. Instabilité du génome mitochondrial et pathologies associées . Med Sci (Paris). 2010; ; 26 : :171.–176. 5.
Wai T, Garcia-Prieto J, Baker MJ, et al. Imbalanced OPA1 processing and mitochondrial fragmentation cause heart failure in mice . Science. 2015; ; 350 : :1221.–1233. 6.
Griparic L, Kanazawa T, van der Bliek AM. Regulation of the mitochondrial dynamin-like protein Opa1 by proteolytic cleavage . J Cell Biol. 2007; ; 178 : :757.–764. 7.
Yan J, Young ME, Cui L, et al. Increased glucose uptake and oxidation in mouse hearts prevent high fatty acid oxidation but cause cardiac dysfunction in diet-induced obesity . Circulation. 2009; ; 119 : :2818.–2828. 8.
Handschin C, Choi CS, Chin S, et al. Abnormal glucose homeostasis in skeletal muscle-specific PGC-1alpha knockout mice reveals skeletal muscle-pancreatic beta cell crosstalk . J Clin Invest. 2007; ; 117 : :3463.–3474. 9.
Turnbull DM, Rustin P. Genetic and biochemical intricacy shapes mitochondrial cytopathies . Neurobiol Dis. 2015 ; Feb 12. doi: 10.1016/j.nbd.2015.02.003.
|