| |
| Med Sci (Paris). 32(5): 455–458. doi: 10.1051/medsci/20163205010.Virus de l’hépatite B et chromatine Une protéine virale, HBx, interfère avec la machinerie épigénétique de la cellule Lise Rivière,1,2* Laetitia Gérossier,3 Olivier Hantz,3 and Christine Neuveut1,2** 1Unité des Hépacivirus et immunité innée, Institut Pasteur, 28, rue du Docteur Roux, 75015Paris, France 2UMR CNRS 3569, 28, rue du Docteur Roux, 75015Paris, France 3Inserm U1052, CNRS UMR5, Centre de recherche en cancérologie de Lyon, université de Lyon, F-69000Lyon, France MeSH keywords: Assemblage et désassemblage de la chromatine, Protéines chromosomiques nonhistones, Épigenèse génétique, Hépatite B, Virus de l'hépatite B, Histone-lysine N-methyltransferase, Histone, Humains, Protein Methyltransferases, Interférence par ARN, Transduction du signal, Transactivateurs, génétique, physiologie, métabolisme |
L’ADNccc du virus de l’hépatite B : une forme virale résistante aux traitements Dans le monde, environ 300 000 personnes sont chroniquement infectées par le virus de l’hépatite B (VHB) et encourent un risque élevé de développer un carcinome hépatocellulaire [1]. Les traitements antiviraux existant contrôlent efficacement la réplication virale sans toutefois éliminer l’ADN viral nucléaire qui reste présent au sein des cellules infectées. Cet ADN, appelé « ADN circulaire covalemment clos » (ADNccc), est à l’origine de l’expression des gènes viraux et de la production de virus. Ces traitements doivent donc être pris à vie afin d’éviter toute réactivation virale. Le développement de nouveaux traitements visant notamment à éliminer l’ADNccc ou contrôler sa transcription nécessite donc de comprendre les mécanismes qui contrôlent l’expression et le maintien de cet ADNccc. Les particules du VHB contiennent un génome d’ADN circulaire partiellement double brin (ADN-RC). Au cours de l’infection, le génome, transporté jusqu’au noyau, est converti en ADNccc après action de la machinerie cellulaire (ou de protéines cellulaires). L’ADNccc sert alors de matrice pour la transcription des ARN viraux, dont l’ARN prégénomique qui est encapsidé au niveau du cytoplasme de la cellule infectée et rétrotranscrit en ADN-RC. L’ADNccc n’est pas intégré dans l’ADN cellulaire. Cependant, à l’instar de celui-ci, il est organisé sous forme de chromatine et exploite des mécanismes cellulaires pour réguler sa transcription (Figure 1).
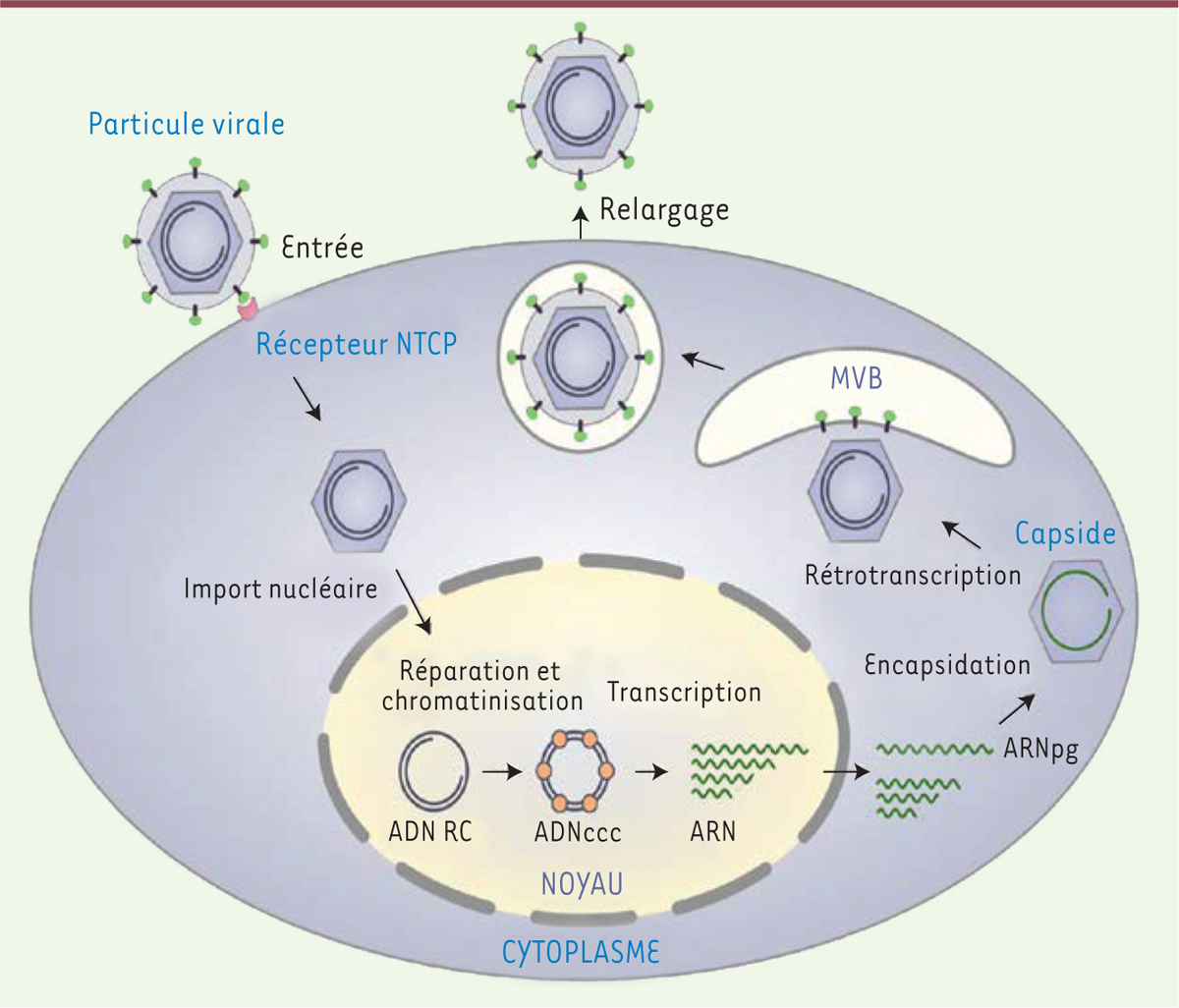
 | Figure 1.
Cycle de réplication du VHB. La particule virale contenant l’ADN viral partiellement double brin (ADN-RC) entre dans la cellule suite à son interaction avec le récepteur : le sodium-taurocholate cotransporting polypeptide (NTCP). La capside contenant le génome viral est ensuite importée dans le noyau où l’ADN viral est libéré. L’ADN-RC est alors réparé par des facteurs cellulaires et converti en ADNccc. L’ADNccc s’associe avec des protéines cellulaires histones en une structure chromatinienne. Il est alors transcrit en ARN, permettant la production des protéines virales. L’ARN prégénomique est encapsidé dans les capsides néosynthétisées et rétrotranscrit en ADN-RC. Après acquisition d’une enveloppe au niveau des corps multivésiculaires (MVB), les nouvelles particules virales sont relarguées de la cellule par exocytose. ADN-RC : ADN relâché circulaire ; ADNccc : ADN circulaire covalemment clos ; ARNpg : ARN prégénomique. |
|
La transcription virale, comme celle des gènes cellulaires, est régulée par des mécanismes de remodelage de la chromatine L’organisation de l’ADN sous forme de chromatine le rend moins accessible aux facteurs de transcription. L’activation de la transcription des gènes dépend donc de mécanismes permettant d’augmenter l’accessibilité de l’ADN aux facteurs soit en déplaçant les nucléosomes sur l’ADN, soit en réduisant les forces permettant son association aux histones via la modification post-traductionnelle (MPT) de ces dernières (Tableau I). Ces modifications reposent sur des enzymes cellulaires dont les histone acétyltransférases (HAT) et les histone méthyltransférases (HMT) qui sont respectivement responsables de l’acétylation et de la méthylation des histones, et les histone déacétylases (HDAC) et histone déméthylases (HDM) qui effacent ces marques.
Tableau I.
| Type d’histone |
Acide aminé modifié |
Modification |
Abréviation |
Conséquence |
| H3 |
lysines 4, 9, 14, 18 |
acétylation |
H3ac |
activation de la transcription |
|
| H4 |
lysines 5, 8, 12, 16 |
acétylation |
H4ac |
activation de la transcription |
|
| H3 |
lysine 4 |
méthylation |
H3K4me |
activation de la transcription |
|
| H3 |
lysine 9 |
méthylation |
H3K9me |
inhibe la transcription |
|
| H3 |
lysine 27 |
méthylation |
H3K27me |
inhibe la transcription |
Principales modifications post-traductionnelles (MPT) de type acétylation et méthylation des histones et leurs conséquences sur la transcription.
|
La transcription de l’ADNccc semble également régulée par des modifications post-traductionnelles touchant les histones. En effet, chez des patients chroniquement infectés par le VHB, une corrélation est observée entre virémie et niveau d’acétylation des histones qui sont associées à l’ADNccc [2]. L’activation de la transcription de l’ADNccc est aussi contrôlée par les HAT CBP (CREB binding protein)/P300 et par l’acétylation des histones H3 et H4. Une étude récente a de plus cartographié les modifications des histones associées à l’ADNccc. Elle montre l’existence d’une corrélation entre ces MPT activatrices et l’activité transcriptionnelle des promoteurs du virus [2–5]. |
La protéine régulatrice virale HBx : une petite protéine, pilier indispensable de la transcription virale in vivoLa protéine virale régulatrice HBx est essentielle à la réplication virale. Elle agit principalement en activant la transcription du VHB. Ainsi, son rôle dans la régulation de la chromatine de l’ADNccc a été suggéré. Le recrutement d’HBx sur l’ADNccc est en effet corrélé avec celui des HAT CBP/P300 et du facteur PCAF (P300/CBP-associated factor), ainsi qu’avec l’acétylation des histones et l’activation transcriptionnelle du VHB [3]. Nous avons montré qu’HBx interagit avec des facteurs cellulaires qui sont impliqués dans la régulation de la transcription et de la chromatine dont elle modifie l’activité. C’est le cas de CBP/P300, de PRMT1 (protein arginine N-methyltransferase 1) ou du complexe HDAC1 (histone deacetylase 1)/PP1 (protein phosphatase 1) [4, 6, 7]. Cependant l’absence de modèles cellulaires permissifs à l’infection a longtemps retardé l’étude du rôle d’HBx dans la régulation épigénétique dans le contexte de l’infection. |
Rôle d’HBx dans le contexte de l’infection par le VHB : HBx contrecarre la répression transcriptionnelle de l’ADNccc médiée par la voie SETDB1/HP1/H3K9me3 L’étude que nous avons réalisée portait sur le rôle d’HBx dans la transcription de l’ADNccc dans le contexte de l’infection par le virus. Des hépatocytes humains primaires ainsi qu’une lignée cellulaire permissive à l’infection par le VHB (les cellules HepaRG1 différenciées) ont été utilisés. Nous avons suivi la réplication et la transcription virales après infection de ces cellules soit par un virus sauvage (VHB wt), soit par un virus déficient pour l’expression d’HBx (VHB X-). Les résultats que nous avons obtenus ont permis de confirmer que la transcription du virus VHB était réprimée en l’absence d’HBx. Afin de comprendre les mécanismes impliqués dans la transcription des gènes de VHB, nous avons étudié la structure de l’ADNccc formé après infection des cellules par le VHB wt ou le virus muté VHB X-. En évaluant la sensibilité de l’ADNccc à la digestion par la nucléase micrococcale, nous avons pu montrer que l’ADNccc du VHB X- était plus résistant à la digestion que l’ADNccc du VHB wt. Ceci suggérait que l’ADNccc du virus VHB X- présentait une structure plus compacte, et donc moins accessible à la machinerie de transcription que celui du virus sauvage, un résultat pouvant expliquer, en partie, sa faible transcription. Différents mécanismes interviennent dans la modulation de la chromatine dont les MPT des histones. Par immunoprécipitation de la chromatine, associée à des PCR quantitatives, nous avons montré que les histones, associées à l’ADNccc du VHB wt, présentaient des modifications activatrices (H3ac, H3K4me3). En revanche, sur l’ADNccc du virus muté VHB X-, nous avons observé un enrichissement en modifications répressives, notamment H3K9me2 et H3K9me3. Ces modifications, notamment retrouvées au niveau de l’hétérochromatine, permettent le recrutement des protéines cellulaires HP1 (heterochromatin protein 1), qui amplifient la répression transcriptionnelle. Nous avons observé que les 3 isoformes de ces protéines (HP1α, γ et β) étaient recrutées de façon plus importante sur l’ADNccc du VHB X-. L’enzyme cellulaire responsable de la méthylation répressive H3K9me3 de l’ADNccc du VHB X- a été déterminée après extinction, par la technique d’ARN interférence, de l’expression de chacune des trois HMT cellulaires susceptibles d’induire une telle modification : suv39H1, suv39H2 et SETDB1. Nos résultats montrent que seule la déplétion de SETDB1 réduit significativement la méthylation H3K9me3 et permet de restaurer partiellement la transcription du VHB X-, suggérant ainsi que SETDB1 est impliquée dans la répression transcriptionnelle du virus muté. Ayant montré qu’HBx pouvait interférer avec la mise en place de la répression transcriptionnelle de l’ADNccc, sa capacité à contrecarrer cette répression une fois qu’elle a été établie, a ensuite été examinée. Sept jours après leur infection par le VHB X-, les cellules infectées ont donc été transduites avec un vecteur lentiviral contenant le gène codant HBx. Les résultats montrent qu’HBx restaure la transcription du VHB X- et que cette transcription est corrélée à une diminution des marques répressives H3K9me3 et du recrutement d’HP1, et à une augmentation des marques activatrices. |
Nos connaissances sur la biologie de l’ADNccc sont encore très limitées en raison de l’absence durant des décennies de modèles permissifs à l’infection par le VHB et la formation de l’ADNccc. Nos travaux ont permis de montrer que, dans le contexte de l’infection, HBx est nécessaire à la transcription de l’ADNccc. Il permet l’établissement d’une chromatine transcriptionnellement active (Figure 2) [8]. Des travaux récents suggèrent que HBx interfère avec la réponse cellulaire antivirale qui réprime la transcription virale [9, 10]. Nos résultats permettent de mieux comprendre les mécanismes de cette répression. Ils suggèrent qu’elle est mise en place, en partie, via l’établissement d’une chromatine réprimée reposant sur des mécanismes associant SETDB1/HP1/H3K9me3. De nombreuses questions restent cependant à résoudre : quels sont les mécanismes cellulaires impliqués dans la reconnaissance de l’ADNccc ? Par quel mécanisme SETDB1 est-elle recrutée sur l’ADNccc et inhibée en présence d’HBx ; HBx cible-t-elle directement SETDB1, ou un de ses partenaires, ou agit-elle sur des facteurs situés plus en amont et responsables de la détection de l’ADN viral et de sa répression transcriptionnelle ?
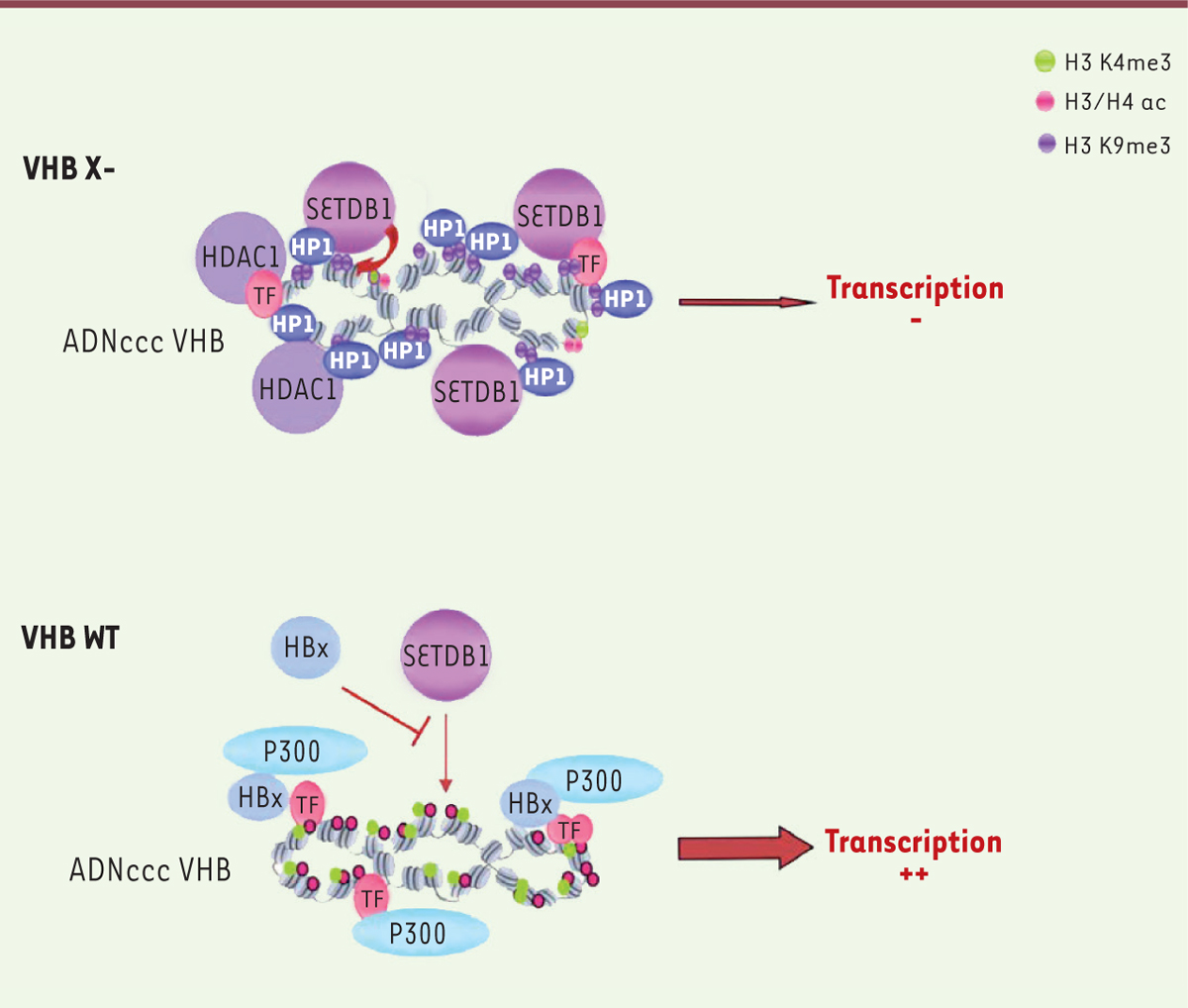
 | Figure 2.
HBx contrecarre la répression transcriptionnelle de l’ADNccc médiée par la voie SETDB1/HP1/H3K9me3. En l’absence d’HBx (VHB X-), la transcription du virus est réprimée via la déacétylation des histones, la mise en place des marques répressives H3K9me3 par SETDB1 et le recrutement des facteurs répresseurs HP1. L’expression d’HBx contrecarre l’activité de SETDB1 inhibant le positionnement des marques répressives H3K9me3 et permettant l’établissement de marques activatrices de la transcription comme l’acétylation des histones et la mise en place des marques H3K4me3, aboutissant ainsi à une forte transcription virale. ADNccc : ADN circulaire covalemment clos ; HBx : protéine X du virus de l’hépatite B ; SETDB1 : SET domain, bifurcated 1 ; HP1 : heterochromatin protein 1 ; H3K9me3, H3K4me3 : histone 3 triméthylée au niveau de la lysine 9 ou 4 respectivement ; H3/H4 ac : histones H3/H4 acétylées ; HDAC1 : histone déacétylase 1 ; TF : facteur de transcription ; VHB WT : virus de l’hépatite B sauvage. |
|
Footnotes |
1.
Buendia MA, Neuveut C. Hepatocellular carcinoma . Cold Spring Harb Perspect Med. 2015; ; 5 : :a021444.. 2.
Pollicino T, Belloni L, Raffa G, et al. Hepatitis B virus replication is regulated by the acetylation status of hepatitis B virus cccDNA-bound H3 and H4 histones . Gastroenterology. 2006; ; 130 : :823.–837. 3.
Belloni L, Pollicino T, De Nicola F, et al. Nuclear HBx binds the HBV minichromosome and modifies the epigenetic regulation of cccDNA function . Proc Natl Acad Sci USA. 2009; ; 106 : :19975.–19979. 4.
Cougot D, Wu Y, Cairo S, et al. The hepatitis B virus X protein functionally interacts with CREB-binding protein/p300 in the regulation of CREB-mediated transcription . J Biol Chem. 2007; ; 282 : :4277.–4287. 5.
Tropberger P, Mercier A, Robinson M, et al. Mapping of histone modifications in episomal HBV cccDNA uncovers an unusual chromatin organization amenable to epigenetic manipulation . Proc Natl Acad Sci USA. 2015; ; 112 : :E5715.–E5724. 6.
Benhenda S, Ducroux A, Riviere L, et al. The PRMT1 methyltransferase is a binding partner of HBx and a negative regulator of hepatitis B virus transcription . J Virol. 2013; ; 87 : :4360.–4371. 7.
Cougot D, Allemand E, Riviere L, et al. Inhibition of PP1 Phosphatase Activity by HBx: A Mechanism for the Activation of Hepatitis B Virus Transcription . Sci Signal. 2012; ; 5 : :ra1.. 8.
Riviere L, Gerossier L, Ducroux A, et al. HBx relieves chromatin-mediated transcriptional repression of hepatitis B viral cccDNA involving SETDB1 histone methyltransferase . J Hepatol. 2015; ; 63 : :1093.–1102. 9.
Lucifora J, Arzberger S, Durantel D, et al. Hepatitis B virus X protein is essential to initiate and maintain virus replication after infection . J Hepatol. 2011; ; 55 : :996.–1003. 10.
Van Breugel PC, Robert EI, Mueller H, et al. Hepatitis B virus X protein stimulates gene expression selectively from extrachromosomal DNA templates . Hepatology. 2012; ; 56 : :2116.–2124. |