| |
| Med Sci (Paris). 32(5): 452–455. doi: 10.1051/medsci/20163205009.Le récepteur neural des œstrogènes bêta Un nouvel acteur dans la maturation pubertaire femelle Lydie Naulé1,2,3* and Sakina Mhaouty-Kodja1,2,3** 1Neuroscience Paris Seine, Inserm, UMR S1130, Université Pierre et Marie Curie, 7, quai Saint-Bernard, 75005Paris, France 2CNRS, UMR 8246, Université Pierre et Marie Curie, Paris, France 3Sorbonne Universités, Université Pierre et Marie Curie UM CR18, universitéParis 06, France MeSH keywords: Animaux, Oestradiol, Récepteur bêta des oestrogènes, Femelle, Humains, Hypothalamus, Mâle, Souris, Souris transgéniques, Neurones, Puberté, Maturation sexuelle, pharmacologie, physiologie, métabolisme, effets des médicaments et substances chimiques, génétique |
La puberté est une période critique du développement qui permet la transition entre l’enfance et l’adolescence. Elle se caractérise par l’augmentation des niveaux d’hormones gonadiques, l’apparition des caractères sexuels secondaires et l’acquisition de la capacité à se reproduire. Le déclenchement de la puberté est régulé par de nombreux facteurs. Des études épidémiologiques ont montré que 50 à 80 % des variations de l’âge de la puberté sont déterminés par des facteurs génétiques [1]. Il est également établi que des facteurs environnementaux, comme les conditions socio-économiques, la nutrition, le stress, ou encore l’exposition à des perturbateurs endocriniens, jouent un rôle important dans le déclenchement de la puberté [2]. Aujourd’hui, l’observation d’une avancée progressive de l’âge de la puberté chez les filles à travers le monde, soulève une forte inquiétude. Les causes de cette avancée ne sont pas clairement établies mais l’augmentation de l’obésité infantile et l’exposition grandissante à des polluants environnementaux y contribueraient fortement. Du fait des effets délétères que peut avoir une perturbation de l’âge de la puberté sur les fonctions de reproduction, mais également sur d’autres fonctions physiologiques comme les fonctions cardiovasculaires, métaboliques, ou encore psychologiques, il est devenu essentiel de comprendre les mécanismes mis en jeu dans le déclenchement de la puberté. |
L’œstradiol : un rôle clé dans la mise en place de la puberté Chez les mammifères, la maturation pubertaire est déclenchée par l’activation de l’axe hypothalamo-hypophysaire-gonadique qui contrôle la reproduction. La libération pulsatile de la GnRH (gonadotropin releasing hormone) par les neurones hypothalamiques à GnRH [12] (→)dans le système porte hypothalamo-hypophysaire active la sécrétion des gonadotrophines LH (hormone lutéinisante) et FSH (hormone folliculo-stimulante) par l’hypophyse antérieure. La LH et la FSH vont à leur tour stimuler les gonades et induire la gamétogénèse ainsi que la sécrétion des hormones stéroïdes gonadiques (œstradiol et progestérone principalement chez la femme). Les hormones stéroïdes sexuelles exercent, en retour, un rétrocontrôle sur cet axe au niveau hypothalamique et hypophysaire.
(→) Voir la Nouvelle de S. Catteau-Jonard et al., page 441 de ce numéro
L’activation des neurones à GnRH, qui déclenche la puberté, est régulée par l’ensemble du réseau de neurones et de cellules gliales qui leur sont anatomiquement et fonctionnellement liés. Les changements neuraux mettent en jeu non seulement l’activation de facteurs excitateurs, dont les principaux sont le glutamate et la kisspeptine (Figure 1), mais également une diminution des facteurs inhibiteurs prépubertaires qui dépendraient des neurones GABAergiques et des peptides opioïdes. Chez la femelle, il a été montré que certains de ces facteurs sont sous le contrôle de l’œstradiol au moment de la puberté. La plus documentée de ces régulations est celle de la kisspeptine dont l’expression dans les neurones de l’hypothalamus augmente pendant la période prépubertaire [3]. Néanmoins, les mécanismes moléculaires mis en jeu dans cette régulation sont encore mal connus.
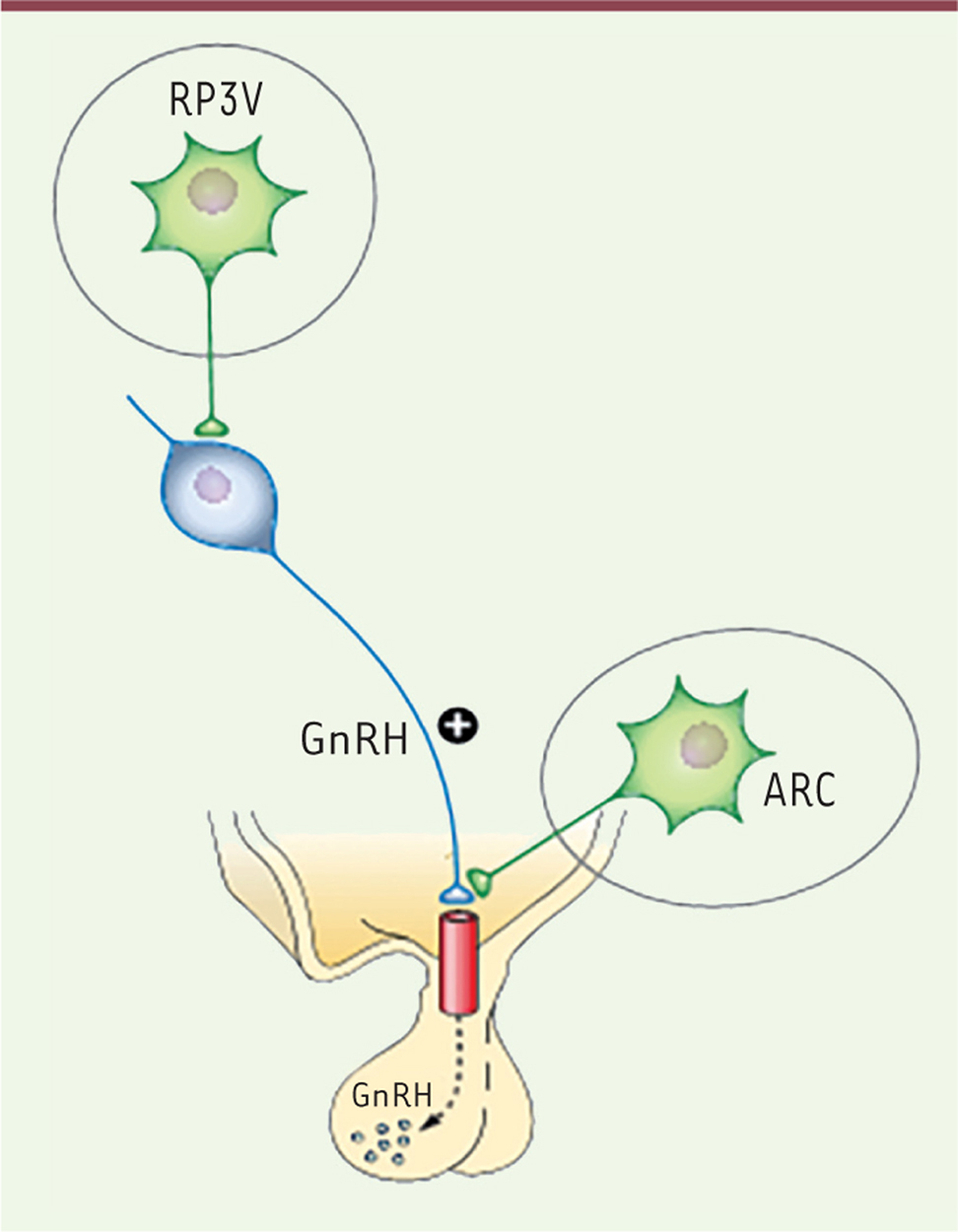
 | Figure 1.
Populations de neurones à kisspeptine dans l’hypothalamus. Les neurones à kisspeptine (en vert) projettent sur les neurones à GnRH (en bleu) et sont localisés dans deux régions hypothalamiques : le noyau rostral périventriculaire du troisième ventricule (RP3V) et le noyau arqué (ARC). La libération de la kisspeptine, qui se lie à son récepteur localisé à la surface des neurones à GnRH, stimule la libération de GnRH, qui va alors agir au niveau hypophysaire. Le noyau RP3V contient plus de neurones à kisspeptine chez la femelle en comparaison avec le mâle. Il est impliqué dans la décharge ovulante de LH. GnRH : gonadotropin releasing hormone ; LH : hormone lutéinisante. |
L’œstradiol exerce la majorité de ces effets biologiques via les récepteurs des œstrogènes ER[estrogen receptor]α [4] (→) et ERβ. Ces deux facteurs de transcription, codés par des gènes différents, sont présents dans les ovaires, l’hypophyse et l’hypothalamus. Au niveau hypothalamique, ils ont été détectés dans les principales régions impliquées dans le contrôle de la reproduction et semblent exprimés dans les cellules neuronales et gliales (neurales). Des analyses des variants polymorphes humains des gènes ERα et ERβ suggèrent que la présence de certains variants est corrélée avec une élévation de l’âge de la puberté, et que des polymorphismes combinés de ces deux gènes pourraient influencer encore plus l’âge de l’apparition des premières règles chez les filles [5, 6]. Chez la souris, l’invalidation sélective de l’ERα dans les neurones à kisspeptine entraîne un arrêt de la maturation pubertaire conduisant à une infertilité [7]. Ces données indiquent un rôle important de la voie de signalisation de l’ERα dans la régulation de la mise en place de la puberté par l’œstradiol. Dans ce contexte, le rôle de l’ERβ dans le système nerveux restait à clarifier.
(→) Voir la Synthèse de M. Adlanmerini et al., m/s n° 12, décembre 2015, page 1083
|
L’ERβ : un nouveau facteur activateur du déclenchement pubertaire Afin de répondre à cette question, notre équipe a généré une lignée de souris invalidée pour l’ERβ uniquement dans le système nerveux, sans interférer avec ses fonctions périphériques. Pour cela, des femelles portant des sites loxP1 en amont et en aval de l’exon 3 du gène ERβ [8] ont été croisées avec des mâles portant la recombinase Cre sous le contrôle du promoteur et de l’activateur neural du gène de la nestine, permettant ainsi l’invalidation d’ERβ dans les précurseurs des cellules gliales et neuronales. Les femelles mutantes (ERβNescre) adultes ainsi obtenues sont fertiles et présentent une cyclicité ovarienne normale. Cependant, l’analyse des principaux marqueurs de la puberté chez les rongeurs, comme l’ouverture vaginale, l’apparition du premier œstrus et la croissance utérine, révèle un important retard pubertaire chez les femelles mutantes [9]. Ce phénotype n’est pas associé à des modifications du poids corporel de ces femelles, écartant ainsi une cause métabolique potentielle dans le retard observé. Afin de mettre en évidence les mécanismes moléculaires conduisant à ce retard pubertaire, nous nous sommes focalisés sur l’analyse du système kisspeptine. Chez les rongeurs, la kisspeptine est exprimée dans deux principales régions de l’hypothalamus, la région rostrale périventriculaire du troisième ventricule (RP3V) localisée dans l’aire préoptique et le noyau arqué. Dans les neurones du RP3V, l’expression de la kisspeptine augmente de façon importante pendant la période prépubertaire sous le contrôle de l’œstradiol. Chez les femelles mutantes, on observe une diminution significative des niveaux d’ARNm et de la protéine kisspeptine dans le RP3V pendant la période prépubertaire. Dans le noyau arqué, une région également impliquée dans le contrôle du déclenchement pubertaire, aucune modification des niveaux d’ARNm, ni de la protéine kisspeptine n’a été observée chez ces souris. Ces données indiquent donc que l’ERβ neural est impliqué dans la régulation par l’œstradiol de l’expression prépubertaire de la kisspeptine dans le RP3V, processus nécessaire au déclenchement de la puberté. |
Déclenchement de la puberté : relation de Yin Yang entre ERα et ERβ ? Les récepteurs ERα et ERβ présentent des spécificités différentes en termes de liaison au ligand et d’activité transcriptionnelle puisqu’ils semblent agir de manière opposée dans la régulation de gènes cibles dans plusieurs modèles in vitro et in vivo [10, 11]. De manière intéressante, la délétion de l’ERα dans les cellules à kisspeptine résulte en une avancée de l’âge de la puberté chez la souris [7]. Nous avons donc cherché à déterminer si la délétion de l’ERβ central affectait l’expression de l’ERα, entraînant ainsi le retard pubertaire observé. Nos résultats ne montrent aucune modification des niveaux d’ARNm et de la protéine ERα dans l’aire préoptique des souris mutantes invalidées pour l’ERβ dans le système nerveux (ERβNescre). La diminution de l’expression prépubertaire de la kisspeptine et le retard pubertaire observés chez les souris ERβNescre ne sont donc pas causés par un changement de l’expression de l’ERα. Des modifications de la voie de signalisation de l’ERα chez ces souris ne peuvent, néanmoins, être exclues. Au vu de notre travail et des découvertes antérieures, nous proposons un mode d’action de l’œstradiol au moment de la puberté. Notre hypothèse est que l’œstradiol exercerait tout d’abord, via la voie de signalisation de l’ERα, une action inhibitrice sur l’expression et l’activité neuronale des neurones à kisspeptine hypothalamiques pendant la période postnatale. Par la suite, en raison de l’augmentation de production ovarienne d’œstradiol et/ou de l’expression de l’ERβ pendant la période prépubertaire, cette voie de signalisation entrerait en jeu et activerait l’expression de la kisspeptine dans le RP3V. Cette activation serait accompagnée, comme cela a été montré auparavant, par une atténuation du frein inhibiteur exercé par l’ERα et d’autres facteurs neuronaux et gliaux. La stimulation des voies activatrices et la diminution du frein inhibiteur entraîneraient alors le déclenchement pubertaire (Figure 2).
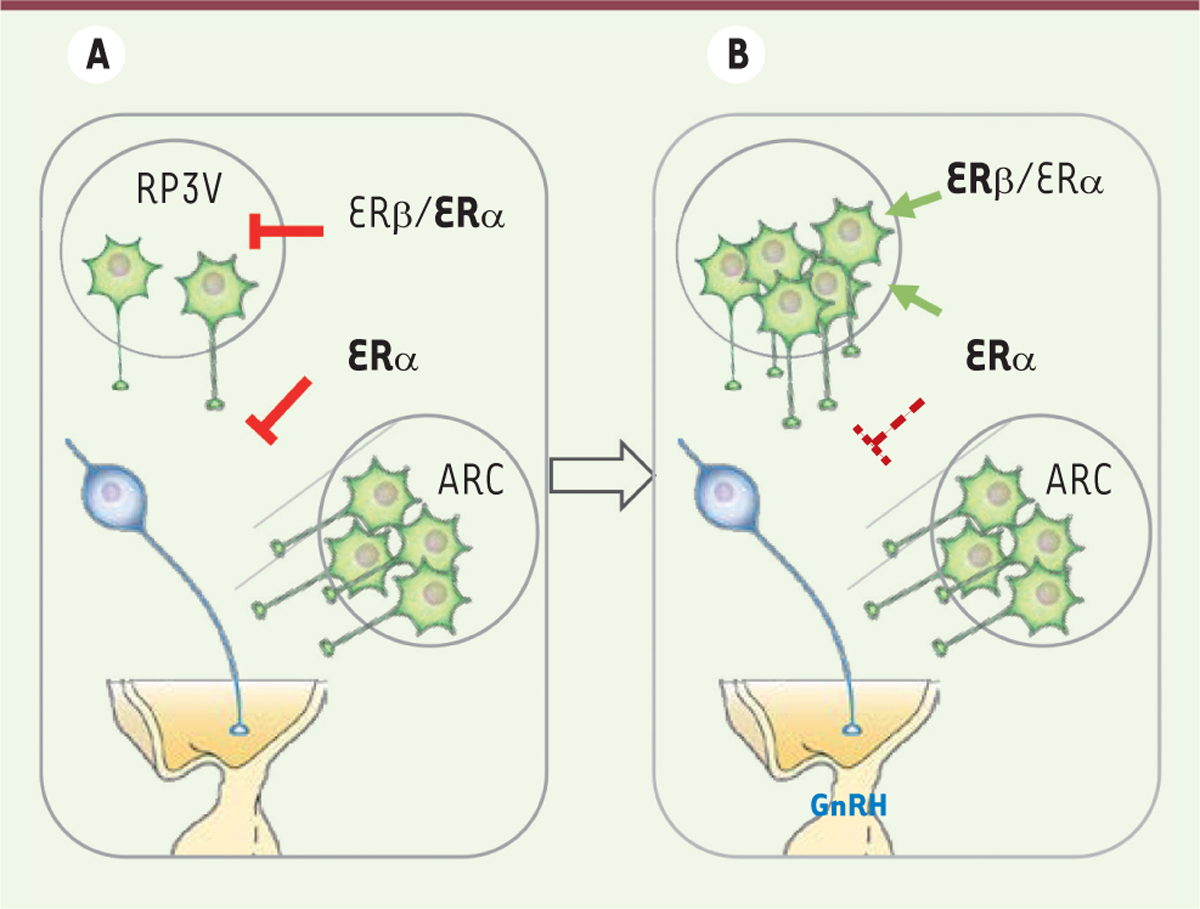
 | Figure 2.
Rôle potentiel de l’ERβ dans la maturation pubertaire induite par l’oestradiol. A. Pendant la période postnatale, l’œstradiol inhiberait via l’ERα l’expression du gène Kiss1 codant la kisspeptine dans le noyau rostral périventriculaire du troisième ventricule (RP3V) et l’activité des neurones à kisspeptine dans le noyau arqué (ARC) (traits rouges pleins). B. L’émergence de la voie de signalisation ERβ pendant la période prépubère s’opposerait à ces effets inhibiteurs en augmentant l’expression Kiss1 dans le noyau RP3V (flèches vertes). Une phase de stimulation suivrait, renforçant ou potentialisant l’expression de kisspeptine dans le RP3V et diminuant la sensibilité à l’inhibition induite par l’ERα (traits hachurés rouges), entraînant ainsi la libération de GnRH. Les neurones à kisspeptine et à GnRH sont illustrés, respectivement, en vert et en bleu. ER : estrogen receptor ; GnRH : gonadotropin releasing hormone.
|
En conclusion, l’ensemble de ces résultats révèle pour la première fois que l’ERβ neural est impliqué dans la régulation de la mise en place de la puberté par l’œstradiol. Une meilleure compréhension des mécanismes physiologiques mis en jeu au moment de la puberté est essentielle de nos jours. Cela permettrait, d’une part, de mieux cerner les causes des anomalies d’apparition de la puberté observées chez la fille, et d’autre part, de prédire les effets potentiels de l’exposition à certains perturbateurs endocriniens à activité oestrogénique ou anti-œstrogénique. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Palmert MR, Boepple PA. Variation in the timing of puberty: clinical spectrum and genetic investigation . J Clin Endocrinol Metab. 2001; ; 86 : :2364.–2368. 2.
Parent AS, Franssen D, Fudvoye J, et al. Developmental variations in environmental influences including endocrine disruptors on pubertal timing and neuroendocrine control: Revision of human observations and mechanistic insight from rodents . Front Neuroendocrinol. 2015; ; 38 : :12.–36. 3.
Franceschini I, Desroziers E. Development and aging of the kisspeptin-GPR54 system in the mammalian brain: What are the impacts on female reproductive function? . Front Endocrinol (Lausanne). 2013; ; 4 : :22.. 4.
Adlanmerini M, Fabre A, Boudou F, et al. Effets membranaires du récepteur alpha des œstrogènes : une question de spécificité tissulaire . Med Sci (Paris). 2015; ; 31 : :1083.–1091. 5.
Stavrou I, Zois C, Chatzikyriakidou A, et al. Combined estrogen receptor alpha and estrogen receptor beta genotypes influence the age of menarche . Hum Reprod. 2006; ; 21 : :554.–557. 6.
Mendoza N, Morón FJ, Quereda F, et al. A digenic combination of polymorphisms within ESR1 and ESR2 genes are associated with age at menarche in the Spanish population . Reprod Sci. 2008; ; 15 : :305.–311. 7.
Mayer C, Acosta-Martinez M, Dubois SL, et al. Timing and completion of puberty in female mice depend on estrogen receptor alpha-signaling in kisspeptin neurons . Proc Natl Acad Sci USA. 2010; ; 107 : :22693.–22698. 8.
Antal MC, Krust A, Chambon P, Mark M. Sterility and absence of histopathological defects in nonreproductive organs of a mouse ERbeta-null mutant . Proc Natl Acad Sci USA. 2008; ; 105 : :2433.–2438. 9.
Naulé L, Robert Parmentier C, et al. Delayed pubertal onset and pre-pubertal Kiss1 expression in female mice lacking central estrogen receptor beta . Hum Mol Genet. 2015; ; 24 : :7326.–7338. 10.
Paech K, Webb P, Kuiper GG, et al. Differential ligand activation of estrogen receptors ERalpha and ERbeta at AP1 sites . Science. 1997; ; 277 : :1508.–1510. 11.
Gonzales KL, Tetel MJ, Wagner CK. Estrogen receptor (ER) beta modulates ERalpha responses to estrogens in the developing rat ventromedial nucleus of the hypothalamus . Endocrinology. 2008; ; 149 : :4615.–4621. 12.
Catteau-Jonard S, Dewailly D, Prévot V, et al. L’hormone anti-müllerienne : une hormone ovarienne exerçant une rétroaction hypothalamique ? . Med Sci (Paris). 2016; ; 32 : :441.–444. |