| |
| Med Sci (Paris). 32(5): 444–447. doi: 10.1051/medsci/20163205006.Mesure simultanée des dynamiques neuronale et vasculaire chez l’animal mobile Lim-Anna Sieu,1,2 Antoine Bergel,1,3 Elodie Tiran,2 Thomas Deffieux,2 Mathieu Pernot,2 Jean-Luc Gennisson,2 Mickaël Tanter,2 and Ivan Cohen1* 1Inserm U1130, CNRS UMR8246, université Pierre et Marie Curie UMCR18, 9, quai Saint-Bernard, 75005Paris, France 2Institut Langevin, ESPCI ParisTech, PSL Research university, CNRS UMR7587, Inserm U979, Paris, France 3Université Paris Diderot, Sorbonne Paris Cité, école doctorale Frontières du Vivant (FdV), Programme Bettencourt, Paris, France MeSH keywords: Potentiels d'action, Animaux, Animaux de laboratoire, Encéphale, Cartographie cérébrale, Angiographie cérébrale, Circulation cérébrovasculaire, Électroencéphalographie, Épilepsie, Activité motrice, Imagerie multimodale, Conduction nerveuse, Rats, physiologie, vascularisation, physiopathologie, méthodes, diagnostic |
La communauté scientifique prend progressivement conscience de l’importance d’aborder les questions de neurophysiologie par le biais d’approches globales qui puissent capturer de façon concomitante le traitement neuronal de l’information et les activités métaboliques du tissu nerveux. Les mécanismes fondamentaux impliqués dans le fonctionnement dynamique des réseaux neuronaux et leurs dysfonctionnements pathologiques ne peuvent être déchiffrés que par leur intégration dans un contexte plus global : celui du codage de l’information par les neurones et de la bioénergétique des tissus reposant sur l’irrigation vasculaire [1]. En fait, les multiples rétroactions entre les activités électriques et métaboliques représentent la règle plutôt que l’exception. Jusqu’à récemment, ces deux facettes du fonctionnement cérébral n’ont été abordées séparément que par manque de méthode appropriée pour accéder à une vision globale. Ceci a donc motivé le développement de stratégies expérimentales mesurant simultanément ces différents paramètres dans des conditions naturelles. |
Équilibre et déséquilibres neuro-métaboliques Afin d’explorer le cerveau sain, il est possible d’utiliser des techniques d’imagerie cérébrale mesurant le métabolisme et identifiant ainsi, de façon non invasive, les aires cérébrales activées par la réalisation d’une tâche cognitive. Ces mesures indirectes de l’activité neuronale reposent sur le fait que la genèse de potentiels d’action dissipe les gradients ioniques de part et d’autre de la membrane cellulaire du neurone, et que les pompes transmembranaires qui rétablissent ces gradients consomment de l’ATP. Lorsqu’une aire cérébrale est activée, une telle consommation énergétique provoque, avec un délai de l’ordre de la seconde, une vasodilatation des artères afin de fournir un surplus de glucose et d’oxygène. Ce mécanisme neuro-vasculaire, nommé « hyperémie1 fonctionnelle » ou couplage neuro-vasculaire, constitue ainsi une mesure dynamique des activités cérébrales à travers l’ensemble du cerveau. Réciproquement, un déséquilibre entre l’activité des neurones et le métabolisme tissulaire est associé à un nombre croissant de pathologies. Des défauts de perfusion cérébrale brusques et localisés provoquent des pertes de capacités cognitives spécifiques (une perte de production de la parole, ou aphasie, lors d’un défaut de perfusion de l’aire de Broca par exemple), tandis qu’un défaut chronique et diffus est associé aux démences. Plus récemment, il est apparu que la maladie d’Alzheimer débute par un défaut de couplage neuro-vasculaire, altérant la barrière hémato-encéphalique et diminuant la capacité à éliminer le peptide bêta-amyloïde [2, 3] (→).
(→) Voir la Synthèse de F. Gosselet et al., m/s n° 11, novembre 2011, page 987
Un autre exemple de déséquilibre entre activité vasculaire et activité neuronale est l’épilepsie. Toutes les épilepsies sont liées à une hyperactivité neuronale. Or on sait également qu’un bas débit sanguin cérébral provoque des convulsions. Plus récemment, dans un modèle de crise convulsive, il a été montré que l’inhibition de l’enzyme lactate déhydrogénase, pivot de la régulation métabolique, bloque les crises [4]. Pour les épilepsies avec absence2, il a été découvert que les crises sont régulées par le neuropeptide Y qui est à la fois vasoconstricteur et angiogénique [5]. |
Concilier EEG avec IRM ou mesures optiques Afin d’aborder des questions au niveau global neuro-métabolique, un développement technique complexe a consisté à adapter l’électroencéphalographie (EEG), permettant d’enregistrer l’activité électrique à la surface du crâne, pour la rendre compatible avec l’IRM (imagerie par résonance magnétique) [6]. L’IRM fonctionnelle (mesurant le signal BOLD, blood-oxygen-level dependent) estime la distribution sanguine en se basant sur l’aimantation de l’hémoglobine [7]. Sa sensibilité et sa résolution augmentent avec l’intensité du champ magnétique utilisé. Cependant, les mesures obtenues sont difficiles à corréler directement avec un enregistrement électrique neuronal, car les champs magnétiques intenses utilisés par l’IRM génèrent des courants électriques induits qui brouillent la détection des activités électriques physiologiques de faible amplitude. Des appareils EEG spécifiques ont donc été développés pour limiter au maximum les artéfacts causés par le champ magnétique. Appliquée au singe, cette technique a permis, par exemple, de montrer que les événements EEG sharp wave-ripple
3, supposés aider la coordination entre aires cérébrales, correspondent à une large activation du néocortex et du cortex limbique, et à une inhibition du diencéphale et du mésencéphale [8]. Cette approche a cependant ses limites. Outre la difficulté technique, sa sensibilité est limitée, imposant de moyenner de nombreux événements sans discerner leur variabilité. De plus, l’IRM est un appareil massif, nécessitant un approvisionnement permanent en hélium, dont la disponibilité reste limitée. Enfin, si l’immobilité du sujet dans l’IRM est une nécessité à laquelle il est possible de répondre par sédation chez le rongeur et par contention chez le primate (tout en maintenant la mobilité des membres supérieurs), elle limite cependant considérablement l’éventail des expériences possibles. Une approche alternative consiste à utiliser l’imagerie optique pour observer les activités vasculaires cérébrales. En effet, l’oxy-hémoglobine est rouge, alors que la déoxy-hémoglobine est plus proche du bleu. En mesurant le spectre d’un faisceau lumineux qui diffuse à travers un volume de tissu, on peut donc estimer son irrigation et le niveau d’oxygénation du sang. Cependant, cette approche est limitée par la forte diffraction de la lumière dans le tissu nerveux, liée aux forts écarts d’indice optique entre le milieu extracellulaire, essentiellement aqueux, et les multiples compartiments contenant des tissus gras, comme la myéline. Des variations métaboliques sont observables à la surface du cortex, en enlevant un volet osseux dans le crâne. Cette approche a permis par exemple d’observer, chez le rat, comment un foyer épileptique provoque un afflux sanguin au détriment des régions voisines [9]. Cette approche est facile à combiner avec des enregistrements EEG, relativement accessible, et permet éventuellement l’étude d’animaux mobiles. Le volume exploré par ce type d’imagerie se limite toutefois à la surface du cortex. |
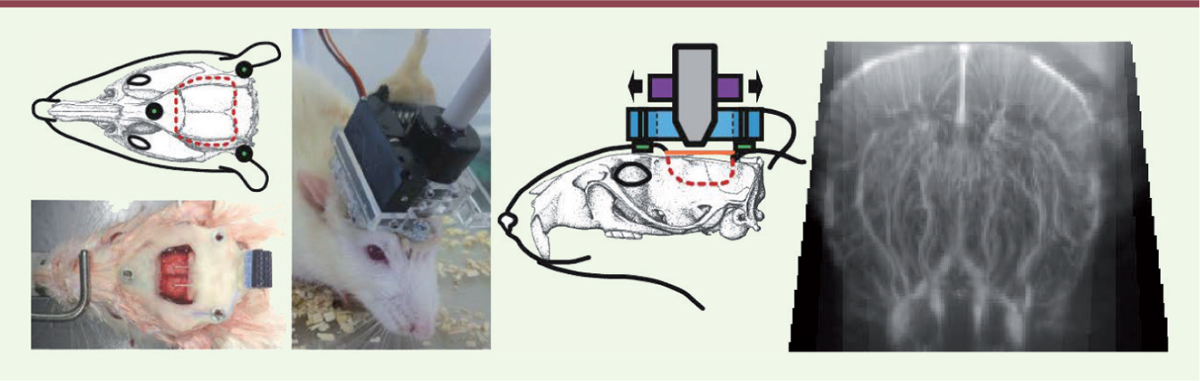
EEG et imagerie ultrasonore fonctionnelle (fUS) L’imagerie vasculaire cérébrale par Doppler ultrasonore ultrarapide possède des atouts permettant d’étudier l’animal éveillé mobile. Elle présente une excellente sensibilité grâce à un échographe ultrarapide permettant de réaliser plus de 10 000 images par seconde. Elle permet de détecter des fluctuations du débit sanguin 50 fois plus faibles que sur les échographes conventionnels. Avec cet échographe ultrarapide, un plan de 200 microns d’épaisseur peut être observé avec une résolution de 100-120 microns, jusqu’à une profondeur de 15 mm depuis la surface du cerveau, ce qui est suffisant pour étudier l’étendue dorso-ventrale du cerveau du rat adulte. En combinant 200 images consécutives, on peut estimer en chaque point de l’image la quantité de particules échogènes en mouvement, autrement dit les cellules sanguines, et particulièrement les globules rouges. Leur concentration étant homogène, la mesure indique le volume local du réseau sanguin, qui est normalisé par rapport à un niveau moyen sur une période de référence. Mis à part les effets liés au battement cardiaque, les variations se produisent sur une échelle de temps de l’ordre de la seconde. La distorsion des ultrasons par la voûte crânienne impose de s’affranchir de la barrière osseuse. Pour la mise au point, nous avons réalisé des expériences aiguës sur le rat, au moyen d’une trépanation. Pour conserver largeur et profondeur du champ d’observation, augmenter la durée d’expérimentation ainsi que l’éventail des protocoles expérimentaux, la calotte crânienne est maintenant remplacée par un film de polymère [10]. Un système mécanique permet d’attacher une sonde miniaturisée sur la tête et de la déplacer à distance à l’aide d’un moteur (Figure 1). Le volume ainsi accessible comprend le système nerveux central situé entre les bulbes olfactifs et le cervelet, qui inclut cortex, thalamus et hippocampe.
 | Figure 1.
Préparation chirurgicale d’un rat pour EEG-fUS. La calotte osseuse est réséquée, suivant la ligne pointillée rouge en vue de dessus, et remplacée par une prothèse plastique perméable aux ultrasons. Après quelques jours de récupération, trois écrous sont disposés autour de la fenêtre pour fixer la sonde ultrasonore. Le support de la sonde est motorisé, mais le poids total n’empêche pas le mouvement de l’animal. L’échographe relié à la sonde produit un plan image du réseau vasculaire, dont on estime en chaque point les variations de flux sanguin par rapport au niveau moyen. EEG : électroencéphalographie ; fUS : imagerie ultrasonore fonctionnelle (adapté de [ 10]). |
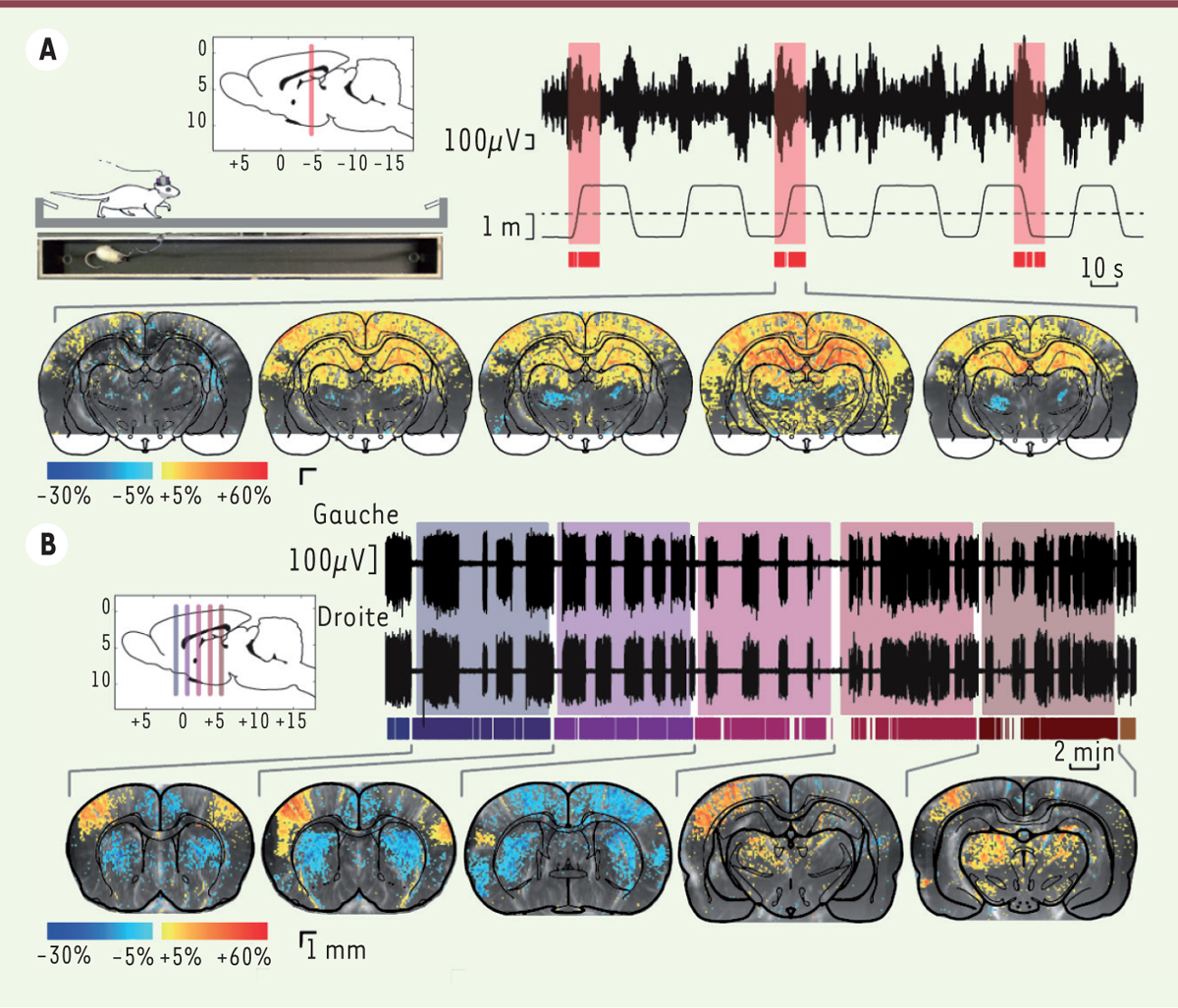
Les avantages de la méthode ultrasonore sont significatifs par rapport aux autres techniques d’exploration fonctionnelle. La sensibilité est fortement accrue puisqu’on peut suivre en direct l’hémodynamique fonctionnelle, dans toute sa variabilité. La sonde étant d’une taille de l’ordre du centimètre, avec un câble souple pouvant atteindre 2 mètres, l’animal peut bouger la tête et se mouvoir dans un environnement de test comportemental. Les ultrasons ne perturbent pas le champ électromagnétique généré par l’activité cérébrale, permettant des enregistrements simultanés de l’EEG sans artefact et avec du matériel standard. Enfin le coût et la maintenance de l’équipement sont largement inférieurs à ceux de l’IRM et comparables aux approches optiques. L’approche globale neuro-métabolique au moyen de l’EEG couplé au fUS permet notamment d’étudier l’activation des aires cérébrales dans des tâches de navigation spatiale, en relation avec les activités rythmiques détectées par l’EEG et associées à la mémoire spatiale (Figure 2A). L’absence de sédation permet de s’intéresser à des pathologies qui y seraient sensibles, comme les épilepsies (Figure 2B). Les prochains développements techniques, tels que l’imagerie simultanée de plusieurs plans ou le couplage aux techniques optiques grâce à la fenêtre transparente, devraient aider à aborder avec une efficacité accrue les questions de codage neuronal de l’information et des pathologies neuro-vasculaires.
 | Figure 2.
Navigation spatiale et crises épileptiques. Les plans d’imagerie, coronaux, sont indiqués sur les vues de côté du cerveau dans les encadrés. A. L’animal court d’un bout à l’autre d’un couloir de 2 mètres pour trouver de l’eau. On enregistre l’EEG de l’hippocampe au rythme thêta (6-9Hz, associé au traitement de l’information spatiale) et la position de l’animal. Par fUS, on image un plan fixe incluant l’hippocampe, pendant les périodes de mobilité (boîtes rouges). Les séquences d’images sont alignées par rapport au moment où l’animal passe au milieu de la piste, au maximum du thêta. La série d’images montre la variation de volume sanguin pour des intervalles de temps de allant de -1s à +3s. Hippocampe, cortex somatosensoriel (codant pour les informations provenant de la surface du corps) et thalamus dorsal sont activés, alors que le thalamus ventral est hypoperfusé. B. Crises d’absence spontanées chez le rat GAERS ( genetic absence epilepsy in rats from Strasbourg) éveillé, un modèle d’épilepsie absence [ 11]. La sonde enregistre chaque plan pendant une dizaine de minutes, tandis que des électrodes corticales à droite et à gauche détectent les crises généralisées. La comparaison des images prises pendant ou entre des crises révèle que les crises sont associées à une hyperactivité du cortex somatosensoriel et des aires thalamiques, tandis que des aires corticales voisines et le striatum présentent une vasoconstriction. EEG : électroencéphalographie ; fUS : imagerie ultrasonore fonctionnelle (adapté de [ 10]). |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Logothetis N. What we can do and what we cannot do with fMRI . Nature. 2008; ; 453 : :869.–878. 2.
Shih AY, Blinder P, Tsai PS, et al. The smallest stroke: occlusion of one penetrating vessel leads to infarction and a cognitive deficit . Nat Neurosci. 2013; ; 16 : :55.–63. 3.
Gosselet F, Candela P, Cecchelli R, Fenart L. La barrière hémato-encéphalique : une nouvelle cible thérapeutique dans la maladie d’Alzheimer ? . Med Sci (Paris). 2011; ; 27 : :987.–992. 4.
Sada N, Lee S, Katsu T, et al. Targeting LDH enzymes with a stiripentol analog to treat epilepsy . Science. 2015; ; 347 : :1362.–1367. 5.
van Raay L, Jovanovska V, Morris MJ, O’Brien TJ. Focal administration of neuropeptide Y into the S2 somatosensory cortex maximally suppresses absence seizures in a genetic rat model . Epilepsia. 2012; ; 53 : :477.–484. 6.
Logothetis NK. Intracortical recordings and fMRI: an attempt to study operational modules and networks simultaneously . Neuroimage. 2012; ; 62 : :962.–969. 7.
Ogawa S, Lee TM, Kay AR, Tank DW. Brain magnetic resonance imaging with contrast dependent on blood oxygenation . Proc Natl Acad Sci USA. 1990; ; 87 : :9868.–9872. 8.
Logothetis NK. Neural-event-triggered fMRI of large-scale neural networks . Curr Opin Neurobiol. 2015; ; 31 : :214.–222. 9.
Ma H, Zhao M, Schwartz TH. Dynamic neurovascular coupling and uncoupling during ictal onset, propagation, and termination revealed by simultaneous in vivo optical imaging of neural activity and local blood volume . Cereb Cortex. 2013; ; 23 : :885.–899. 10.
Sieu LA, Bergel A, Tiran E, et al. EEG and functional ultrasound imaging in mobile rats . Nat Methods. 2015; ; 12 : :831.–834. 11.
Depaulis A, David O, Charpier S. The genetic absence epilepsy rat from Strasbourg as a model to decipher the neuronal and network mechanisms of generalized idiopathic epilepsies . J Neurosci Methods. 2016; ; 260 : :159.–174. |