| |
| Med Sci (Paris). 32(4): 387–393. doi: 10.1051/medsci/20163204017.Les lymphocytes Th9 Une nouvelle population de lymphocytes T auxiliaires dans la lutte contre le cancer Frédérique Vegran,1,2,3 François Martin,2 Lionel Apetoh,1,2,3 and François Ghiringhelli1,2,3* 1Centre Georges François Leclerc, 1, rue du Professeur Marion, 21079Dijon, France 2Inserm, U866, faculté de médecine et de pharmacie, 7, boulevard Jeanne d’Arc, 21079Dijon, France 3Université de Bourgogne, faculté de médecine, 7, boulevard Jeanne d’Arc, 21079Dijon, France |

Vignette (Photo © Delphine Sauce). Les cellules Th9 (pour T helper 9) sont des lymphocytes T CD4 caractérisés par la production d’interleukine-9 (IL-9) et la très faible expression de cytokines considérées comme des marqueurs d’autres sous-populations de lymphocytes T auxiliaires comme l’interféron (IFN)γ, l’IL-4 et l’IL-17. Peu abondants dans les conditions normales, ces lymphocytes auxiliaires ont été essentiellement caractérisés grâce à l’étude de cellules dérivées de lymphocytes T CD4 naïfs cultivés in vitro en présence de TGF-β (tumor growth factor-β) et d’IL-4. Ils sont considérés comme des lymphocytes inflammatoires et sont impliqués dans les maladies atopiques et auto-immunes et dans la défense contre les parasites [1]. Récemment, les Th9 se sont révélés particulièrement efficaces dans la lutte contre le cancer. |
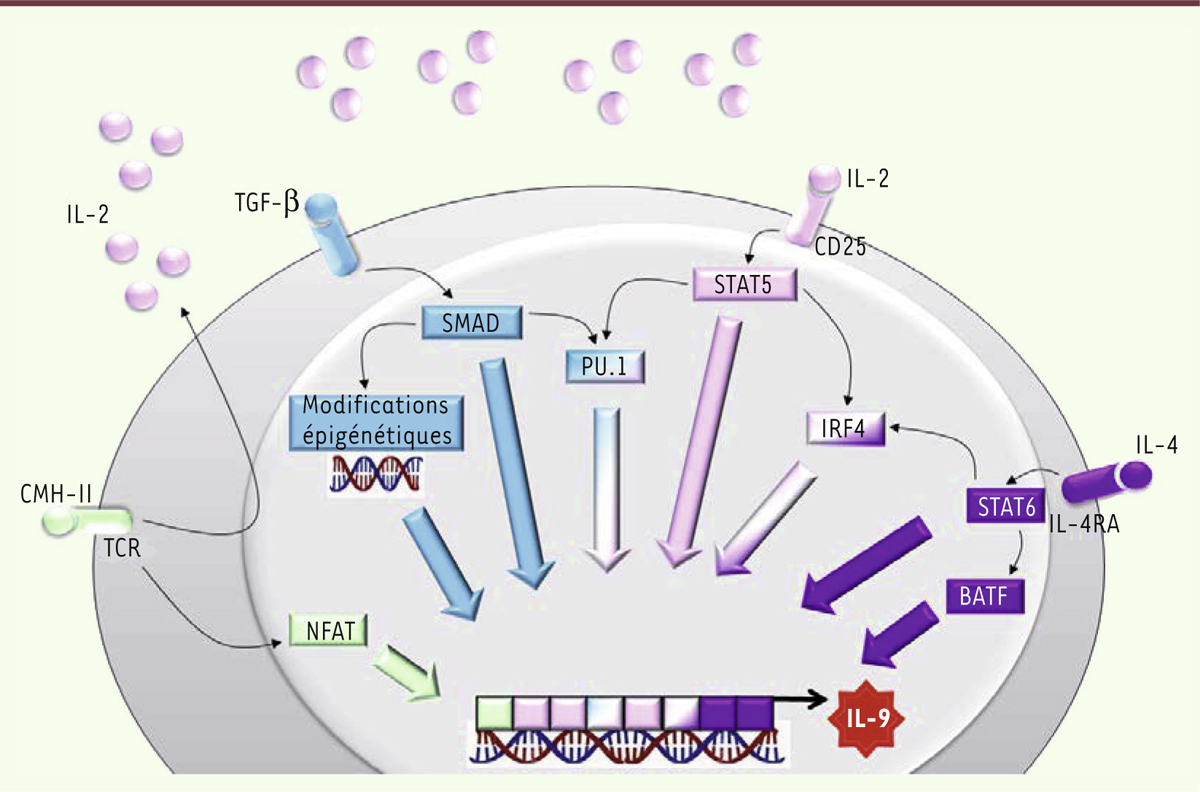
Différenciation des lymphocytes Th9 La description initiale de la polarisation des cellules Th9 a été faite à partir d’expériences dans lesquelles les cellules T ont été cultivées en présence d’IL-2, d’IL-4 et de TGF-β [2]. Après activation du TCR (T cell receptor), les lymphocytes T CD4 produisent de l’IL-2 qui, en se fixant à son récepteur (le CD25), active une voie de signalisation dépendant du facteur de transcription STAT5 (signal transducers and activators of transcription 5) qui interagit avec le promoteur du gène Il9, codant l’IL-9, afin d’induire la production de la cytokine [3]. En l’absence de STAT5, les lymphocytes T sont donc incapables de sécréter de l’IL-9 [4]. STAT5 induit également l’expression d’IRF4 (interferon regulatory factor 4) et de Spi-1/PU.1, deux facteurs de transcription qui sont nécessaires à la différenciation des lymphocytes en Th9 [5–7] (Figure 1).
 | Figure 1.
Étapes moléculaires de la différenciation Th9. Après activation du TCR (T cell receptor), les lymphocytes T CD4 activés produisent de l’IL(interleukine)-2. L’IL-2 libérée se fixe à son récepteur (CD25) et active une voie dépendante de STAT5 (signal transducer and activator of transcription 5). Après fixation de l’IL-4 à son récepteur (IL-4RA), une voie de transduction du signal dépendante de STAT6 est induite. Suite à l’activation du récepteur au TGF(transforming growth factor)-β, les protéines SMAD (Sma and Mad related protein) sont recrutées. Ces différentes voies induisent des facteurs de transcription (comme PU.1) et des modifications épigénétiques qui activent directement l’expression des gènes du profil Th9 dont l’Il9. CMH-II : complexe majeur d’histocompatibilité de type II ; IRF4 : interferon regulatory factor 4 ; BATF : basic leucine zipper transcription factor, ATF-like ; TCR : récepteur des cellules T ; NFAT : nuclear factor of activated T-cells. |
STAT6 est un autre facteur de transcription essentiel qui est activé après stimulation par le récepteur de l’IL-4 porté par les lymphocytes. STAT6 peut se fixer directement au promoteur de l’Il9 [8, 9], mais il est également capable d’induire l’expression des facteurs de transcription IRF4 et BATF (basic leucine zipper transcription factor, ATF-like) qui, bien que non spécifiques du sous-type Th9, sont essentiels à la différenciation de ces cellules [5]. IRF4 est crucial pour la différenciation Th9. Il se lie directement au promoteur de l’Il9 [5, 6] et, tout comme STAT6, est capable de bloquer l’expression de facteurs de transcription répresseurs de la différenciation Th9 comme Tbet (T-box expressed in T cells) ou FOXP3 (forkhead box P3), qui contôlent, eux, la maturation des cellules vers d’autres sous-populations lymphocytaires [5]. Le facteur de transcription GATA-3 (GATA binding protein 3) est, quant à lui, fortement induit dans les cellules de type Th2 à la suite de la fixation de l’IL-4 sur son récepteur IL-4Ra. Bien que plus faible dans les Th9, l’expression de GATA-3 semble essentielle à ces cellules. Les Th9 sont en effet incapables de produire de l’IL-9 en l’absence de GATA-3 [8, 10]. GATA-3 pourrait interagir avec le facteur de transcription Foxp3 et ainsi réprimer la différenciation (induite par le TGF-β) des cellules en Treg (T régulateurs) [11]. Les protéines SMAD2 (Sma and Mad related protein 2), SMAD3 et SMAD4 sont impliquées dans l’activation des cellules induite par le TGF-β [12, 13]. Elles sont à l’origine de modifications de la structure de la chromatine, au niveau du locus de l’Il9, notamment en bloquant le recrutement des protéines comme EZH2 (enhancer of zeste 2), appartenant au complexe multi-protéique PRC2 (polycomb repressive complex 2) responsable de la méthylation de l’ADN [13]. SMAD2 et SMAD3 interagissent également avec IRF4 lui permettant une fixation optimale au promoteur de l’Il9 [12]. Les SMAD favoriseraient également la différenciation Th9 en bloquant l’expression des gènes spécifiques du sous-type Th2 induits par l’IL-4 [13]. La stimulation des cellules par le TGF-β active également des voies de signalisation, indépendantes des SMAD, qui peuvent induire l’expression de PU.1, un facteur de transcription de la famille ETS (E26 transformation-specific). PU.1 est essentiel pour la différenciation des cellules Th9 [8]. Il interagit avec le promoteur de l’Il9 et est également responsable du recrutement d’histone acétyle transférases (HAT) qui facilitent l’accessibilité à la chromatine [7, 8]. En son absence, la capacité des lymphocytes T à produire de l’IL-9 est diminuée et est associée, simultanément, à une augmentation de production des cytokines de type Th2 [7]. À noter enfin, que l’activation des lymphocytes naïfs par l’intermédiaire des récepteurs GITR (glucocorticoid-induced tumor necrosis factor receptor [TNFR] related protein) favorise la différenciation Th9 par une voie de signalisation impliquant TRAF6 (TNF-receptor associated factor 6) et NFkB (nuclear factor-kappa B) et que des anticorps agonistes de GITR stimulent l’activité antitumorale des Th9 [14]. |
Les cytokines exprimées par les lymphocytes Th9 Les cellules Th9, obtenues par polarisation conventionnelle (c’est-à-dire en présence de TGF-β et d’IL-4) de lymphocytes T CD4 naïfs de souris, expriment fortement les gènes Il9 et Il10 [10, 11]. Ces cellules produisent également de l’IL-3 à des niveaux qui sont équivalents à ceux de l’IL-9 [15]. Jäger et al. [16] ont rapporté que les Th9 de souris produisaient des quantités importantes d’IL-9 et d’IL-10, mais qu’elles sécrétaient aussi de petites quantités d’IL-17, d’IL-21, d’IL-22 et d’IFNγ. Lorsque la polarisation par le TGF-β et l’IL-4 est associée à une exposition à une cytokine inflammatoire, l’IL-1β, une forte augmentation de la production d’IL-9 et d’IL-21 par les Th9 est observée [17]. Bien que produisant de l’IL-10, une cytokine anti-inflammatoire, les Th9 semblent dépourvus d’activité immunosuppressive [11], une absence de fonction suppressive qui n’est actuellement pas clairement expliquée. Contrairement aux Th9 de souris, les Th9 humains, obtenus après polarisation conventionnelle, ne semblent pas exprimer l’Il-10 [18]. |
Lymphocytes Th9 et pathologies Maladies allergiques Une étude récente a montré une augmentation significative du nombre de cellules Th9 dans le sang de patients atteints de dermatite atopique [ 19, 44] ( →).
(→) Voir la Synthèse de V. Julia et al., m/s n° 3, mars 2016, page 260
Les Th9 semblent également être impliqués dans la maladie asthmatique. En effet, l’IL-9 stimule la production du mucus, l’infiltration de leucocytes et la production d’IgE par les lymphocytes B [20]. Elle active également la production d’histamine par les mastocytes [21] leur conférant un rôle dans l’allergie chronique. À noter que la neutralisation de l’IL-9 diminue l’inflammation [22] et que, dans les lavages broncho-alvéolaires des patients allergiques, la concentration d’IL-10 est inversement corrélée à la sévérité de la maladie [23] (Tableau I).
Tableau I
| Observations |
|
Dermatite |
Augmentation : |
|
|
des cellules Th9 dans le sang |
|
|
des cellules Th9 infiltrantes |
|
|
IL(interleukine)-9 augmente : |
| Allergies |
|
l’infiltrat en éosinophiles |
|
|
l’infiltrat en mastocytes |
|
Asthme |
la production de mucus |
|
|
la production d’IgE |
|
|
la production d’histamine |
|
|
l’anaphylaxie |
|
| Maladies auto-immunes |
Colite (MICI, maladies inflammatoires chroniques de l’intestin) |
Infiltrat Th9 augmente avec la maladie |
| L’IL-9 bloque la cicatrisation des plaies |
| L’IL-9 induit la surproduction de pores sur la paroi intestinale |
| Sclérose en plaques (SEP) |
L’IL-9 induit le recrutement de cellules Th17 (inflammation et angiogenèse) |
|
| Cancer |
Recrutement des cellules dendritiques et des lymphocytes T CD8 par la voie CCL20/CCR6 |
|
L’IL-9 induit l’arrêt de la prolifération et la mort des cellules de mélanome |
|
L’IL-21 induit le recrutement et l’activation des lymphocytes T CD8 et des cellules NK (natural killer) |
|
L’IL-3 induit la survie des cellules dendritiques |
|
L’IL-9 accélère la croissance des cellules leucémiques myéloïdes et réduit l’efficacité de la réponse immunitaire antitumorale |
Th9 et pathologies. CCL20 : chemokine (C-C motif) ligand 20 ; CCR6 : chemokine (C-C motif) receptor 6; IgE : immunoglobuline E. |
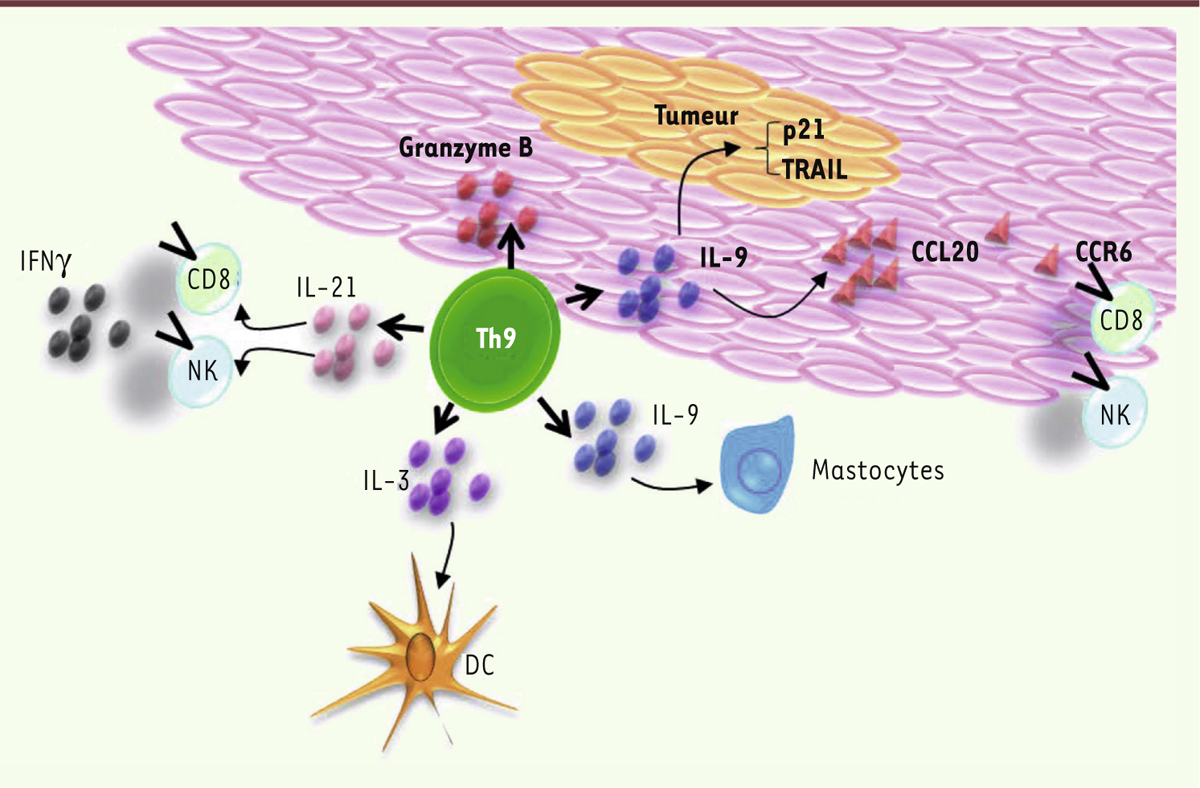
Maladies auto-immunes L’implication des lymphocytes Th9 a été récemment décrite dans la pathogénèse des maladies inflammatoires chroniques de l’intestin (MICI). En utilisant des marquages par immunofluorescence de l’IL-9, du facteur PU.1 et de CD4, il a en effet été montré que les cellules Th9 étaient présentes au niveau de la muqueuse intestinale des patients atteints de colite et que leur nombre augmentait selon la gravité de la maladie. Chez la souris, l’absence d’IL-9 et/ou de PU.1 prévient l’apparition d’une colite induite par l’oxazolone 1, suggérant que le ciblage de l’IL-9 pourrait être une stratégie thérapeutique pour lutter contre la colite inflammatoire. En se fixant sur ses récepteurs présents au niveau des cellules épithéliales coliques, l’IL-9 a une action délétère en induisant en particulier, une perte d’intégrité de la paroi intestinale. L’IL-9 bloquerait également la cicatrisation des plaies [ 24]. Les lymphocytes Th9 sont également impliqués dans d’autres modèles de maladies auto-immunes comme la sclérose en plaques (SEP). Dans cette pathologie, l’IL-9 présente un caractère délétère en induisant la différenciation des lymphocytes en Th17 ainsi qu’en stimulant l’inflammation et l’angiogenèse associées [25]. L’IL-9 induit également la production de CCL20 (chemokine [C-C motif] ligand 20) par les astrocytes favorisant ainsi le recrutement dans le système nerveux central des lymphocytes Th17 présentant le récepteur à la chimiokine (CCR6, chemokine [C-C motif] receptor 6) [26]. Les lymphocytes Th9 expriment à leur surface différents récepteurs aux chimiokines, CCR3, CCR6 et CXCR3 (chemokine [C-X-C motif] receptor 3). CCR3 et CCR6 sont impliqués dans la migration des cellules Th9 dans la cavité péritonéale. CXCR3 participe à leur recrutement dans le système nerveux central [27]. Dans des modèles murins d’encéphalite (EAE, experimental autoimmune encephalomyelitis) fondé sur l’activité de cellules autoréactives réagissant contre un antigène de la myéline, MOG (myelin oligodendrocyte glycoprotein), des souris ayant subi un transfert adoptif de cellules Th9 exprimant un récepteur antigénique (TCR) spécifique de cet antigène, développent toutes une pathologie sévère et des lésions importantes du système nerveux central [16]. Infections parasitaires Il était jusqu’à présent admis que l’IL-9, produite par les lymphocytes de type Th2, était en partie responsable de l’immunité antiparasitaire. Désormais, les lymphocytes Th9 sont considérés comme les principales cellules productrices d’IL-9 dans ces infections. Les cellules Th9 sont présentes en grande quantité dans le sang de patients atteints de filarioses lymphatiques 2, leur abondance étant directement reliée à la sévérité de la maladie [ 28]. L’IL-9 joue également un rôle dans les helminthiases 3. Des souris transgéniques produisant de grandes quantités d’IL-9 présentent, après infestation, une réponse de type Th2 qui est accélérée et une élimination plus rapide des parasites Trichuris muris et T. spiralis (des formes d’helminthes infectant la souris). La quantité d’IL-9 est directement corrélée aux nombres de mastocytes et d’éosinophiles, des cellules qui seraient les effecteurs de la réponse antiparasitaire [ 29, 30]. Des résultats récents semblent confirmer ces observations. Malgré une grande variabilité expérimentale, ils montrent qu’un transfert adoptif de Th9 est suffisant pour induire l’expulsion de Nippostrongylus brasiliensis, une autre espèce d’helminthe [ 31]. Cancer Purwar et al. [ 32] ont montré chez la souris que le transfert adoptif de lymphocytes Th9 spécifiquement dirigés contre l’ovalbumine est plus efficace pour freiner la croissance du mélanome de souris B16-F10, exprimant l’ovalbumine (B16-OVA), que le transfert des autres sous-populations de lymphocytes T auxiliaires (Th1, Th2 et Th17). Un rôle direct des cellules Th9 a ainsi été évoqué, soulignant leur aptitude à induire directement une apoptose des cellules de mélanome en culture (Figure 2). Un rôle indirect a également été observé. En effet, l’administration d’IL-9 recombinante permet de ralentir la croissance du mélanome B16-F10 (mais également celle du carcinome pulmonaire murin de Lewis LLC-1 [ Lewis lung carcinoma line 1]) chez la souris immunocompétente. Inversement, chez des souris génétiquement déficientes pour le gène codant le récepteur à l’IL-9, la croissance tumorale est plus rapide. L’administration d’IL-9 recombinante ralentit également la croissance du mélanome B16-F10 chez des souris Rag-1-/- qui sont dépourvues de lymphocytes T et B, suggérant que l’IL-9 peut avoir une action sur d’autres cellules, non lymphocytaires, comme les mastocytes qui, eux, semblent être impliqués puisque l’administration d’IL-9 perd de son effet anti-tumoral chez des souris déficientes en ces cellules (Kit W-sh/HNihrJaeBsmJ 4). Le rôle des Th9 a également été examiné dans un modèle de métastases pulmonaires obtenues après injection intraveineuse de cellules de mélanome B16-F10 [ 33]. Dans ce modèle, l’administration d’un anticorps neutralisant l’IL-9 augmente significativement le nombre et le volume des foyers tumoraux. Parallèlement, une diminution significative de l’infiltration pulmonaire par des lymphocytes T CD4 et CD8 et par des cellules dendritiques (DC) est observée. Inversement, le transfert adoptif de cellules Th9, obtenus par différenciation de lymphocytes T CD4 reconnaissant l’ovalbumine, protège les souris contre les tumeurs pulmonaires induites par l’injection intraveineuse de cellules de mélanome B16-OVA, en induisant une accumulation de lymphocytes T CD4 et CD8 et de cellules dendritiques. Au sein de la tumeur, les cellules Th9 induisent la production de CCL20 qui est reconnue par le récepteur CCR6 exprimé par les cellules CD4, CD8 et les DC, leur servant ainsi de chimioattractant. L’effet antitumoral du transfert des Th9 disparaît après déplétion des lymphocytes CD8 et aucune accumulation de mastocytes n’est alors observée.
 | Figure 2.
Rôle antitumoral des Th9 dans le cancer. Différentes activités antitumorales des Th9 ont été décrites. Ils possèdent une activité cytotoxique par le biais du Granzyme B. L’IL(interleukine)-3 qu’ils sécrètent active les cellules dendritiques (DC). L’IL-21 active les lymphocytes T CD8 et les cellules NK (natural killer). L’IL-9 active les mastocytes et peut également bloquer la croissance cellulaire par le biais de TRAIL (TNF-related apoptosis-inducing ligand) et p21 (cyclin-dependent kinase inhibitor) ou induire le recrutement des cellules T CD8 et NK par chimiotactisme impliquant la chimiokine CCL20 (chemokine [C-C motif] ligand 20) et son récepteur CCR6 (chemokine [C-C motif] receptor 6). IFNγ : interféron gamma. |
Les Th9 produisent également de l’IL-10 qui est retrouvée au site des mélanomes mais pas dans la peau saine adjacente [34]. Cette cytokine pourrait présenter un effet antitumoral en inhibant l’angiogenèse [35]. Cependant, aucune étude ne démontre que l’activité antitumorale des cellules Th9 dépendrait de fonctions antiangiogéniques de l’IL-10. Les lymphocytes Th9, générés in vitro, produisent des quantités non négligeables d’IL-3, une cytokine qui induit la prolifération de la lignée myéloïde. L’IL-3 produite par les Th9 augmente la survie des cellules dendritiques. Lorsque ces cellules myéloïdes sont conditionnées par du surnageant de lymphocytes Th9 (et donc activées par l’IL-3 qui y est contenue), et transférées à des souris porteuses de tumeurs B16-OVA, elles induisent une augmentation de la production d’IFNγ par les lymphocytes T de ces souris [15]. Un ralentissement de la croissance tumorale a été observé chez des souris porteuses de tumeurs coliques après vaccination par un lysat de cellules isolées de tumeurs coliques associé à de l’alun. Le développement d’une réponse de type Th2, au sein de la tumeur, permettrait, dans ce cas, la conversion des lymphocytes T régulateurs (Treg) intratumoraux en cellules Th9 qui seraient responsables de l’effet antitumoral observé [36]. |
Les cytokines antitumorales produites par les Th9 L’IL-9 est considérée comme le marqueur caractéristique des cellules Th9. Elle peut cependant être produite également par de nombreux autres types cellulaires [1, 37], dont les lymphocytes T CD4 (Th2, Th17 et Treg), les lymphocytes T CD8, les cellules natural killer (NK), les cellules lymphoïdes innées de type 2 (ILC2), mais aussi des cellules non lymphocytaires comme les mastocytes et les éosinophiles. Dans ces autres cellules, différentes des Th9, l’IL-9 peut contribuer à leur activité antitumorale. Ainsi, l’expression de l’Il9 dans les T CD8 (les cellules Tc9) procure à ces cellules une activité tumoricide supérieure à celle des Tc1 conventionnelles (les lymphocytes T CD8 cytotoxiques) qui expriment l’IFNγ [38]. Les données montrant l’efficacité antitumorale du transfert de lymphocytes Th9 chez des souris porteuses de mélanome ou de carcinome pulmonaire que nous avons évoquées, suggèrent que l’IL-9, et les lymphocytes Th9 qui expriment cette cytokine, constituent des armes puissantes contre les cancers. Cela est également le cas dans des modèles de cellules humaines où l’IL-9 inhibe la croissance du mélanome HTB-72 (un mélanome humain), en augmentant l’expression de p21 (cyclin-dependent kinase inhibitor) et TRAIL (TNF-related apoptosis-inducing ligand) dans ces cellules [39]. Cependant, la situation est sans doute plus complexe… Dans les leucémies et les lymphomes, que ce soit chez l’homme et dans certains modèles animaux, l’IL-9 peut avoir un rôle protumoral en stimulant la prolifération des cellules cancéreuses et en réduisant également l’efficacité de la réponse immunitaire antitumorale [40]. Ainsi, dans des souris déficientes pour l’Il9 (IL-9KO), les cellules de lignées de cancers mammaires non métastasique, TUBO, et métastasique, 4T1, et de cancer colique, CT26, ne provoquent pas de tumeurs ou seulement des tumeurs régressives [41]. Le rejet des tumeurs chez ces souris est conditionné par la présence de lymphocytes T CD4 et surtout T CD8 dont la déplétion rétablit la progression tumorale. Ces effets inhibiteurs sur la croissance tumorale de la déplétion génomique de l’IL-9 peuvent être reproduits par l’injection d’anticorps neutralisant la cytokine. Ces résultats qui apparaissent contradictoires avec ceux évoqués plus haut, pourraient dépendre de la nature de la tumeur étudiée, de la diversité des anticorps neutralisants utilisés ou d’autres facteurs qui restent à déterminer. La polarisation Th9 de lymphocytes de souris par les cytokines conventionnelles, TGF-β et IL-4, en présence de la cytokine inflammatoire IL-1β, induit une expression accrue de l’Il9, mais également une expression abondante de l’Il21. La présence d’IL-1β lors de la polarisation, permet d’augmenter significativement l’activité antitumorale des Th9 ainsi différenciés par rapport à celle des Th9 conventionnels. Cette activité antitumorale est totalement neutralisée par l’adjonction d’anticorps bloquant l’IL-21 contrairement à celle des Th9 conventionnels qui dépend, elle, de la présence d’IL-9 [17]. L’IL-21 est une cytokine pléiotropique qui influence de nombreux types cellulaires : les lymphocytes T CD4 et CD8, les cellules Th17 et Treg, les cellules NK et NKT (T natural killer), les lymphocytes B, les cellules dendritiques et les macrophages [42]. Elle potentialise l’activité antitumorale des lymphocytes T CD4 et CD8 et des cellules NK en stimulant leur sécrétion d’IFNγ et en augmentant leur capacité tumoricide [43]. L’IL-21 ne fait pas partie des marqueurs qui permettent de caractériser un type particulier de lymphocytes T auxiliaires. Cependant, l’expression d’IL-21 dans des Th9 humains avait déjà été observée, indépendamment de leur activité anti-tumorale, lorsque ces lymphocytes avaient été différenciés en présence de cytokines inflammatoires, comme l’IL-1β, mais aussi en présence d’interférons de type I (IFNa et β), d’IL-10 et d’IL-21 [18]. |
Les lymphocytes Th9, une nouvelle approche pour l’immunothérapie des cancers ? La mise en évidence dans des modèles de cancers expérimentaux d’une activité antitumorale accrue des lymphocytes Th9 par rapport aux autres types de lymphocytes auxiliaires comme les cellules Th1, jusqu’ici considérés comme les champions dans la lutte immunitaire contre le cancer, est un fait nouveau et surprenant. Beaucoup de points restent cependant à confirmer et à approfondir : les observations obtenues avec les cellules Th9 de souris s’appliquent-elles toutes à leurs homologues humaines ? D’autres cytokines inflammatoires, comme les interférons de classe I, ont-elles un effet supérieur à celui de l’IL-1β pour l’induction de la production d’IL-9 et d’IL-21 par les cellules Th9, et la promotion de leur activité antitumorale ? Quel est l’effet de traitements mixtes qui associent l’effet antitumoral des Th9, ou des cytokines qu’ils produisent, et celui d’agents capables d’inhiber les mécanismes immunosuppresseurs ? Dans les protocoles expérimentaux utilisant, chez la souris, la lignée de mélanome B16, il est remarquable que les transferts passifs de cellules Th9 n’aient qu’un effet suspensif sur l’évolution des tumeurs, excepté dans le cas d’une association à une administration de cyclophosphamide, une chimiothérapie anticancéreuse connue pour éliminer les lymphocytes T régulateurs, avec une régression totale des tumeurs chez 4 des 10 souris traitées [17]. La recherche d’une synergie avec un blocage des checkpoints immunitaires comme CTLA4 (cytotoxic T-lymphocyte-associated protein 4) et PD1 (programmed cell death 1) serait particulièrement intéressante étant donnés les résultats obtenus dans le traitement des cancers chez l’homme fondés sur des molécules inhibant cette voie [45, 46] (→).
(→) Voir l’Éditorial de J.L. Teillaud, m/s n° 8-9, août-septembre 2015, page 707, et l’article Prix Lasker 2015 de J.L. Teillaud, m/s n° 1, janvier 2016, page 121
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Kaplan MH, Hufford MM, Olson MR. The development and in vivo function of T helper 9 cells . Nat Rev Immunol. 2015; ; 15 : :295.–307. 2.
Schmitt E, Germann T, Goedert S, et al. IL-9 production of naive CD4+ T cells depends on IL-2, is synergistically enhanced by a combination of TGF-beta and IL-4, and is inhibited by IFN-gamma . J Immunol. 1994; ; 153 : :3989.–3996. 3.
Bassil R, Orent W, Olah M, et al. BCL6 controls Th9 cell development by repressing Il9 transcription . J Immunol. 2014; ; 193 : :198.–207. 4.
Brustle A, Heink S, Huber M, et al. The development of inflammatory T(H)-17 cells requires interferon-regulatory factor 4 . Nat Immunol. 2007; ; 8 : :958.–966. 5.
Jabeen R, Goswami R, Awe O, et al. Th9 cell development requires a BATF-regulated transcriptional network . J Clin Invest. 2013; ; 123 : :4641.–4653. 6.
Staudt V, Bothur E, Klein M, et al. Interferon-regulatory factor 4 is essential for the developmental program of T helper 9 cells . Immunity. 2010; ; 33 : :192.–202. 7.
Chang HC, Sehra S, Goswami R, et al. The transcription factor PU.1 is required for the development of IL-9-producing T cells and allergic inflammation . Nat Immunol. 2010; ; 11 : :527.–534. 8.
Goswami R, Kaplan MH. Gcn5 is required for PU.1-dependent IL-9 induction in Th9 cells . J Immunol. 2012; ; 189 : :3026.–3033. 9.
Yang XO, Zhang H, Kim BS, et al. The signaling suppressor CIS controls proallergic T cell development and allergic airway inflammation . Nat Immunol. 2013; ; 14 : :732.–740. 10.
Veldhoen M, Uyttenhove C, van Snick J, et al. Transforming growth factor-beta ‘reprograms’ the differentiation of T helper 2 cells and promotes an interleukin 9-producing subset . Nat Immunol. 2008; ; 9 : :1341.–1346. 11.
Dardalhon V, Awasthi A, Kwon H, et al. IL-4 inhibits TGF-beta-induced Foxp3+ T cells and together with TGF-beta, generates IL-9+ IL-10+ Foxp3- effector T cells . Nat Immunol. 2008; ; 9 : :1347.–1355. 12.
Tamiya T, Ichiyama K, Kotani H, et al. Smad2/3 and IRF4 play a cooperative role in IL-9-producing T cell induction . J Immunol. 2013; ; 191 : :2360.–2371. 13.
Wang W, Wang X, Chun J, et al. Inflammasome-independent NLRP3 augments TGF-beta signaling in kidney epithelium . J Immunol. 2013; ; 190 : :1239.–1249. 14.
Kim IK, Kim BS, Koh CH, et al. Glucocorticoid-induced tumor necrosis factor receptor-related protein co-stimulation facilitates tumor regression by inducing IL-9-producing helper T cells . Nat Med. 2015; ; 21 : :1010.–1017. 15.
Park J, Li H, Zhang M, et al. Murine Th9 cells promote the survival of myeloid dendritic cells in cancer immunotherapy . Cancer Immunol Immunother. 2014; ; 63 : :835.–845. 16.
Jager A, Dardalhon V, Sobel RA, et al. Th1, Th17, and Th9 effector cells induce experimental autoimmune encephalomyelitis with different pathological phenotypes . J Immunol. 2009; ; 183 : :7169.–7177. 17.
Vegran F, Berger H, Boidot R, et al. The transcription factor IRF1 dictates the IL-21-dependent anticancer functions of TH9 cells . Nat Immunol. 2014; ; 15 : :758.–766. 18.
Wong MT, Ye JJ, Alonso MN, et al. Regulation of human Th9 differentiation by type I interferons and IL-21 . Immunol Cell Biol. 2010; ; 88 : :624.–631. 19.
Ma L, Xue HB, Guan XH, et al. Possible pathogenic role of T helper type 9 cells and interleukin (IL)-9 in atopic dermatitis . Clin Exp Immunol. 2014; ; 175 : :25.–31. 20.
Longphre M, Li D, Gallup M, et al. Allergen-induced IL-9 directly stimulates mucin transcription in respiratory epithelial cells . J Clin Invest. 1999; ; 104 : :1375.–1382. 21.
Forbes EE, Groschwitz K, Abonia JP, et al. IL-9- and mast cell-mediated intestinal permeability predisposes to oral antigen hypersensitivity . J Exp Med. 2008; ; 205 : :897.–913. 22.
Kearley J, Buckland KF, Mathie SA, Lloyd CM. Resolution of allergic inflammation and airway hyperreactivity is dependent upon disruption of the T1/ST2-IL-33 pathway . Am J Respir Crit Care Med. 2009; ; 179 : :772.–781. 23.
Borish L, Aarons A, Rumbyrt J, et al. Interleukin-10 regulation in normal subjects and patients with asthma . J Allergy Clin Immunol. 1996; ; 97 : :1288.–1296. 24.
Gerlach K, Hwang Y, Nikolaev A, et al. TH9 cells that express the transcription factor PU.1 drive T cell-mediated colitis via IL-9 receptor signaling in intestinal epithelial cells . Nat Immunol. 2014; ; 15 : :676.–686. 25.
Singh TP, Schon MP, Wallbrecht K, et al. Involvement of IL-9 in Th17-associated inflammation and angiogenesis of psoriasis . PLoS One. 2013; ; 8 : :e51752.. 26.
Zhou Y, Sonobe Y, Akahori T, et al. IL-9 promotes Th17 cell migration into the central nervous system via CC chemokine ligand-20 produced by astrocytes . J Immunol. 2011; ; 186 : :4415.–4421. 27.
Kara EE, Comerford I, Bastow CR, et al. Distinct chemokine receptor axes regulate Th9 cell trafficking to allergic and autoimmune inflammatory sites . J Immunol. 2013; ; 191 : :1110.–1117. 28.
Anuradha R, George PJ, Hanna LE, et al. IL-4-, TGF-beta-, and IL-1-dependent expansion of parasite antigen-specific Th9 cells is associated with clinical pathology in human lymphatic filariasis . J Immunol. 2013; ; 191 : :2466.–2473. 29.
Faulkner H, Humphreys N, Renauld JC, et al. Interleukin-9 is involved in host protective immunity to intestinal nematode infection . Eur J Immunol. 1997; ; 27 : :2536.–2540. 30.
Faulkner H, Renauld JC, Van Snick J, Grencis RK. Interleukin-9 enhances resistance to the intestinal nematode Trichuris muris . Infect Immun. 1998; ; 66 : :3832.–3840. 31.
Licona-Limon P, Henao-Mejia J, Temann AU, et al. Th9 cells drive host immunity against gastrointestinal worm infection . Immunity. 2013; ; 39 : :744.–757. 32.
Purwar R, Schlapbach C, Xiao S, et al. Robust tumor immunity to melanoma mediated by interleukin-9-producing T cells . Nat Med. 2012; ; 18 : :1248.–1253. 33.
Lu Y, Hong S, Li H, et al. Th9 cells promote antitumor immune responses in vivo . J Clin Investig. 2012; ; 122 : :4160.–4171. 34.
Kruger-Krasagakes S, Krasagakis K, Garbe C, et al. Expression of interleukin 10 in human melanoma . Br J Cancer. 1994; ; 70 : :1182.–1185. 35.
Howell WM, Turner SJ, Bateman AC, Theaker JM. IL-10 promoter polymorphisms influence tumour development in cutaneous malignant melanoma . Genes Immun. 2001; ; 2 : :25.–31. 36.
Liu JQ, Li XY, Yu HQ, et al. Tumor-specific Th2 responses inhibit growth of CT26 colon-cancer cells in mice via converting intratumor regulatory T cells to Th9 cells . Sci Rep. 2015; ; 5 : :10665.. 37.
Noelle RJ, Nowak EC. Cellular sources and immune functions of interleukin-9 . Nat Rev Immunol. 2010; ; 10 : :683.–687. 38.
Lu Y, Hong B, Li H, et al. Tumor-specific IL-9-producing CD8+ Tc9 cells are superior effector than type-I cytotoxic Tc1 cells for adoptive immunotherapy of cancers . Proc Natl Acad Sci USA. 2014; ; 111 : :2265.–2270. 39.
Fang Y, Chen X, Bai Q, et al. IL-9 inhibits HTB-72 melanoma cell growth through upregulation of p21 and TRAIL . J Surg Oncol. 2015; ; 111 : :969.–974. 40.
Lemoli RM, Fortuna A, Tafuri A, et al. Interleukin-9 in human myeloid leukemia cells . Leuk Lymphoma. 1997; ; 26 : :563.–573. 41.
Hoelzinger DB, Dominguez AL, Cohen PA, Gendler SJ. Inhibition of adaptive immunity by IL9 can be disrupted to achieve rapid T-cell sensitization and rejection of progressive tumor challenges . Cancer Res. 2014; ; 74 : :6845.–6855. 42.
Davis MR, Zhu Z, Hansen DM, et al. The role of IL-21 in immunity and cancer . Cancer letters. 2015; ; 358 : :107.–114. 43.
Croce M, Rigo V, Ferrini S. IL-21: a pleiotropic cytokine with potential applications in oncology . J Immunol Res. 2015; ; 2015 : :696578.. 44.
Julia V, Staumont-Salle D, Dombrowicz D. Rôle de la fractalkine/CX3CL1 et de son récepteur CX3CR1 dans les pathologies allergiques . Med Sci (Paris). 2016; ; 32 : :260.–266. 45.
Teillaud JL. Quand les anticorps rencontrent l’immunité antitumorale : fin de partie pour la cellule cancéreuse ? Med Sci (Paris). 2015; ; 31 : :707.–708. 46.
Teillaud JL. L’homme qui a fait sauter le verrou de la réponse immune adaptative anti-tumorale . Med Sci (Paris). 2016; ; 32 : :121.–122. |