| |
| Med Sci (Paris). 32(4): 326–328. doi: 10.1051/medsci/20163204005.L’association fait le poison Nouveau regard sur l’effet cocktail des xénobiotiques et les interactions médicamenteuses Vanessa Delfosse,1* Patrick Balaguer,2 and William Bourguet1 1Centre de Biochimie Structurale, Inserm U1054, CNRS, UMR 5048, Université de Montpellier, 29, rue de Navacelles, 34090Montpellier, France 2Institut de Recherche en Cancérologie de Montpellier, Inserm U1194, Institut Régional du Cancer de Montpellier, Université de Montpellier, 34298Montpellier, France MeSH keywords: Interactions médicamenteuses, Humains, Modèles moléculaires, Toxiques, Récepteurs cytoplasmiques et nucléaires, Récepteurs aux stéroïdes, Xénobiotique, synthèse chimique, composition chimique, physiologie, administration et posologie, intoxication |
Les organismes vivants sont constamment exposés à de multiples composés chimiques exogènes, appelés xénobiotiques. Cette exposition, active ou passive, se fait au travers de l’alimentation, de la médication, ou encore de l’utilisation de produits domestiques ou industriels. Certaines de ces molécules, connues sous le nom de perturbateurs endocriniens, sont capables d’altérer le fonctionnement normal du système hormonal, ayant ainsi des effets néfastes sur la santé humaine [1, 2] (→).
(→) Voir la Synthèse de C. Mauduit et al., m/s n° 1, janvier 2016, page 45
La plupart des perturbateurs endocriniens sont des composés de synthèse tels que les bisphénols et les phtalates (retrouvés dans les plastiques, les cosmétiques), les parabènes (agents antibactériens utilisés comme conservateurs dans les cosmétiques), les dioxines (polluants organiques persistants produits lors de processus de combustion), les alkylphénols (présents dans les détergents, les résines), les organoétains (biocides principalement utilisés dans les peintures marines), certains pesticides ou encore des médicaments comme le distilbène [3] (→).
(→) Voir la Synthèse de B. Le Magueresse-Battistoni et al., m/s n° 1, janvier 2016, page 51
Cependant, d’autres perturbateurs endocriniens sont naturels et peuvent être trouvés dans les plantes et les champignons (phyto- et myco-œstrogènes par exemple). Ces molécules agissent comme des leurres hormonaux et sont très fortement soupçonnées d’être à l’origine de troubles du développement, de la reproduction ou du métabolisme (obésité, diabète), et même de cancers [2–5]. Au-delà de leurs effets individuels, il était également pressenti que l’activité biologique de ces composés, lorsqu’ils sont contenus dans des mélanges, pouvait être très différente de celle observée pour les molécules testées isolément. Une étude récente vient de confirmer expérimentalement ce phénomène, connu sous le nom « d’effet cocktail », et propose un mécanisme moléculaire qui pourrait expliquer une partie des effets à faibles doses des perturbateurs endocriniens ainsi que certaines interactions médicamenteuses [6]. Ces résultats ont donc des implications importantes pour les domaines de la réglementation et de l’évaluation des risques chimiques, ainsi que celui de la prescription médicale, et des changements dans ces domaines sont maintenant attendus. |
Récepteurs nucléaires-xénobiotiques, les liaisons dangereuses L’une des principales cibles des xénobiotiques sont les récepteurs nucléaires d’hormones. Ces protéines, au nombre de 48 chez l’homme, constituent une famille importante de facteurs de transcription ligand-dépendants, jouant un rôle essentiel dans le développement, ainsi que dans tous les aspects métaboliques et physiologiques chez les métazoaires. Sous l’effet de la liaison d’un ligand (comme une hormone, une vitamine, un métabolite, etc.), ces récepteurs vont agir au niveau des régions promotrices de leurs gènes cibles en recrutant des corégulateurs de la transcription [7]. Les récepteurs nucléaires régulent ainsi l’expression génique en réponse à un signal hormonal et ce d’une manière finement contrôlée dans le temps et dans l’espace. Comme leur nom l’indique, les perturbateurs endocriniens vont dérégler ce processus de signalisation en mimant l’action des hormones, pouvant ainsi provoquer des troubles métaboliques et physiologiques importants. Il s’agit d’un mimétisme moléculaire, certains xénobiotiques étant capables de se lier aux récepteurs nucléaires en lieu et place des ligands naturels via des mécanismes qui commencent à être décryptés [8, 9]. |
Dans leur très grande majorité, les études visant à évaluer la toxicité des xénobiotiques sont menées sur les composés pris isolément. Cependant, nous sommes quotidiennement exposés à des mélanges de molécules différentes qui peuvent agir de façon additive, antagoniste ou synergique. Autrement dit, une substance exogène qui aurait peu ou pas d’activité hormonale verrait ses effets potentialisés par la présence d’une ou plusieurs autres substances. Cet « effet cocktail » est depuis longtemps fortement suspecté dans le domaine de la perturbation endocrinienne mais les mécanismes moléculaires qui le sous-tendent demeuraient jusqu’à présent obscurs. Les travaux récents menés sur le récepteur nucléaire pregnane X receptor (PXR)1, ont permis de mettre en évidence un des mécanismes possibles pour l’action synergique des xénobiotiques, à savoir la liaison concomitante de plusieurs molécules différentes au sein de la poche de liaison d’un même récepteur nucléaire, corrélée à une activation accrue du récepteur [6]. |
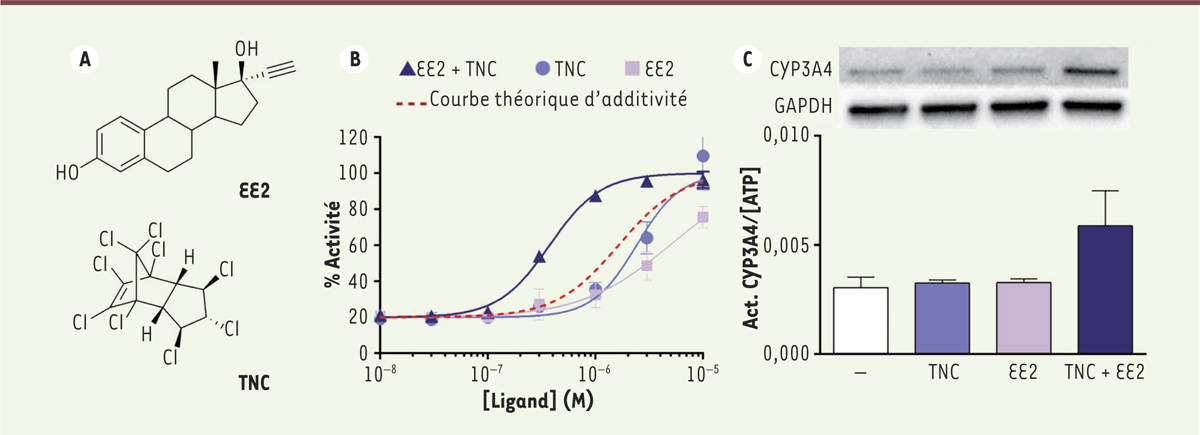
Comment les xénobiotiques peuvent-ils s’associer pour être plus toxiques ? Cette étude combine de façon originale des approches complémentaires de biologie cellulaire, de biologie structurale et de caractérisations biophysiques en solution. Dans un premier temps, un criblage croisé de 40 substances (médicaments, pesticides, produits chimiques industriels, etc. ; soit 780 combinaisons à deux partenaires) testant l’activité transcriptionnelle du récepteur PXR, révèle une action plus qu’additive du couple éthinylestradiol (EE2)/ trans-nonachlore (TNC). Le premier composé, l’EE2, est l’œstrogène de synthèse le plus utilisé au monde et l’un des deux composés actifs des pilules contraceptives combinées ; le second, le TNC, est un composant du chlordane, un pesticide organochloré persistant, connu pour être l’un des douze polluants majeurs à l’échelle mondiale (Figure 1A). Les mesures d’activité des composés, seuls ou en mélange, dans différentes lignées cellulaires et cultures d’hépatocytes primaires humains, montrent, en effet, une action synergique des deux molécules sur la stimulation de l’activité transcriptionnelle de PXR (Figure 1B) et l’expression du cytochrome P450 3A4, un gène endogène cible de ce récepteur, essentiel pour la métabolisation de substances endogènes et exogènes (Figure 1C). Ces expériences indiquent que le mélange binaire est capable d’induire une réponse biologique significative à des doses auxquelles les deux composés sont individuellement inactifs.
 | Figure 1.
L’EE2 et le TNC activent PXR de façon synergique. A. Structures chimiques de l’éthinylestradiol (EE2) et du trans-nonachlore (TNC). B..Courbes dose-réponse montrant l’activité transcriptionnelle de PXR (Pregnane X Receptor) en présence de l’EE2 et du TNC, seuls ou en mélange. La courbe en pointillés rouges correspond à l’activité prédite pour le mélange dans le cas d’un effet additif. C. Quantification du taux de production du cytochrome P450 3A4 (CYP3A4) par western-blot (comparé à un contrôle, le GAPDH) et de son activité enzymatique dans des cultures primaires d’hépatocytes humains. GAPDH : glycéraldéhyde-3-phosphate déshydrogénase. |
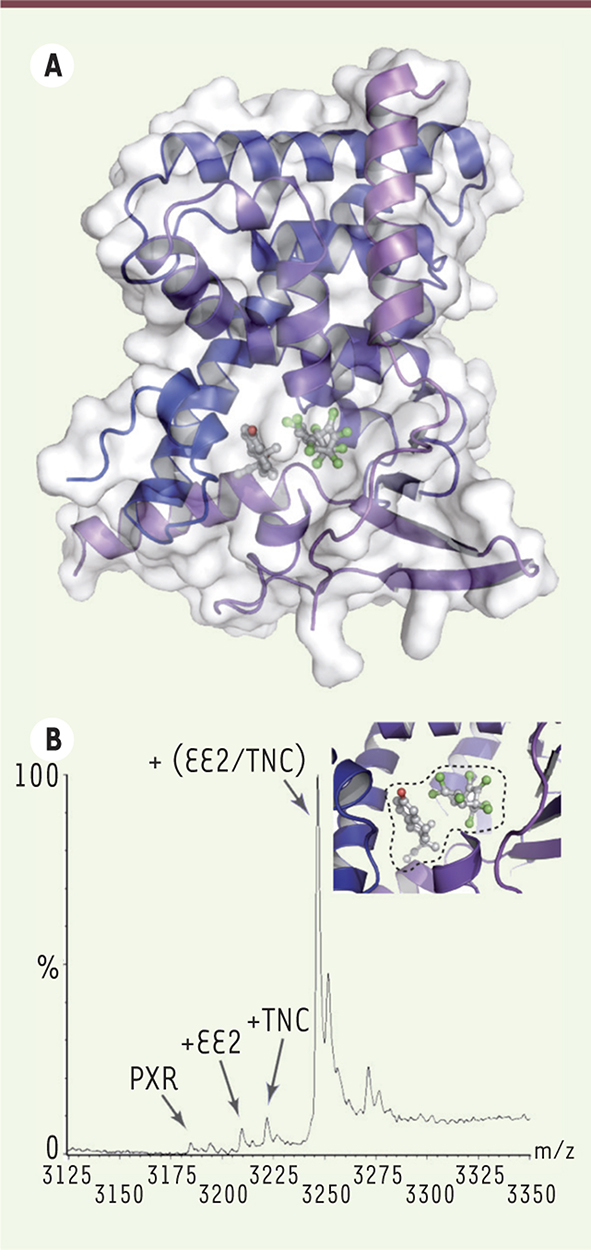
Des analyses structurales (par cristallographie aux rayons X) et biophysiques ont ensuite été menées afin de mieux appréhender les bases moléculaires et structurales de l’effet cocktail observé. Elles montrent clairement une stabilisation réciproque des deux molécules dans la poche de liaison du récepteur (Figure 2A). Ensemble, les deux composés interagissent pour former un ligand supramoléculaire qui occupe totalement la cavité et forme davantage d’interactions avec celle-ci que les molécules seules. Cette augmentation du nombre et de la force des contacts protéine/ligand permet de stabiliser plus efficacement la forme transcriptionnellement active du récepteur, et d’accroître très significativement l’affinité apparente de liaison du ligand supramoléculaire au récepteur. Des expériences de microcalorimétrie et de spectrométrie de masse (Figure 2B) révèlent en effet une coopérativité de liaison qui permet à chacun des composés d’accroître la capacité de liaison du second, avec une augmentation globale de l’affinité du ligand supramoléculaire pour le récepteur d’un facteur 50 à 100 par rapport à ses composants pris isolément. Ainsi, bien que très peu actifs par eux-mêmes, l’EE2 et le TNC sont capables de se fixer simultanément au récepteur PXR et de l’activer de façon synergique, avec potentiellement des répercussions physiopathologiques importantes, comme par exemple, une augmentation de la chimiorésistance [10] ou de l’agressivité de certains cancers [11].
 | Figure 2.
L’EE2 et le TNC se stabilisent mutuellement dans la poche de liaison de PXR. A. Structure entière du domaine de liaison du ligand du récepteur PXR (pregnane X receptor) en complexe avec l’EE2 (éthinylœstradiol) et le TNC (trans-nonachlore). B. Spectre de masse en conditions natives du complexe ternaire PXR/EE2-TNC et zoom sur la poche de liaison de PXR où se lient les deux molécules formant un ligand supramoléculaire (encerclé de pointillés noirs). Le spectre montre une affinité du mélange pour PXR bien supérieure à celles des molécules isolées. Ce spectre représente l’abondance relative des différents complexes (%) en fonction de leur rapport masse/charge (m/z). |
|
Ces résultats novateurs constituent une preuve de concept qui ouvre la voie à un large champ d’études. Il existe en effet dans notre environnement plus de 150 000 composés dont l’action combinée pourrait avoir des effets inattendus sur la santé humaine au regard de leur innocuité reconnue ou supposée en tant que substances isolées. Les approches intégratives telles que celles utilisées dans l’article présenté ici [6] permettent de mieux comprendre les mécanismes moléculaires mis en jeu dans la perturbation endocrinienne et, en particulier, dans les effets de mélange, mais également de développer des outils bio-informatiques de prédiction de l’activité hormonale potentielle des xénobiotiques. Ainsi, ces résultats auront le potentiel d’influer sur les méthodes d’évaluation des risques des xénobiotiques mais également d’orienter le développement de composés chimiques plus sûrs. L’étude réalisée sur PXR met également en évidence un mécanisme possible d’interaction médicamenteuse. De nombreux médicaments tels que la rifampicine (un antibiotique), l’hyperforine (un antidépresseur), la carbamazépine (un antiépileptique) ou encore l’éthinylestradiol, l’estradiol et la mifépristone (des stéroïdes) sont des activateurs de faible affinité du récepteur PXR. L’activation synergique de PXR par des combinaisons de médicaments, avec comme conséquence l’activation des gènes impliqués dans la détoxication de l’organisme (métabolisme, conjugaison, efflux), pourrait diminuer, voire annuler, l’efficacité du ou des traitements administrés, ou encore perturber l’homéostasie des hormones endogènes. Ainsi, l’évaluation de l’action de molécules thérapeutiques en mélange sur l’activité du récepteur PXR pourrait permettre d’expliquer certaines interactions médicamenteuses connues mais également d’en révéler de nouvelles. |
Les auteurs déclarent n’avoir aucun conflit d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Diamanti-Kandarakis E, Bourguignon JP, Giudice LC, et al. Endocrine-disrupting chemicals : an Endocrine Society scientific statement . Endocr Rev. 2009; ; 30 : :293.–342. 2.
Mauduit C, Siddeek B, Benahmed M. Origine développementale et environnementale de l’infertilité masculine : rôle des perturbateurs hormonaux . Med Sci (Paris). 2016; ; 32 : :45.–50. 3.
Le Magueresse-Battistoni B, Vidal H, Naville D. Exposition maternelle aux polluants et altération de la santé métabolique à l’âge adulte . Med Sci (Paris). 2016; ; 32 : :51.–56. 4.
De Coster S, van Larebeke N. Endocrine-disrupting chemicals : associated disorders and mechanisms of action . J Environ Public Health. 2012; ; 2012 : :713696.. 5.
Schug TT, Janesick A, Blumberg B, Heindel JJ. Endocrine disrupting chemicals and disease susceptibility . J Steroid Biochem Mol Biol. 2011; ; 127 : :204.–215. 6.
Delfosse V, Dendele B, Huet T, et al. Synergistic activation of human pregnane X receptor by binary cocktails of pharmaceutical and environmental compounds . Nat Commun. 2015; ; 6 : :8089.. 7.
Germain P, Staels B, Dacquet C, et al. Overview of nomenclature of nuclear receptors . Pharmacol Rev. 2006; ; 58 : :685.–704. 8.
Delfosse V, le Maire A, Balaguer P, Bourguet W. A structural perspective on nuclear receptors as targets of environmental compounds . Acta Pharmacol Sin. 2015; ; 36 : :88.–101. 9.
Delfosse V, Grimaldi M, Cavailles V, et al. Structural and functional profiling of environmental ligands for estrogen receptors . Environ Health Perspect. 2014; ; 122 : :1306.–1313. 10.
Raynal C, Pascussi JM, Leguelinel G, et al. Pregnane X receptor (PXR) expression in colorectal cancer cells restricts irinotecan chemosensitivity through enhanced SN-38 glucuronidation . Mol Cancer. 2010; ; 9 : :46.. 11.
Wang H, Venkatesh M, Li H, et al. Pregnane X receptor activation induces FGF19-dependent tumor aggressiveness in humans and mice . J Clin Invest. 2011; ; 121 : :3220.–3232. |