| |
| Med Sci (Paris). 2016 March; 32(3): 281–289. Published online 2016 March 23. doi: 10.1051/medsci/20163203013.L’autophagie et l’homéostasie des lymphocytes T et B Bien recycler pour un développement durable Johan Arnold,1* Diane Murera,1 Florent Arbogast,1 Sylviane Muller,1,2 and Frédéric Gros1,3 1CNRS, immunopathologie et chimie thérapeutique, laboratoire d’excellence MEDALIS, institut de biologie moléculaire et cellulaire, 15, rue Descartes, 67084Strasbourg, France 2Université de Strasbourg, institut d’études avancées (USIAS), Strasbourg, France 3Université de Strasbourg, Strasbourg, France |
Vignette (photo © Inserm-Baptiste Jammart). L’autophagie est un mécanisme catabolique complexe issu de la formation en amont dans le cytoplasme de vésicules à double membrane qui fusionnent en aval avec des lysosomes (Figure 1) [1] (→).
(→) Voir la Nouvelle de P. Codogno, m/s n° 8-9, août-septembre 2004, page 734
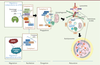 | Figure 1.
La machinerie moléculaire de l’autophagie. L’autophagie peut être induite par des signaux liés à un stress énergétique (voie dépendant de mTOR) mais également par d’autres stimulus (voies indépendantes de mTOR) comme les dommages à l’ADN, la signalisation via la voie JNK (c-Jun N-terminal kinase) ou encore l’action de la protéine Bcl2 (B-cell lymphoma 2). L’autophagie se déroule en trois grandes étapes : le recrutement de la membrane, grâce au complexe ATG9a (autophagy related 9A) qui permet d’initier la formation d’un phagophore (vésicule initialement formée dans le contexte de l’autophagie) avec le concours des complexes ULK1 (unc-51-like kinase 1) et Beclin1 (correspondant à la nucléation). L’étape d’élongation, faisant intervenir les complexes ATG5-ATG12/ATG16L1 et LC3 (microtubule-associated protein-light chain 3), permet alors de former une vésicule close à double membrane (l’autophagosome) qui séquestre le matériel cytoplasmique. L’étape de maturation, au cours de laquelle l’autophagosome fusionne avec les lysosomes contenant des hydrolases acides, grâce à l’action des protéines HOP (homotypic fusion and protein sorting), PLEKHM1 (pleckstrin homology domain containing protein family member 1) et du cytosquelette, mène enfin à la dégradation du contenu cytoplasmique de la vésicule. Du contenu cytosolique, des mitochondries endommagées, du réticulum endoplasmique et des gros agrégats protéiques peuvent être pris en charge par la machinerie autophagique. Le complexe ULK1, nécessaire à l’initiation de l’autophagie, contient les kinases ULK1, ATG101, FIP200 (FAK family kinase-interacting protein of 200 kDa) et ATG13. Ce complexe sert au recrutement de la membrane isolée, avec l’aide de la protéine ATG9a, permettant la mise en place du phagophore. Ces protéines régulent un autre complexe majeur impliqué dans la formation du phagophore, à savoir le complexe Beclin1/VPS34 (vacuolar protein-sorting 34)/VPS15. La machinerie d’élongation est composée de deux systèmes de conjugaison, à savoir les systèmes ATG12 et LC3 (microtubule-associated protein-light chain 3). Ils sont incorporés dans les membranes de l’autophagosome sous la forme d’un complexe ATG12-ATG5/ATG16L1 et sous forme lipidée pour LC3 après incorporation d’une phosphatidyléthanolamine (LC3-PE ou LC3-II). La maturation est la dernière étape de formation de l’autophagosome. L’adressage de ces deux vésicules, autophagosome et lysosome, est réalisé entre autres par des protéines SNARE (soluble N-ethylmaleimide-sensitive factor attachment protein receptor)/Rab (Ras-related in brain) et les composants du cytosquelette tels que l’actine. La fusion en elle-même est réalisée par l’interaction du complexe PLEKHM1/HOP avec la protéine LC3. Ce complexe qui interagit avec Rab7, forme un ensemble qui permet la fusion entre l’autophagosome et les lysosomes. Cette fusion crée une vésicule appelée autolysosome dans laquelle sera dégradé le contenu cytoplasmique séquestré. AMPK : AMP [adénosine monophosphate]-activated protein kinase ; PI3P : phosphatidylinositol-3-phosphate. |
L’autophagie induite par un stress énergétique favorise la survie des cellules. Une activité autophagique basale permet en outre l’élimination des gros agrégats protéiques et des organites altérés [1]. Ce rôle est particulièrement important dans les cellules à longue durée de vie comme les neurones. La machinerie autophagique est composée d’une trentaine de gènes appelés ATG pour autophagy-related genes [2]. Cette appellation souligne le fait que les protéines ATG peuvent intervenir dans d’autres processus que l’autophagie, notamment dans la régulation de la mort cellulaire, l’exocytose ou certaines formes d’endocytose [3]. L’autophagie, basale ou induite, joue des rôles spécialisés en fonction des compartiments physiologiques considérés. En particulier, l’implication de l’autophagie dans l’immunité a été dévoilée au cours de la dernière décennie [4]. La dégradation de composants intracellulaires par autophagie permet en effet l’élimination de microorganismes viraux ou bactériens par un mécanisme appelé xénophagie1 [5, 6] (→).
(→) Voir la Synthèse de P.E. Joubert et al., m/s n° 1, janvier 2011, page 4
L’autophagie permet également de réguler l’inflammation en limitant la sécrétion de cytokines pro-inflammatoires. Ce lien entre autophagie et pathologies inflammatoires humaines est notamment illustré au cours de la maladie de Crohn2. En effet, des études génétiques ont révélé une association entre des polymorphismes affectant un des gènes ATG, ATG16L1, et le développement de cette maladie inflammatoire chronique [7, 8] (→).
(→) Voir la Nouvelle de A.L. Glasser et al., m/s n° 4, avril 2009, page 349
Dans ce cas, un déficit d’activité autophagique favorise l’inflammation. L’autophagie est également impliquée dans la présentation des antigènes par le complexe majeur d’histocompatibilité de classe II (CMH-II) [9]. Par son rôle dans les processus inflammatoires et la présentation antigénique, elle participe ainsi à l’activation de l’immunité adaptative. L’autophagie intrinsèque des lymphocytes joue également un rôle important dans la biologie de ces cellules. |
Autophagie et développement des lymphocytes La première étude s’intéressant au rôle de l’autophagie dans les lymphocytes a été publiée par Heather Pua [10], à partir de modèles murins de délétion du gène Atg5. Cette délétion étant létale à la naissance, lorsqu’elle est systémique, les auteurs ont utilisé des souris chimériques établies à partir de cellules de foie fœtal, isolées de souris déficientes pour le gène Atg5, transférées chez des animaux Rag1
-/-dépourvus de LT et LB. Une baisse importante du nombre de LT et LB en périphérie a été observée (Figure 2). Dans le cas des LT, il n’apparaît pas de changement dans la répartition des sous-populations de thymocytes, mais une baisse de leur nombre. D’autres études se sont intéressées au rôle de l’autophagie des LT grâce à des modèles de délétion plus tardifs [11, 12]. Ainsi, en utilisant le promoteur proximal du gène lck (lymphocyte-specific protein tyrosine kinase), exprimé tôt lors du développement thymique, ce qui permet d’invalider l’autophagie seulement à partir de ce stade, les auteurs ont observé une baisse de cellularité au niveau du thymus mais également en périphérie. L’autophagie joue donc un rôle dans le développement des thymocytes et aussi lors de leur migration vers la périphérie. Elle favorise l’élimination des mitochondries endommagées. De manière intéressante, les thymocytes, avant de migrer en périphérie, réduisent leur nombre de mitochondries. L’absence d’élimination des mitochondries par les thymocytes déficients en ATG5 conduirait à une accumulation d’espèces réactives de l’oxygène (ROS), ce qui favoriserait l’apoptose des cellules en périphérie. Récemment, il a été montré que, contrairement aux lymphocytes T impliqués dans l’immunité adaptative, les cellules invariantes NKT3 requéraient une autophagie compétente dès le développement thymique [13], ce qui souligne l’existence d’une transition de métabolisme très précoce pour ces lymphocytes de l’immunité innée.
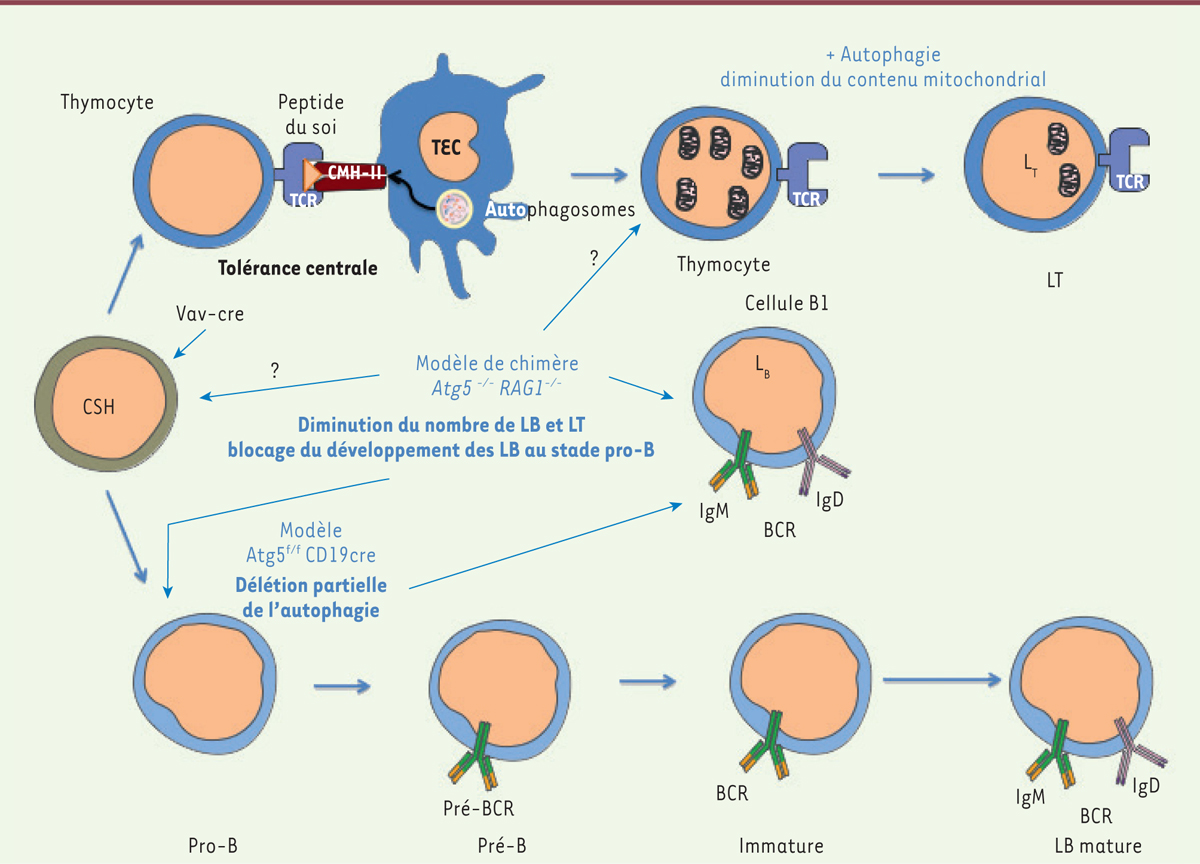
 | Figure 2.
Implication de l’autophagie dans le développement des lymphocytes T et B. L’autophagie est nécessaire à la survie et à la différenciation des cellules souches hématopoïétiques (CSH)[ 16]. Le transfert de cellules de foie fœtal de souris déficientes pour Atg5 chez des souris dépourvues de lymphocytes provoque, outre une forte perte de thymocytes, une forte baisse du nombre de LT et LB en périphérie [ 10, 14]. Les cellules épithéliales thymiques (TEC) présentent un niveau élevé d’autophagie basale si on le compare à celui d’autres tissus. Cette activité autophagique permet la présentation de peptides du soi intracellulaires sur le CMH de classe II et intervient dans l’éducation des LT CD4 + [ 17, 20, 21]. Les LT déficients en autophagie depuis le développement thymique maintiennent une quantité de mitochondries importante lors de leur passage de la zone centrale vers la zone périphérique, les sensibilisant à l’apoptose [ 10, 12]. Les LB de souris chimères, générées à partir de cellules de foie fœtal déficientes pour Atg5, subissent un blocage développemental à partir du stade pro-B [ 14]. En revanche, le modèle murin de délétion d’ Atg5 sous le contrôle du promoteur CD19 exprimé à partir du stade pro-B ne montre pas un tel défaut. La délétion partielle pourrait expliquer ce phénomène. Dans ces souris, aucun défaut majeur dans la proportion des différentes populations de LB en périphérie n’est observé, à l’exception d’une diminution de la population de cellules B-1a du péritoine. BCR : B cell receptor ; TCR : T cell receptor ; CMH-II : complexe majeur d’histocompatibilité de classe II ; Ig : immunoglobuline ; LB : lymphocyte B ; LT : lymphocyte T. |
En utilisant le même modèle de souris chimères qui avait été développé par Pua et al., l’équipe de Virgin s’est intéressée en détail au rôle de l’autophagie dans le développement des LB [14, 15] (→).
(→) Voir la Synthèse de M. Hamze et al., m/s n° 10, octobre 2014, page 874
Ces auteurs ont ainsi relevé un défaut de développement dans la moelle osseuse des souris chimères lors de la transition du stade pro-B au stade pré-B, pouvant expliquer la baisse du nombre de LB en périphérie déjà observée par Pua et ses collègues. Les auteurs ont également généré une souris dont les LB sont spécifiquement déficients en autophagie dès le stade pro-B. De manière étonnante, ils ne retrouvent pas de blocage développemental. Le nombre de LB en périphérie est alors normal, à l’exception des cellules B-1a4, du péritoine qui sont fortement impactées par la perte de l’autophagie. Il est possible que, dans ce cas, la délétion conditionnelle d’Atg5 ne soit pas totale au stade pro-B et permette la survie des cellules au fil de leur développement. En effet, le promoteur (cd19) utilisé dans ce travail conduit l’expression de la recombinase cre. Son activité n’induit, dans beaucoup d’études, qu’une excision partielle du gène cible au sein des LB. Que ce soit pour les LB ou les LT, les défauts développementaux observés dans les souris chimères pourraient refléter des anomalies touchant des stades antérieurs à la séparation des lignées B et T. En effet, dans les souris chimères, ATG5 est absent des précurseurs hématopoïétiques, et ce dès le début de la vie embryonnaire. Il faut donc considérer que l’autophagie est nécessaire à la survie des cellules souches hématopoïétiques [16]. Dans les souris dont l’autophagie est invalidée au début de l’hématopoïèse (souris Vav-cre), on observe, entre autres défauts, une baisse drastique du nombre de LB et LT. Ainsi, même si l’autophagie semble clairement impliquée dans le développement des LT dans le thymus, son rôle dans la lignée B reste confus. Des modèles de délétion à différents stades de développement des LB, ou l’usage de modèles pleinement déficients en autophagie au stade pro-B pourront éclaircir l’implication de ce processus au cours du développement des LB. |
Autophagie et éducation des lymphocytes T Les cellules épithéliales du thymus (TEC) et les cellules dendritiques de la médulla thymique jouent un rôle prépondérant dans l’éducation des LT. Ces cellules sont impliquées dans la présentation aux LT de peptides du soi sur les molécules du CMH. Lors de la sélection positive, seules les cellules T possédant un récepteur (TCR) peu affin pour le complexe CMH/peptide survivent, assurant la restriction des TCR pour le CMH de l’individu. Lors de la sélection négative, les LT possédant un TCR qui reconnaît les complexes CMH/peptides du soi sont alors éliminés, limitant ainsi l’autoréactivité des lymphocytes. La nature des peptides présentés par le thymus est donc primordiale pour assurer la tolérance au soi. De manière intéressante, les TEC présentent une forte activité autophagique spontanée (Figure 2) [17]. L’autophagie permet la présentation de peptides d’origine intracellulaire par les molécules du CMH de classe II. Partant de ce constat, une première étude réalisée par Klein et ses collaborateurs a montré que la greffe d’un thymus totalement déficient en ATG5 compromettait l’éducation des LT lors du processus de sélection positive [17]. Ce défaut n’affecte que les LT CD4+ qui sont restreints au CMH-II, ce qui souligne le rôle particulier de l’autophagie dans la présentation par cette classe de CMH. À noter que les souris possédant un thymus déficient pour ATG5 développent des colites d’origine auto-immune. Une étude autrichienne a néanmoins remis en cause les travaux de L. Klein. Elle avance que les défauts observés initialement pouvaient être dus à des effets non-autophagiques d’ATG5, ou encore à une conséquence de l’absence d’autophagie dans des sous-types cellulaires autres que les cellules épithéliales [18]. Les résultats obtenus avec un modèle murin présentant une déficience conditionnelle en ATG7 dans l’épithélium thymique a conduit les auteurs à conclure que l’autophagie ne participait pas à l’éducation thymique. On peut cependant penser que dans ce modèle déficient en ATG7, une activité autophagique résiduelle permettrait l’éducation des LT. L’équipe de Klein a montré peu de temps après, grâce à un nouveau modèle de délétion conditionnelle, que l’autophagie des cellules épithéliales thymiques exprimant AIRE (autoimmune regulator) [19] (→), participait à la sélection négative via la présentation par le CMH de classe II [20]. Le rôle de l’autophagie du stroma thymique dans l’éducation des LT semble conforté par une étude récente. En effet, Schuster et ses collègues ont montré que le gène Clec16A, orthologue murin d’un gène humain de prédisposition à plusieurs maladies auto-immunes, régulait l’activité autophagique du thymus[21]. La diminution de l’expression de Clec16A chez la souris réduit l’activité autophagique de l’épithélium thymique. Chez la souris NOD (non-obese diabetic) qui développe un diabète auto-immun, une baisse de la pathogénicité des LT est observée après inhibition de l’expression de Clec16A. La modulation qualitative des peptides présentés lors de l’éducation thymique par l’autophagie permettrait donc de limiter la réponse auto-immune. Ces deux derniers résultats s’accordent pour établir un rôle primordial de l’autophagie du thymus dans la prévention de l’auto-immunité.
(→) Voir la Synthèse de N. Lopes et al., m/s n°8-9, août-septembre 2015, page 742
|
Le rôle de l’autophagie dans la survie et l’activation des lymphocytes Les modèles murins de délétion spécifique de l’autophagie des LT dès la différenciation thymique ont donc permis de mettre en évidence des anomalies liées à la charge en mitochondries. De fait, en absence d’autophagie, les LT matures présentent des défauts de survie à l’état basal, étant plus sensibles à l’apoptose (Figure 3) [10–12, 22, 23]. Après stimulation de leur TCR in vitro, ils présentent également une survie et une prolifération défectueuses. De fait, une accumulation du marqueur light chain 3-II (LC3-II), présent à la membrane des autophagosomes, est observée dans les LT dont le TCR a été stimulé par des anticorps, ou après traitements pharmacologiques qui activent les voies de signalisation liées à ce récepteur [10]. Plusieurs éléments justifient le rôle de l’autophagie dans l’activation des LT. Tout d’abord, elle permet à la cellule de répondre à la demande d’énergie qui résulte de la stimulation du TCR [24]. En réduisant le nombre de mitochondries non fonctionnelles, elle prévient de plus l’accumulation de ROS qui favorise l’apoptose [11, 12]. L’autophagie régule également le stress du réticulum endoplasmique (RE) en intervenant dans la dégradation sélective de ses membranes [22, 23]. Enfin, elle permet le catabolisme de procaspases désensibilisant ainsi les cellules à l’apoptose [25]. Un rôle de l’autophagie dans la polarisation des cellules T auxiliaires (Th) a également été rapporté [22, 23]. En effet, elle apparaît plus importante pour la survie des cellules Th1, Th2 et Th0 que pour celle des cellules Th17 [25] avec une plus forte induction dans les cellules Th2 que dans les cellules Th1 [26]. Dans tous les cas, des variations de métabolisme et de sensibilité à l’apoptose entre les différents types de cellules Th, pourraient être à l’origine de ce besoin différentiel en autophagie.
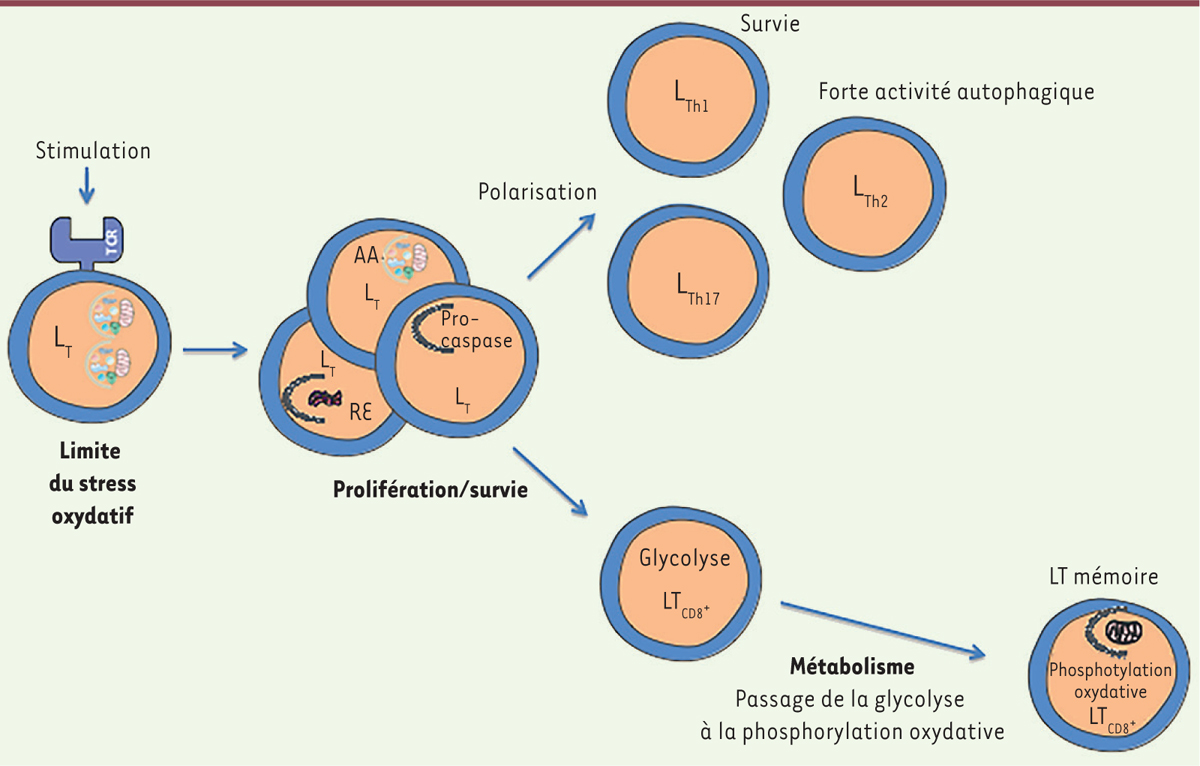
 | Figure 3.
Implication de l’autophagie dans la différenciation des lymphocytes T. L’autophagie est induite dans les LT lors de l’activation par le TCR (récepteur des cellules T) [ 10]. L’autophagie sélectionne les cargos à dégrader. On peut donc penser qu’en absence d’autophagie les défauts de prolifération et de survie observés en réponse à une stimulation du TCR, sont en partie dus à l’expansion du réticulum endoplasmique (RE) [ 22, 23] et de la masse mitochondriale [ 11, 12]. L’autophagie permet également de soutenir la demande métabolique en générant des acides aminés (AA) [ 24]. Enfin, elle permet de dégrader les pro-caspases [ 25]. Les cellules Th ( T helper) peuvent se différencier en plusieurs sous-types. Les premières études sur l’implication de l’autophagie dans la différenciation des LT auxiliaires ont montré que les cellules Th2 ont un taux d’autophagie plus élevé que les cellules Th1. Les sous-populations de lymphocytes Th1 et Th2 montrent une moins bonne survie que les Th17 après stimulation en absence d’autophagie. L’autophagie joue un rôle important dans l’évolution du métabolisme des LT CD8 + effectrices lors de leur transition en cellules mémoire [ 36, 37]. L’autophagie, dans ce cas, paraît nécessaire au maintien du métabolisme lié à l’oxydation des acides gras, probablement de par le contrôle du bon fonctionnement de l’activité mitochondriale. LT : lymphocyte T ; TCR : T cell receptor. |
Comme pour les LT, les premières études s’intéressant à l’autophagie dans les LB ont montré une induction de la formation d’autophagosomes après stimulation de leur récepteur à l’antigène, le BCR (B cell receptor) [27]. Cette activation a cependant été remise en question dans une étude plus récente [28] dont les résultats on été confirmés [29]. Quoi qu’il en soit, les données obtenues dans les modèles d’étude in vivo chez la souris ont conduit à une même conclusion : l’autophagie est peu impliquée dans la survie des LB en périphérie (à l’exception des cellules B-1a du péritoine) et dans leur activation initiale en réponse à la stimulation de leur récepteur (Figure 4) [14, 30, 31]. Il est en revanche probable qu’elle contribue à l’activation des LB dépendant des LT au cours de la présentation antigénique. L’autophagie favorise en effet la présentation d’antigènes cytosoliques du soi [32] ou d’antigènes viraux intracellulaires par le CMH-II [33]. Si aucune étude n’a montré la pertinence de ces observations in vivo, il apparaît néanmoins possible que l’autophagie, par la présentation antigénique aux LT CD4+ spécifiques d’antigènes intracellulaires, contribue à l’activation de LB autoréactifs ou spécifiques d’antigènes viraux. Cependant, des études récentes ont montré qu’elle n’était pas nécessaire à la présentation antigénique in vivo. En effet, la formation des centres germinatifs, après immunisation par des antigènes modèles ou lors d’une infection par le virus de la grippe, apparaît normale dans des souris dont les LB sont déficients en autophagie [30, 31]. Il faut cependant noter que dans le modèle d’infection par le virus de la grippe, l’antigène présenté ne peut être totalement qualifié d’endogène ou d’exogène, les antigènes viraux pouvant provenir soit de particules virales capturées par le BCR, soit du cytosol de la cellule infectée. La notion selon laquelle l’autophagie n’exercerait aucun rôle dans les étapes initiales de l’activation des LB nécessite donc de nouvelles études pour déterminer son éventuel rôle sélectif dans la présentation d’antigènes endogènes et exogènes. L’absence d’implication de l’autophagie paraîtrait cependant surprenante. En effet, la machinerie autophagique semble reliée au trafic intracellulaire du BCR qui, après internalisation, peut être colocalisé avec des structures à morphologie autophagosomale [34] et avec des molécules de la machinerie autophagique [29]. Cette convergence entre le trafic du BCR et les protéines impliquées dans l’autophagie permet sa translocation vers des compartiments cellulaires où est exprimé le récepteur de type Toll (toll-like receptor) TLR-9, un récepteur de l’immunité innée spécifique de l’ADN. Son interaction avec des antigènes contenant de l’ADN permettrait ainsi d’abaisser le seuil d’activation des LB après leur reconnaissance par le BCR. L’autophagie participe également à la citrullination5, des antigènes qui ont été internalisés par le BCR [29], les antigènes reconnus par le BCR étant transportés par la machinerie autophagique vers des compartiments cellulaires contenant la peptidyl arginine déiminase, l’enzyme responsable de la citrullination. Un rôle majeur de protéines de l’autophagie a également été mis en évidence dans certaines formes d’endocytose, comme la phagocytose assistée par LC3 (microtubule-associated protein light chain-3 [LC3]-associated phagocytosis) (LAP) dans laquelle la protéine autophagique LC3 est associée aux membranes des phagosomes. Elles pourraient participer à la présentation d’antigènes d’origine extracellulaire [35].
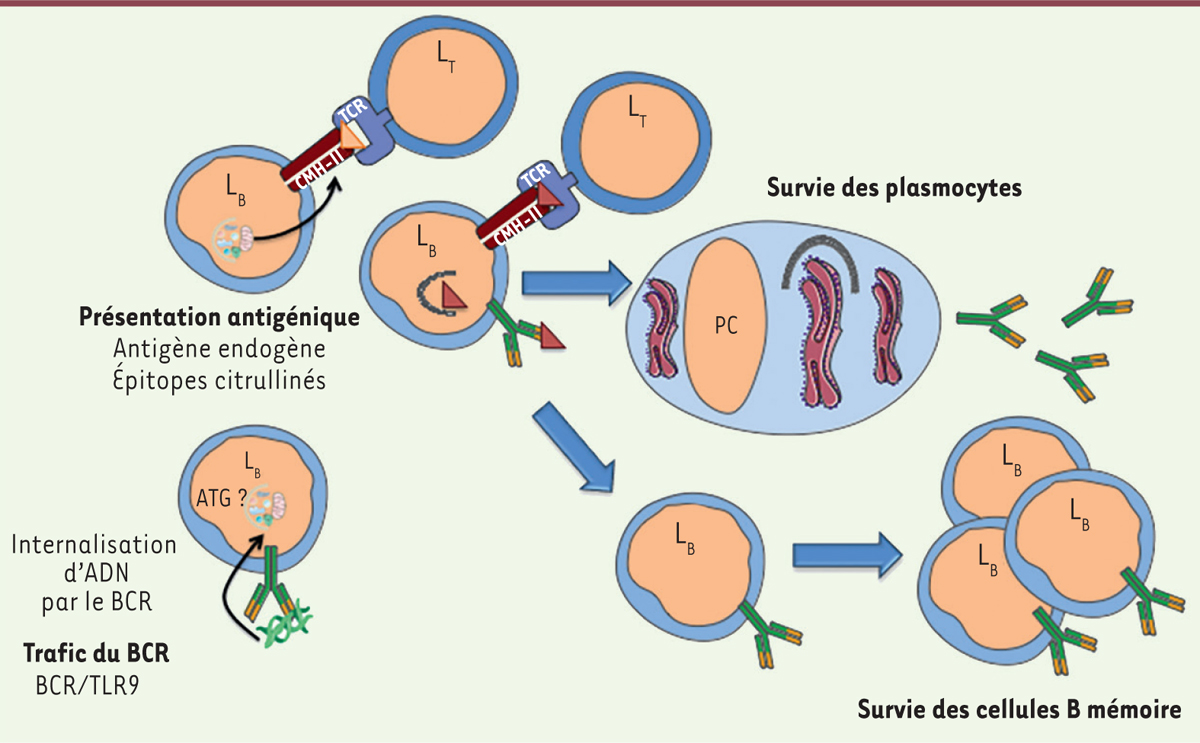
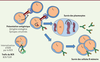 | Figure 4.
Implication de l’autophagie dans les lymphocytes B. Le BCR ( B cell receptor) internalisé colocalise avec des structures à morphologie autophagique, dans ce cas l’autophagie ou sa machinerie est requise pour la translocation de l’antigène vers des compartiments contenant le TLR9 ( toll-like receptor 9) [ 34]. De plus, l’autophagie dans les LB est nécessaire à la présentation d’épitopes endogènes [ 33] ou citrullinés provenant d’antigènes internalisés par le BCR [ 29]. L’activité autophagique augmente pendant la différenciation plasmocytaire. L’autophagie est nécessaire à la survie des plasmocytes [ 39], en régulant la quantité de réticulum endoplasmique (RE) [ 31]. L’autophagie peut également influencer la survie des LB mémoire et permettre la génération d’une réponse secondaire efficace [ 30]. L’autophagie n’est pas requise lors de l’initiation de la génération des LB mémoire mais pour leur maintien à long terme [ 51]. ATG : autophagy-related genes ; CMH-II : complexe majeur d’histocompatibilité de classe II ; PC : plasmocyte. |
|
L’autophagie et la fonction effectrice des lymphocytes L’importance de l’autophagie dans la survie à long terme des lymphocytes a été mise à jour par deux études récentes. Les équipes de Simon et d’Ahmed ont en effet montré que l’autophagie était indispensable au maintien des cellules T CD8+ mémoire (Figure 3) [36, 37]. Afin de résoudre les problèmes rencontrés dans les modèles que nous avons décrits plus haut pour la survie basale des LT déficients en autophagie, Ahmed et al. ont utilisé un modèle permettant l’inactivation de l’autophagie au seul stade effecteur des cellules T CD8+. De manière étonnante, dans ce modèle, l’autophagie n’a qu’un faible impact lors d’une première stimulation antigénique in vivo dans les premières heures d’activation en réponse à la signalisation du TCR, suggérant que l’accumulation du marqueur LC3-II qui avait été observée dans les précédentes études était en fait due à un blocage de la dégradation des autophagosomes plutôt qu’à une activation de l’autophagie. Des études sont donc encore nécessaires pour comprendre comment l’activation du TCR peut moduler la balance entre génération d’autophagosomes et dégradation lysosomale. En revanche, dans ces études in vivo, une induction nette de l’activité autophagique a été observée au moment de la transition des cellules vers le phénotype mémoire [37]. Il est ainsi possible que l’autophagie soit particulièrement importante lorsque les LT passent d’un métabolisme, dans les premières heures d’activation, qui ne sollicite pas la machinerie autophagique mais repose sur la glycolyse, à d’autres sources d’énergie. Ainsi, dans des cellules à longue durée de vie comme les cellules mémoires, l’autophagie permettrait le maintien d’une activité optimale de la phosphorylation oxydative, source principale d’énergie à ce stade de différenciation. Cette hypothèse est soutenue par une étude récente montrant l’implication des ROS dans la survie limitée de lymphocytes T CD8+ mémoires déficients pour l’autophagie [38]. En effet, l’autophagie permet le maintien d’une population de mitochondries fonctionnelles. Elle limiterait également l’accumulation d’agrégats protéiques et favoriserait de ce fait la survie à long terme des cellules mémoire. L’autophagie est également importante dans la différenciation des LB en cellules effectrices. En effet, Pengo et ses collaborateurs ont montré que, bien qu’elle ne soit pas requise pour l’activation initiale des LB, l’autophagie permet la survie des plasmocytes (Figure 4) [31, 39]. Dans ces cellules, l’activité autophagique permet de limiter la quantité de réticulum endoplasmique, et donc le stress qui est lié à son accumulation dans la cellule. L’inactivation de l’autophagie dans les LB conduit à une diminution des sécrétions d’immunoglobulines IgM et IgG après immunisation ou infection. De même, la survie à long terme des plasmocytes à longue durée de vie dans la moelle osseuse nécessite une activité autophagique. L’autophagie semble également importante pour la survie des LB mémoires. Ainsi, lors d’une immunisation ou d’une infection par le virus de la grippe, l’autophagie est nécessaire pour obtenir une réponse secondaire [30]. L’activité autophagique s’avère donc indispensable, non pour la différenciation des cellules mémoires, mais pour leur survie [40]. Cependant, le mécanisme par lequel l’autophagie favorise la survie des LB mémoire n’est pas encore élucidé, mais il est possible qu’il soit similaire à celui observé dans le cas des LT. |
Autophagie des lymphocytes et physiopathologie L’importance de l’autophagie dans l’homéostasie lymphocytaire suggère qu’une dérégulation de ce processus pourrait entraîner des dysfonctionnements majeurs de l’immunité. Des facteurs génétiques ou environnementaux modifiant l’activité autophagique pourraient ainsi être impliqués dans certaines pathologies. La première étude s’intéressant à l’activité autophagique des lymphocytes lors de dysfonctionnements immunitaires décrit une augmentation de l’expression de la protéine ATG5 dans les LT qui infiltrent les lésions observées dans la sclérose en plaques (SEP) [41]. L’absence d’autophagie dans les LT diminue ainsi les symptômes de la pathologie dans un modèle murin de SEP [25], l’amélioration clinique étant liée à une baisse du nombre de lymphocytes de type Th1. Dans une pathologie auto-immune systémique – le lupus érythémateux disséminé (LED)6 –, l’identification de polymorphismes génétiques dans la région du gène ATG5, corrélés avec le développement de la pathologie, a conduit à s’interroger sur l’implication de l’autophagie [42]. Même si la signification fonctionnelle de ces polymorphismes est encore peu documentée, des auteurs ont proposé l’existence d’une corrélation entre une des variantes de la maladie et une plus forte expression transcriptionnelle d’ATG5 [43]. Un des polymorphismes d’ATG5 est également associé au développement de l’asthme, une autre pathologie caractérisée par une hyperactivation du système immunitaire [44]. Il est intéressant de noter que des molécules qui impactent l’activité autophagique sont utilisées pour le traitement du LED. C’est le cas de l’hydroxychloroquine, utilisée en routine, ou la rapamycine et le peptide P140 [45, 46] qui sont en essais cliniques. De plus, l’autophagie est dérégulée dans les LT, dans des modèles murins de lupus, et chez les patients atteints de LED [28, 47–49]. Les LT de ces patients présentent une charge en autophagosomes plus importante que des LT de sujets sains [47]. Cependant, l’origine et la signification physiopathologique de cette dérégulation ne sont pas connues, mais il est possible que l’activation de l’autophagie favorise l’émergence et la survie de LT autoréactifs, qui associés aux LB induiront leur différenciation en cellules productrices d’autoanticorps. Il est également possible que l’accumulation d’autophagosomes soit liée à un blocage partiel de leur dégradation par les lysosomes. Dans ce cas, le déficit en activité autophagique sensibiliserait les LT à l’apoptose. Cette propension à l’apoptose des LT est caractéristique du LED in vitro. Elle pourrait résulter de l’activation chronique subie par ces cellules in vivo et favoriser l’accumulation d’autoantigènes dans la circulation et dans les tissus. Un déficit de l’autophagie a également été observé dans les LT de patients atteints de polyarthrite rhumatoïde (PR), une autre pathologie auto-immune systémique. Dans ce cas, la baisse de l’activité autophagique accroît la mort cellulaire des LT [50]. Il apparaît important de déterminer l’impact exact de la dérégulation de l’autophagie des LT lors des pathologies auto-immunes afin de mieux comprendre ses conséquences. De manière intéressante, une étude suggère qu’une modification de l’activité autophagique des LB favorise l’auto-immunité. Un accroissement de l’activité autophagique dans les LB est en effet observé au cours du lupus [28], ce qui favoriserait la survie des LB autoréactifs mais également des plasmocytes, producteurs des autoanticorps. L’activité autophagique des LB pourrait également participer à la physiopathologie de la PR en favorisant la présentation d’épitopes citrullinés aux LT, ce qui entraînerait la production d’anticorps dirigés contre des structures déiminées [29]. De tels anticorps sont fréquemment retrouvés au cours de cette pathologie. |
Les études récentes ont montré un impact crucial de l’activité autophagique dans toutes les phases de la vie des lymphocytes, du développement aux phases effectrices. Les modèles d’étude murins n’ont pas toujours permis de définir clairement ces rôles et d’autres études sont nécessaires afin d’affiner nos connaissances. Il reste ainsi à définir le rôle précis de l’autophagie dans le développement des LB. De plus, les causes de la dérégulation de l’autophagie des lymphocytes observée dans plusieurs pathologies comme le lupus ne sont pas encore expliquées. L’origine de ces anomalies pourra être mieux appréhendée lorsque les mécanismes de modulation de l’autophagie par la signalisation des récepteurs à l’antigène, des récepteurs de l’immunité innée et des cytokines seront mieux documentés. Enfin, le rôle, peut-être non strictement lié, de l’autophagie dans le trafic intracellulaire permettant l’activation des LB, et important dans la présentation antigénique devra faire l’objet de nouvelles recherches. Mieux comprendre l’impact d’une modification ciblée de l’autophagie des lymphocytes pourrait permettre d’éliminer spécifiquement les cellules effectrices et mémoire, afin de limiter leur impact délétère lors des pathologies auto-immunes. À l’inverse, activer l’autophagie des lymphocytes lors des vaccinations pourrait permettre d’améliorer leur efficacité, qui repose largement sur la génération et la survie des cellules mémoire. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les auteurs remercient le CNRS, le programme « Investissements d’Avenir » (LabEx, EquipEx) lié à l’IdEx de Strasbourg, l’association Arthritis Courtin et la Ligue contre le cancer (ARC) pour leur soutien financier ; le ministère de l’Éducation nationale, de l’enseignement supérieur et de la recherche pour son soutien pré-doctoral à Johan Arnold et Florent Arbogast, l’ARC pour son soutien pré-doctoral à Johan Arnold et le Fond national de recherche du Luxembourg pour son soutien pré-doctoral à Diane Murera.
|
Footnotes |
1.
Codogno P. Les gènes ATG et la macro-autophagie . Med Sci (Paris). 2004; ; 20 : :734.–736. 2.
Feng Y, He D, Yao Z, Klionsky DJ The machinery of macroautophagy . Cell Res. 2014; ; 24 : :24.–41. 3.
Subramani S, Malhotra V Non-autophagic roles of autophagy-related proteins . EMBO Rep. 2013; ; 14 : :143.–151. 4.
Deretic V, Saitoh T, Akira S Autophagy in infection, inflammation and immunity . Nat Rev Immunol. 2013; ; 13 : :722.–737. 5.
Joubert PE, Grégoire IP, Meiffren G, et al. Autophagie et pathogènes . Med Sci (Paris). 2011; ; 27 : :41.–47. 6.
Gomes LC, Dikic I Autophagy in antimicrobial immunity . Mol Cell. 2014; ; 54 : :224.–233. 7.
Glasser AL, Lapaquette P, Darfeuille-Michaud A Altération de l’autophagie chez les patients atteints de maladie de Crohn . Med Sci (Paris). 2009; ; 25 : :349.–351. 8.
Gardet A, Xavier RJ Common alleles that influence autophagy and the risk for inflammatory bowel disease . Curr Opin Immunol. 2012; ; 24 : :522.–529. 9.
Mintern JD, Macri C, Villadangos JA Modulation of antigen presentation by intracellular trafficking . Curr Opin Immunol. 2015; ; 34 : :16.–21. 10.
Pua HH, Dzhagalov I, Chuck M, et al. A critical role for the autophagy gene Atg5 in T cell survival and proliferation . J Exp Med. 2007; ; 204 : :25.–31. 11.
Pua HH, Guo J, Komatsu M, He YW Autophagy is essential for mitochondrial clearance in mature T lymphocytes . J Immunol. 2009; ; 182 : :4046.–4055. 12.
Stephenson LM, Miller BC, Ng A, et al. Identification of Atg5-dependent transcriptional changes and increases in mitochondrial mass in Atg5-deficient T lymphocytes . Autophagy. 2009; ; 5 : :625.–635. 13.
Salio M, Puleston DJ, Mathan TSM, et al. Essential role for autophagy during invariant NKT cell development . Proc Natl Acad Sci USA. 2014; ; 111 : :E5678.–E5687. 14.
Miller BC, Zhao Z, Stephenson LM, et al. The autophagy gene ATG5 plays an essential role in B lymphocyte development . Autophagy. 2008; ; 4 : :309.–314. 15.
Hamze M, Desmetz C, Guglielmi P. Les lymphocytes B. Med Sci (Paris). 2014; ; 30 : :874.–881. 16.
Mortensen M, Soilleux EJ, Djordjevic G, et al. The autophagy protein Atg7 is essential for hematopoietic stem cell maintenance . J Exp Med. 2011; ; 208 : :455.–467. 17.
Nedjic J, Aichinger M, Emmerich J, et al. Autophagy in thymic epithelium shapes the T-cell repertoire and is essential for tolerance . Nature. 2008; ; 455 : :396.–400. 18.
Sukseree S, Mildner M, Rossiter H, et al. Autophagy in the thymic epithelium is dispensable for the development of self-tolerance in a novel mouse model . PLoS One. 2012; ; 7 : :e38933.. 19.
Lopes N, Ferrier P, Irla M Induction de la tolérance centrale dans le thymus par le facteur de transcription Aire . Med Sci (Paris). 2015; ; 31 : :742.–747. 20.
Aichinger M, Wu C, Nedjic J, Klein L Macroautophagy substrates are loaded onto MHC class II of medullary thymic epithelial cells for central tolerance . J Exp Med. 2013; ; 210 : :287.–300. 21.
Schuster C, Gerold KD, Schober K, et al. The autoimmunity-associated gene CLEC16A modulates thymic epithelial cell autophagy and alters T cell selection . Immunity. 2015; ; 42 : :942.–952. 22.
Jia W, He YW Temporal regulation of intracellular organelle homeostasis in T lymphocytes by autophagy . J Immunol. 2011; ; 186 : :5313.–5322. 23.
Jia W, Pua HH, Li QJ, He YW Autophagy regulates endoplasmic reticulum homeostasis and calcium mobilization in T lymphocytes . J Immunol. 2011; ; 186 : :1564.–1574. 24.
Hubbard VM, Valdor R, Patel B, et al. Macroautophagy regulates energy metabolism during effector T cell activation . J Immunol. 2010; ; 185 : :7349.–7357. 25.
Kovacs JR, Li C, Yang Q, et al. Autophagy promotes T-cell survival through degradation of proteins of the cell death machinery . Cell Death Differ. 2012; ; 19 : :144.–152. 26.
Li C, Capan E, Zhao Y, et al. Autophagy is induced in CD4+ T cells and important for the growth factor-withdrawal cell death . J Immunol. 2006; ; 177 : :5163.–5168. 27.
Watanabe K, Tsubata T Autophagy connects antigen receptor signaling to costimulatory signaling in B lymphocytes . Autophagy. 2009; ; 5 : :108.–110. 28.
Clarke AJ, Ellinghaus U, Cortini A, et al. Autophagy is activated in systemic lupus erythematosus and required for plasmablast development . Ann Rheum Dis. 2015; ; 74 : :912.–920. 29.
Ireland JM, Unanue ER Autophagy in antigen-presenting cells results in presentation of citrullinated peptides to CD4 T cells . J Exp Med. 2011; ; 208 : :2625.–2632. 30.
Chen M, Hong MJ, Sun H, et al. Essential role for autophagy in the maintenance of immunological memory against influenza infection . Nat Med. 2014; ; 20 : :503.–510. 31.
Pengo N, Scolari M, Oliva L, et al. Plasma cells require autophagy for sustainable immunoglobulin production . Nat Immunol. 2013; ; 14 : :298.–305. 32.
Dengjel J, Schoor O, Fischer R, et al. Autophagy promotes MHC class II presentation of peptides from intracellular source proteins . Proc Natl Acad Sci USA. 2005; ; 102 : :7922.–7927. 33.
Paludan C, Schmid D, Landthaler M, et al. Endogenous MHC class II processing of a viral nuclear antigen after autophagy . Science. 2005; ; 307 : :593.–596. 34.
Chaturvedi A, Dorward D, Pierce SK The B cell receptor governs the subcellular location of toll-like receptor 9 leading to hyperresponses to DNA-containing antigens . Immunity. 2008; ; 28 : :799.–809. 35.
Münz C, Of LAP CUPS, and DRibbles: unconventional use of autophagy proteins for MHC restricted antigen presentation . Front Immunol. 2015; ; 6 : :200.. 36.
Puleston DJ, Zhang H, Powell TJ, et al. Autophagy is a critical regulator of memory CD8+ T cell formation . Elife. 2014 ; :3.. 37.
Xu X, Araki K, Li S, et al. Autophagy is essential for effector CD8+ T cell survival and memory formation . Nat immunol. 2014; ; 15 : :1152.–1161. 38.
Schlie K, Westerback A, DeVorkin L, et al. Survival of effector CD8+ T cells during influenza infection is dependent on autophagy . J Immunol. 2015; ; 194 : :4277.–4286. 39.
Conway KL, Kuballa P, Khor B, et al. ATG5 regulates plasma cell differentiation . Autophagy. 2013; ; 9 : :528.–537. 40.
Chen M, Kodali S, Jang A, et al. Requirement for autophagy in the long-term persistence but not initial formation of memory B cells . J Immunol. 2015; ; 194 : :2607.–2615. 41.
Alirezaei M, Fox HS, Flynn CT, et al. Elevated ATG5 expression in autoimmune demyelination and multiple sclerosis . Autophagy. 2009; ; 5 : :152.–158. 42.
Harley JB, Alarcon-Riquelme ME, Criswell LA, et al. Genome-wide association scan in women with systemic lupus erythematosus identifies susceptibility variants in ITGAM, PXK, KIAA1542 and other loci . Nat Genet. 2008; ; 40 : :204.–210. 43.
Zhou XJ, Lu XL, Lv JC, et al. Genetic association of PRDM1-ATG5 intergenic region and autophagy with systemic lupus erythematosus in a Chinese population . Ann Rheum Dis. 2011; ; 70 : :1330.–1337. 44.
Martin LJ, Gupta J, Jyothula SS, et al. Functional variant in the autophagy-related 5 gene promotor is associated with childhood asthma . PLoS One. 2012; ; 7 : :e33454.. 45.
Page N, Gros F, Schall N, et al. HSC70 blockade by the therapeutic peptide P140 affects autophagic processes and endogenous MHCII presentation in murine lupus . Ann Rheum Dis. 2011; ; 70 : :837.–843. 46.
Zimmer R, Scherbarth HR, Rillo OL, et al. Lupuzor/P140 peptide in patients with systemic lupus erythematosus: a randomised, double-blind, placebo-controlled phase IIb clinical trial . Ann Rheum Dis. 2013; ; 72 : :1830.–1835. 47.
Gros F, Arnold J, Page N, et al. Macroautophagy is deregulated in murine and human lupus T lymphocytes . Autophagy. 2012; ; 8 : :1113.–1123. 48.
Alessandri C, Barbati C, Vacirca D, et al. T lymphocytes from patients with systemic lupus erythematosus are resistant to induction of autophagy . FASEB J. 2012; ; 26 : :4722.–4732. 49.
Caza TN, Fernandez DR, Talaber G, et al. HRES-1/Rab4-mediated depletion of Drp1 impairs mitochondrial homeostasis and represents a target for treatment in SLE . Ann Rheum Dis. 2014; ; 73 : :1888.–1897. 50.
Yang Z, Fujii H, Mohan SV, et al. Phosphofructokinase deficiency impairs ATP generation, autophagy, and redox balance in rheumatoid arthritis T cells . J Exp Med. 2013; ; 210 : :2119.–2134. 51.
Chen M, Kodali S, Jang A, et al. Requirement for autophagy in the long-term persistence but not initial formation of memory B cells . J Immunol. 2015; ; 194 : :2607.–2615. |