| |
| Med Sci (Paris). 2016 March; 32(3): 253–259. Published online 2016 March 23. doi: 10.1051/medsci/20163203009.Immunopathologie du psoriasis *
From bench to bedside Adèle de Masson,1,2,3** Jean-David Bouaziz,1,2,3 Maxime Battistella,2,4,5 Martine Bagot,1,2,3 and Armand Bensussan1,2,6 1Inserm U976, laboratoire oncodermatologie, immunologie et cellules souches cutanées, hôpital Saint-Louis, 1, avenue Claude Vellefaux, 75010Paris, France 2Université Paris VII Paris Diderot, Sorbonne Paris Cité, Paris, France 3Service de dermatologie, hôpital Saint-Louis, 1, avenue Claude Vellefaux, 75010Paris, France 4Laboratoire de pathologie, hôpital Saint-Louis, 1, avenue Claude Vellefaux, 75010Paris, France 5Inserm U1165, hôpital Saint-Louis, 1, avenue Claude Vellefaux, 75010Paris, France 6OREGA Biotech, 15, chemin du Saquin, 69130Écully, France |
Le psoriasis est une maladie inflammatoire chronique fréquente de cause inconnue, bien que des facteurs génétiques [1] et environnementaux aient été mis en évidence. On estime qu’environ 2 % de la population occidentale est touchée [2]. Cette maladie altère significativement la qualité de vie des patients atteints [3]. Les lymphocytes T CD4 Th17 sont une variété de lymphocytes T sécrétant de l’interleukine (IL)-17A, de l’IL-17F, de l’IL-22, de l’IL-26, ainsi que du TNF (tumor necrosis factor)-α. Ils expriment le facteur de transcription ROR (retinoic acid-related orphan receptor)-γT et, à la membrane, le récepteur de chimiokine CCR6 (CC chemokine receptor 6) [4–6] (→).
(→) Voir la Synthèse de S. Leung-Theung-Long et S. Guerder, m/s n° 11, novembre 2008, page 972 et la Nouvelle de H. Yssel et A. Bensussan, m/s n° 1, janvier 2010, page 12
Leur différenciation est induite par la stimulation des lymphocytes T naïfs par l’IL-6 [7], le TGF (transforming growth factor)-β et l’IL-23 [8, 9]. Un rôle majeur de ces lymphocytes Th17 dans le psoriasis ayant été montré [10], de nombreuses biothérapies ciblant l’IL-23 [11–14], l’IL-22 [15, 16], l’IL-17A [17, 18] ou son récepteur IL-17RA (interleukin 17A receptor) [19] ont été développées ou sont actuellement à l’étude dans le traitement de la maladie. Cette revue propose une synthèse des mécanismes d’action de ces biothérapies du psoriasis en relation avec la physiopathologie de la maladie. |
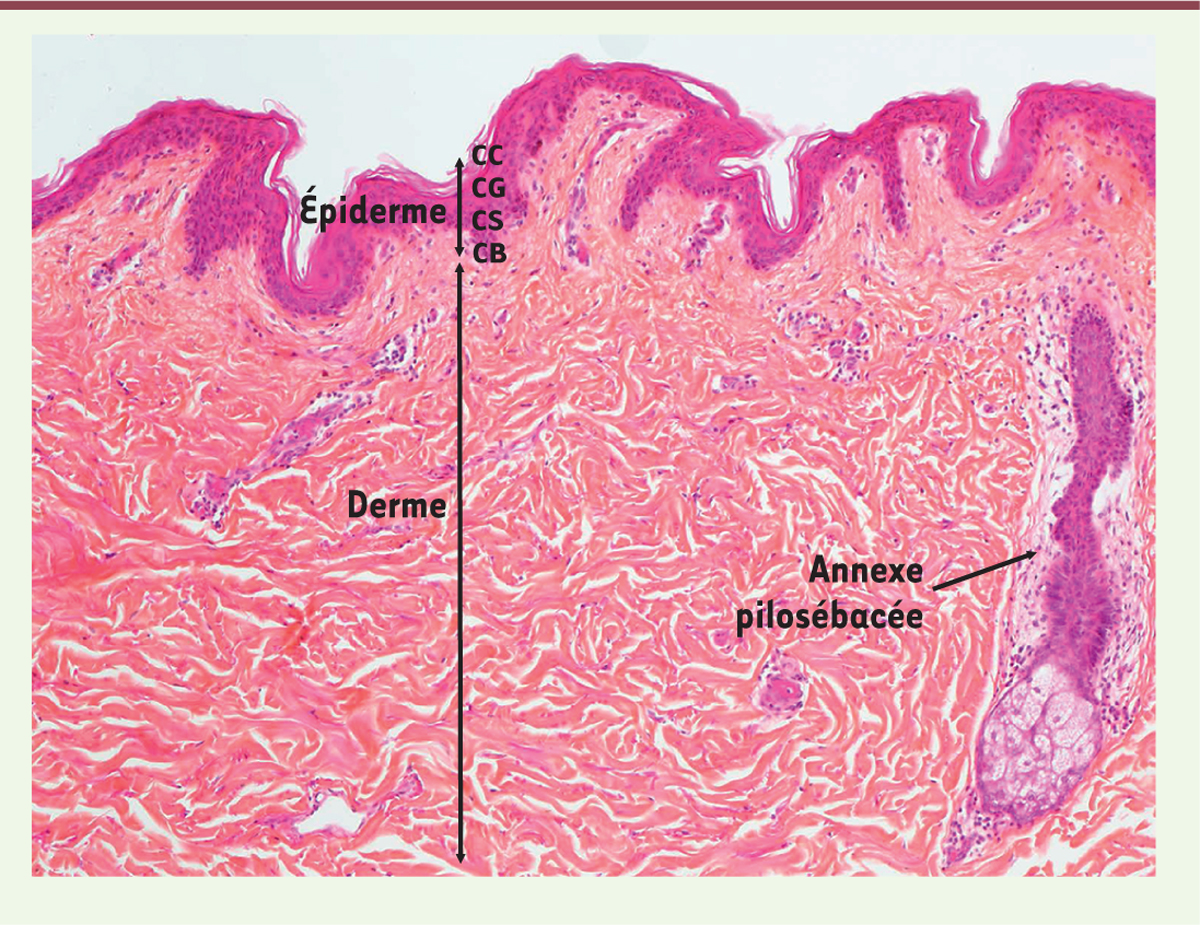
Structure de la peau humaine normale La peau humaine (Figure 1) est constituée de trois couches qui sont, de la profondeur à la superficie, l’hypoderme, le derme et l’épiderme. L’hypoderme est majoritairement constitué des adipocytes qui sont des cellules chargées de lipides. Le derme contient un tissu interstitiel formé de collagène, des vaisseaux sanguins, des annexes pilosébacées et des cellules du système immunitaire. L’épiderme est constitué de kératinocytes organisés en quatre couches. La plus profonde, la couche basale (stratum basale), est au contact de la membrane basale qui sépare l’épiderme du derme superficiel. Elle est constituée des kératinocytes basaux qui prolifèrent et se différencient en kératinocytes des couches supérieures, c’est-à-dire couche épineuse (stratum spinosum ou corps muqueux de Malpighi), couche granuleuse (stratum granulosum), et couche cornée (stratum corneum) en superficie. Les kératinocytes présents au niveau de la couche cornée (les cornéocytes) ont perdu leur noyau. Ils sont enveloppés de protéines constituant l’enveloppe cornée.
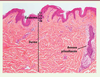 | Figure 1.
Structure de la peau humaine normale. L’épiderme est constitué de la superficie vers la profondeur de la couche cornée (CC), couche granuleuse (CG), couche spineuse (CS), couche basale (CB). Le derme contient les vaisseaux sanguins et les annexes pilosébacées. L’hypoderme n’est pas visible. |
|
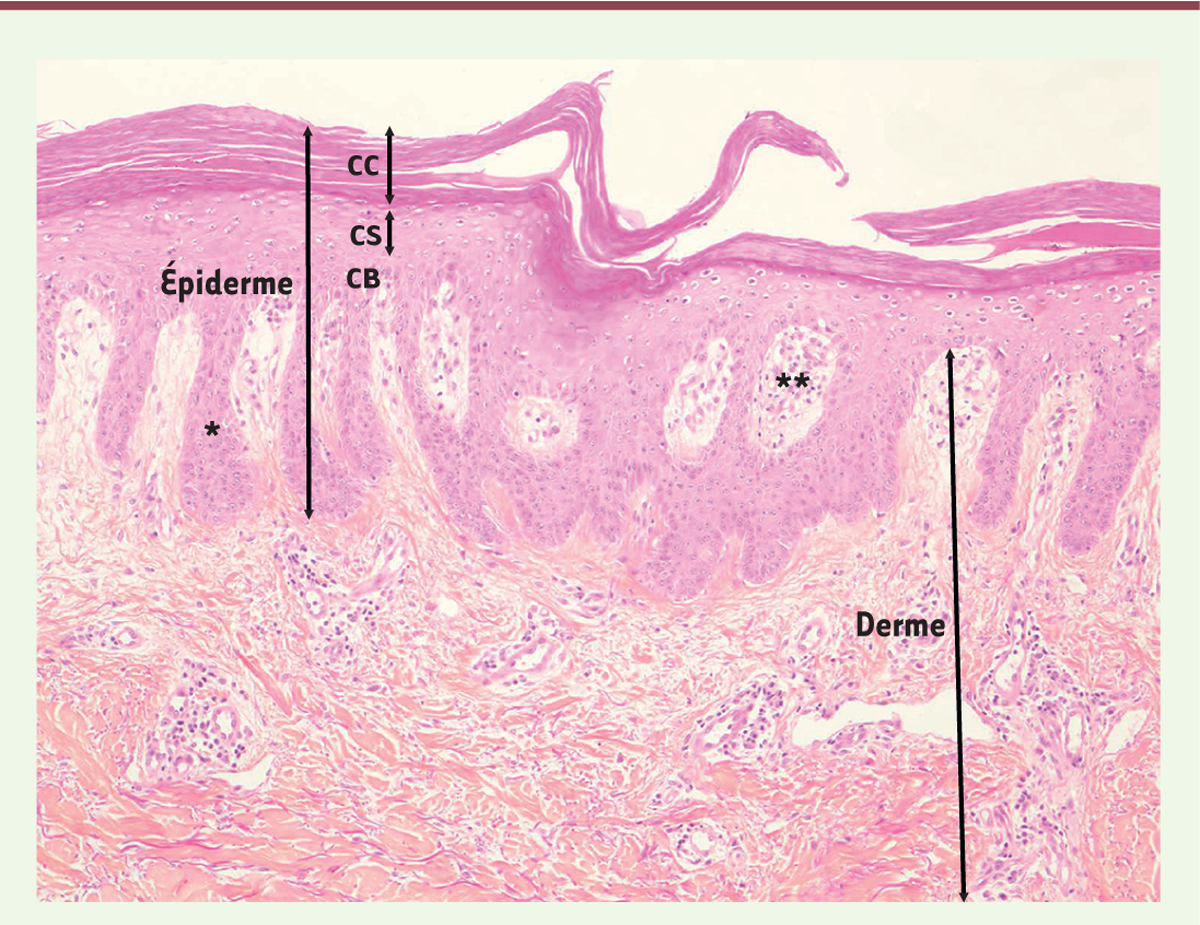
Histologie des lésions cutanées de psoriasis L’examen histologique (Figure 2) d’une plaque de psoriasis cutané, dans sa forme typique, montre :
-
une hyperkératose (épaississement de la couche cornée [CC] de l’épiderme) ;
-
une parakératose (rétention anormale des noyaux des kératinocytes dans la partie supérieure de la couche cornée) ;
-
une acanthose (épaississement du corps muqueux de Malpighi) liée à une prolifération exagérée des kératinocytes basaux ;
-
une hypogranulose (diminution d’épaisseur de la couche granuleuse [CG] de l’épiderme) ;
-
une papillomatose (hyperplasie épithéliale avec allongement des bourgeons interpapillaires, qui sont les zones où l’épiderme plonge entre les papilles dermiques) ;
-
une hypervascularisation et un infiltrat inflammatoire du derme superficiel.
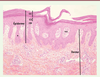 | Figure 2.
Anomalies histologiques caractéristiques de la peau humaine psoriasique. On note une hyperplasie de l’épiderme avec allongement des bourgeons interpapillaires (*) hyperkératose (épaississement de la couche cornée, CC), et hypogranulose. Une hypervascularisation et un infiltrat inflammatoire (**) sont présents dans le derme superficiel. |
Des neutrophiles peuvent être anormalement présents dans l’épiderme et la couche cornée (ces infiltrats de neutrophiles forment les microabcès de Munro-Sabouraud). |
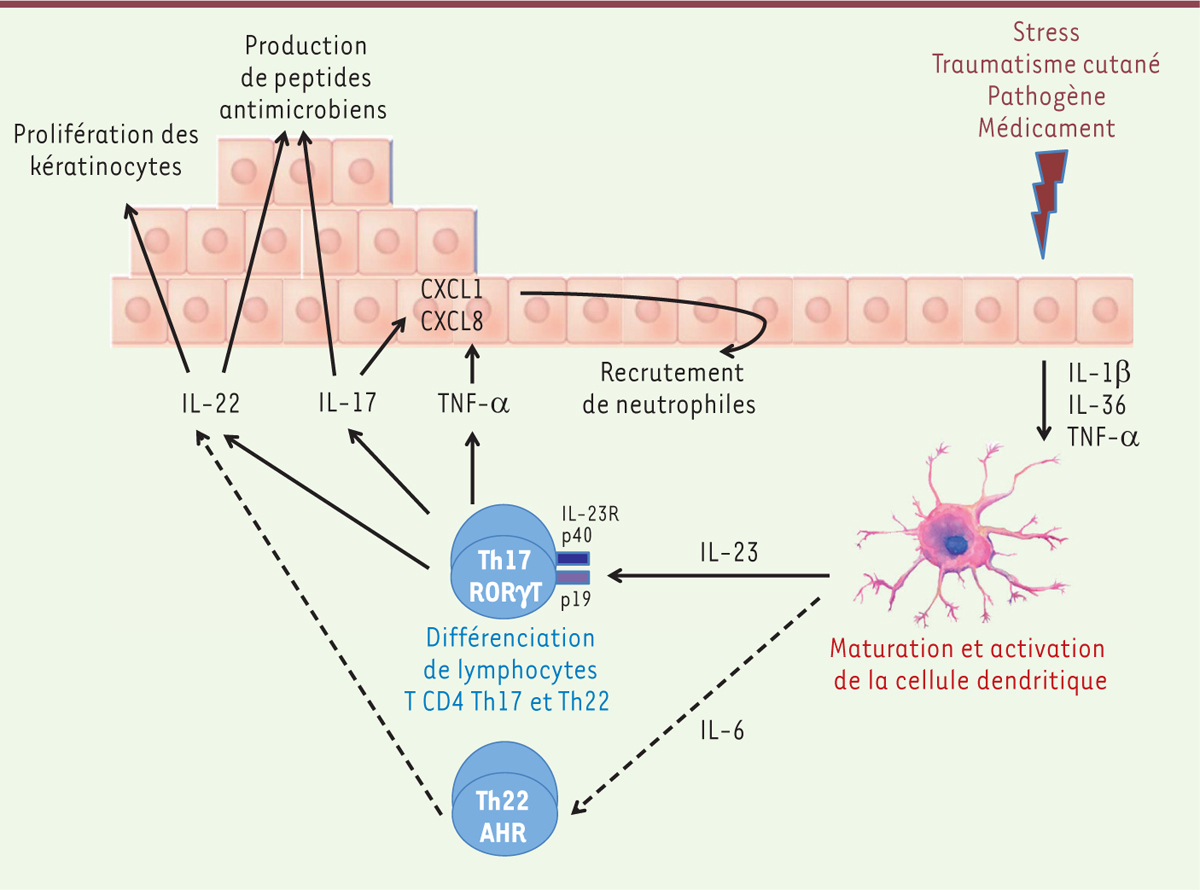
Immunopathologie du psoriasis Plusieurs facteurs peuvent déclencher les poussées de psoriasis, dont les traumatismes cutanés (phénomène de Koebner1), les infections (comme l’infection à streptocoque bêta-hémolytique du groupe A impliqué dans certaines formes de psoriasis de l’enfant), certains médicaments (bêtabloquants, lithium, inhibiteurs de l’enzyme de conversion de l’angiotensine [un vasoconstricteur], interféron alpha, antipaludéens de synthèse), et les chocs émotionnels. Phase initiale : activation des cellules dendritiques Le nombre de cellules dendritiques (DC) est augmenté dans les lésions de psoriasis par rapport à la peau saine. Il s’agit de cellules dendritiques d’origine myéloïde (cellules de Langerhans dans l’épiderme, cellules dendritiques dermiques), et d’origine lymphoïde (cellules dendritiques plasmacytoïdes [pDC]). Un modèle a ainsi été proposé pour l’initiation de la maladie psoriasique. Il implique l’agression initiale des kératinocytes qui entraîne la libération du peptide antimicrobien LL37 (aussi appelé hCAP18 [ human cationic antimicrobial protein 18]). LL37 formerait un complexe avec l’ADN extracellulaire permettant son transport dans les compartiments endosomiques des DC. La fixation du complexe LL37/ADN au récepteur de l’immunité innée TLR7 ( Toll like receptor 7) activerait les pDC, et, par sa fixation au TLR8, il stimulerait les DC myéloïdes. L’engagement des TLR7, qui active les pDC, leur fait produire de l’interféron-α [ 20] qui, lui-même, active les DC myéloïdes. L’activation des DC entraîne leur différenciation en cellules présentatrices d’antigène matures, exprimant des molécules de costimulation des lymphocytes T. Phase d’expansion clonale et de différenciation des lymphocytes T La génération de cellules dendritiques (DC) matures permet, par leur interaction par contact direct, le priming (l’éducation) des lymphocytes T naïfs et leur expansion clonale. Le premier signal est la présentation de l’antigène au lymphocyte T par l’interaction entre le CMH (complexe majeur d’histocompatibilité) des DC présentant l’antigène et le TCR ( T-cell receptor) du lymphocyte T. Le second signal nécessaire à l’activation des lymphocytes T est constitué par les molécules de costimulation qui sont exprimées par les cellules dendritiques activées qui lient des molécules présentes sur le lymphocyte T (comme B7.1 exprimé par la DC activée qui lie CD28 sur le lymphocyte T). Le troisième signal correspond aux cytokines produites par la DC. Elles polarisent le lymphocyte T dans une voie de différenciation particulière telle que Th1, Th2 ou Th17 par exemple. Ainsi, au cours du psoriasis, l’activation des DC myéloïdes induit la synthèse d’IL-12 et d’IL-23, des cytokines qui activent la différenciation des lymphocytes T CD4 en Th1 et en Th17 [ 21]. Rôle des lymphocytes Th1 et Th17 Les différentes populations de lymphocytes T CD4 (telles que Th1, Th2, Th17, ou T régulateurs) sont caractérisées notamment par leurs profils de sécrétion cytokiniques particuliers : IFN-γ et TNF-α pour les Th1, IL-4 pour les Th2 (Figure 3).
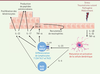 | Figure 3.
Immunopathologie du psoriasis. Sous l’influence du stress, de traumatismes cutanés, après l’infection par certains pathogènes ou la prise de certains médicaments, la production d’IL(interleukine)-1b, d’IL-36 et de TNF(tumor necrosis factor)-α par les kératinocytes active la cellule dendritique. Celle-ci subit une maturation, exprime des molécules de costimulation du lymphocyte T et sécrète de l’IL-23. L’IL-23, en association à d’autres cytokines telles que le TGF (transforming growth factor)-β et l’IL-6, contribue à la différenciation des lymphocytes T CD4 en Th17. Ceux-ci, ainsi que les lymphocytes Th22, sécrètent de l’IL-22 qui entraîne la prolifération des kératinocytes et la production de peptides antimicrobiens en association à l’IL-17. L’IL-17, cytokine majeure produite par les Th17, stimule avec le TNF-α la production des chimiokines CXCL (chemokine [C-X-C motif] ligand) 1 et CXCL8 par les kératinocytes. Ces chimiokines recrutent des polynucléaires neutrophiles dans la peau. AHR : aryl hydrocarbon receptor ; RORγt : retinoid-acid receptor-related orphan receptor gamma t ; IL-23 R : récepteur de l’IL-23. |
La découverte en 2000 de la protéine p19 et de son association à la sous-unité IL-12p40 pour constituer l’IL-23 [22], a permis une avancée majeure dans la compréhension des maladies inflammatoires [9, 23]. L’IL-12 est un hétérodimère constitué des sous-unités p40 et p35. Avant même la découverte de l’IL-23 et l’élucidation de sa structure, des niveaux élevés de p40 avaient été trouvés au niveau de la peau lésionnelle dans le psoriasis [24]. Ils avaient été attribués à la présence d’IL-12 (qui était alors l’interleukine constituée de cette sous-unité), contribuant à donner un rôle important à cette cytokine dans la physiopathologie de la maladie. L’IL-12 stimulant la différenciation Th1, le psoriasis était ainsi considéré comme une maladie associée aux lymphocytes de type Th1. Les lymphocytes Th1 activés sécrètent de l’IFN-γ et du TNF-α qui induisent dans les cellules cibles (kératinocytes, cellules endothéliales et leucocytes) des voies de signalisation (STAT [signal transducer and activator of transcription]-1, NF[nuclear factor]-κB) qui régulent l’expression de diverses molécules impliquées dans la réponse inflammatoire. Ces molécules comprennent, entre autres, l’iNOS (inducible nitric oxide synthetase), enzyme catalytique exprimée par les kératinocytes responsable de la production de NO (oxyde nitrique), un puissant vasodilatateur [25], CXCL9 (chemokine [C-X-C motif] ligand 9) (également appelé MIG [monokine induced by IFN-γ]) [26], CXCL10 (ou IP-10 [interferon gamma-inducible protein 10]) [27], ICAM-1 (intercellular adhesion molecule-1) [28], IL-8 [29], et VCAM-1 (vascular cell adhesion molecule 1) [30] qui attirent les cellules mononucléées, ou le VEGF (vascular endothelial growth factor) qui stimule l’angiogenèse [31]. En fait, l’IL-12p35 (constituant l’IL-12 spécifique des lymphocytes Th1) n’est pas augmentée dans la peau psoriasique contrairement à l’IL-23p19 (spécifique de l’IL-23). Il semble ainsi plus probable que l’IL-23, et non l’IL-12, puisse jouer un rôle dans la physiopathologie de la maladie [32]. De plus, l’ustekinumab, un anticorps thérapeutique dirigé contre la sous-unité p40, efficace dans le psoriasis, dont on pensait qu’il était spécifique de l’IL-12, inhibe également l’IL-23 [33]. Une sous-population de lymphocytes T CD4 producteurs d’IL-17 qui sont induits après stimulation par l’IL-23, fut découverte en 2003 et nommée « Th17 » [8]. La différenciation des lymphocytes naïfs en lymphocytes Th17 nécessite l’IL-17 et le TGF-β qui activent le facteur de transcription ROR-γT. L’activation de ROR-γT augmente la synthèse par les cellules d’IL-17A et d’IL-23R (le récepteur à l’IL-23). L’IL-23, produite entre autres par les DC, achève la différenciation des lymphocytes en Th17 [34, 35]. À noter que la peau psoriasique présente de grandes quantités de lymphocytes Th1 et Th17 [21]. Les lymphocytes Th17 produisent de l’IL-17, de l’IL-22 et du TNF-α. Ces cytokines permettent le recrutement au niveau du tissu de cellules inflammatoires, l’hyperplasie kératinocytaire et induisent la production de médiateurs, dont certains diffèrent de ceux induits par les Th1, qui stimulent l’angiogenèse :
-
MCP-1 (macrophage chemoattractant protein-1) [36] induit la migration des monocytes sanguins vers les tissus ;
-
Gro α (growth-related oncogene α) [37] stimule le recrutement des neutrophiles ;
-
G-CSF (granulocytes colony-stimulating factor) et GM-CSF (granulocyte-macrophage colony-stimulating factor) favorisent la production médullaire de cellules phagocytaires [38] ;
-
IL-6 [39] et prostaglandine E2 (PGE-2), amplifient l’inflammation locale.
|
Biothérapies ciblant les cytokines, leur récepteur ou leur signalisation dans le psoriasis Le premier anticorps ayant reçu en 2003 une autorisation de mise sur le marché (AMM) aux États-Unis pour le traitement du psoriasis ne ciblait pas directement les cytokines possiblement impliquées dans la pathologie, mais l’activation des lymphocytes T et leur adhérence à l’épithélium et l’endothélium. Il s’agissait de l’efalizumab, un anticorps ciblant CD11a, une des sous-unités de LFA-1 (lymphocyte function-associated antigen 1, ou αLβ2 [CD11a/CD18]). LFA-1 est une protéine de la membrane plasmique des leucocytes capable de lier ICAM-1, une molécule surexprimée à la surface des cellules endothéliales et des kératinocytes dans les plaques de psoriasis. Cet anticorps étant à l’origine de l’apparition de cas de leuco-encéphalopathie multifocale progressive2, a été retiré du marché en 2009. Les premières biothérapies ciblant une cytokine sont apparues en 2004 : deux anticorps monoclonaux anti-TNF-α, l’infliximab et l’adalimumab, et un récepteur soluble pour la cytokine, l’étanercept. Ces biothérapies ont reçu l’autorisation de mise sur le marché pour le psoriasis modéré à sévère, après échec des autres traitements systémiques du psoriasis que sont la PUVAthérapie3, les immunosuppresseurs utilisant la ciclosporine et le méthotrexate, ou contre-indications. Les principales limitations à ces biothérapies très efficaces du psoriasis en sont le coût, les effets indésirables infectieux (notamment des infections respiratoires hautes et des tuberculoses) et la perte d’efficacité liée à l’apparition d’anticorps anti-médicament (surtout décrite avec l’infliximab) [40]. Des aggravations paradoxales du psoriasis ont également été notées [41] ainsi que le développement de maladies auto-immunes [42, 43]. Un sur-risque de néoplasie, en particulier de lymphome associé à l’utilisation au long terme de ces immunomodulateurs, ne peut être écarté. Plusieurs cas de lymphomes γδ hépatospléniques, un lymphome rare touchant le foie et la rate, ont été rapportés sous anti-TNF [44]. Néanmoins, le recul important concernant l’utilisation de ces anticorps (utilisés depuis 1998 dans des indications rhumatologiques), le nombre de patients traités, et la surveillance de cohortes observationnelles, plaident pour un sur-risque qui s’avère soit inexistant, soit particulièrement faible. Deux autres anticorps anti-TNF-α, le certolizumab pegol et le golimumab, ont été développés par la suite dans le psoriasis articulaire4. Le premier anticorps anti-IL23p40 qui a été développé est l’ustékinumab. Il a fait l’objet de la première étude comparant l’efficacité et la tolérance de deux biothérapies dans le psoriasis. Cet essai, ACCEPT (active comparator [CNTO1275/Enbrel] psoriasis trial), de phase III multicentrique et randomisé, comparait l’efficacité et la tolérance de l’ustékinumab et de l’étanercept dans le psoriasis en plaques modéré à sévère. À la semaine 12 du traitement, la proportion de patients atteignant le PASI75 (c’est à dire présentant 75 % au moins de réduction du score PASI5 par rapport au score initial) était significativement plus grande dans les groupes ayant reçu l’ustékinumab aux doses, par injection, de 45 mg (67,5 %) et 90 mg (75,8 %) (2 injections à J0 et 4 semaines après) que dans le groupe traité avec 50 mg d’étanercept 2 fois par semaine pendant 12 semaines (56,8 %) (p = 0,012 contre ustékinumab 45 mg et p < 0,001 contre ustékinumab 90 mg). Un deuxième anticorps anti-IL23p40, le briakinumab, a été développé mais la demande d’autorisation de mise sur le marché a été retirée à la demande du laboratoire pharmaceutique l’ayant produit après qu’il ait reçu des commentaires des autorités réglementaires indiquant « la nécessité d’une analyse plus poussée et le potentiel pour des études supplémentaires ». Bien que cette suspension de demande d’AMM ait été présentée par le laboratoire en 2011, comme seulement provisoire, à ce jour, aucune nouvelle demande n’a été soumise. Les biothérapies ciblant directement l’IL-17A, correspondant aux anticorps ixekizumab et secukinumab [45–47] (→), ont montré des résultats extrêmement prometteurs. En revanche, l’essai portant sur le brodalumab, qui cible lui le récepteur à l’IL-17 (IL-17RA) a été interrompu en 2015 en raison d’effets secondaires graves, d’ordre psychiatrique. En effet, de nombreux patients recevant cet anticorps ont eu des pensées et comportements suicidaires, conduisant à des interrogations sur le lien existant entre le traitement par cet anti-IL-17RA et ces comportements. Bien qu’un tel lien ait été démenti, cette observation a conduit à l’arrêt par le laboratoire du développement de cet anticorps. Si un lien entre cet effet secondaire neuropsychique et le traitement par brodalumab était confirmé, cela poserait des questions intéressantes sur les relations entre IL-17RA et système neuroendocrinien, et ceci d’autant plus que le choc émotionnel est l’un des facteurs déclenchant des poussées de psoriasis.
(→) Voir la Nouvelle de M.C. Bonnet et al., m/s n° 12, décembre 2012, page 1035
Concernant les inhibiteurs de la signalisation, un essai de phase III évaluant l’efficacité dans le psoriasis en plaques modéré à sévère du tofacitinib, un inhibiteur de JAK (Janus kinase) 1 et JAK3 (des kinases impliquées dans les voies JAK/STAT de signalisation en aval de nombreux récepteurs de cytokines), a montré un effet équivalent de la molécule par rapport au récepteur soluble au TNF-α, l’étanercept, et sa supériorité par rapport au placebo [48]. |
Anticorps spécifiques de l’IL-23p19 dans le psoriasis La découverte du rôle prépondérant de l’IL-23 dans le psoriasis, cytokine favorisant la différenciation des lymphocytes T en Th17, a conduit au développement de plusieurs anticorps inhibiteurs spécifiques de la sous-unité IL-23p19. En particulier, une étude de phase I a évalué l’efficacité et la tolérance du tildrakizumab (MK-3222) développé par le laboratoire pharmaceutique Merck [14]. Dans cette étude, conduite sur 77 patients atteints de psoriasis modéré à sévère, trois injections de tildrakizumab à J1, J56 et J84 ont induit chez les patients une réduction moyenne du score PASI de 50 à 80 % après 112 jours, qui était maintenue à J196, c’est-à-dire près de trois mois après la dernière injection. Les effets secondaires (céphalées et infections respiratoires hautes) semblaient proches de ceux observés avec les inhibiteurs du TNF-α. Les altérations histologiques spécifiques du psoriasis (hyperkératose, hypervascularisation du derme superficiel, infiltrat mononucléé) et le score histopathologique HPSS (histopathologic psoriasis severity score)6 ont également régressé sous ce traitement. Dans la peau, l’IL23p19 est produite majoritairement par les DC myéloïdes (CD11c+), les neutrophiles (CD15+) et les macrophages (CD163+). Après traitement, les cellules IL-23p19+ disparaissaient presque complètement en peau lésionnelle bien que, du fait du faible nombre d’échantillons testés, la différence entre avant et après traitement n’atteigne pas la significativité. Cette disparition a été attribuée à un effet du médicament sur la déplétion des cellules, sans toutefois pouvoir formellement exclure un artefact technique lié à la saturation par le tildrakizumab des sites de fixation de l’anticorps utilisé pour identifier les cellules par immunohistochimie. Par ailleurs, une diminution de l’expression au niveau de la peau lésionnelle de gènes inductibles par l’IL-23, tels que les gènes codant les cytokines IL-19 et IL-20, les peptides antimicrobiens S100A7 (ou psoriasine) et LCN2 (ou lipocaline 2), les chimiokines CCL20 et CXCL8, est observée après traitement. Ces résultats semblent confirmer le rôle joué par l’IL-23 au cours du psoriasis. Ils montrent l’intérêt de cibler cette voie en thérapeutique. Quatre autres anticorps anti-IL-23p19, le guselkumab (CNTO-1959, Johnson & Johnson et Janssen Biotech), l’AMG-139 (Amgen et Medimmune), le LY-3074828 (Eli Lilly) et le BI-655066 (Boehringer Ingelheim) sont actuellement en développement. Les résultats de l’étude de phase I concernant l’anticorps BI-655066 ont montré que 87 % des patients atteignent le PASI75 12 semaines après une seule injection. Le profil d’expression des gènes de la voie IL-23/IL-17 est également normalisé en peau lésionnelle après ce traitement [12]. Des études prospectives randomisées devraient permettre de préciser l’apport des inhibiteurs spécifiques de l’IL-23p19 par rapport aux biothérapies actuelles du psoriasis, et en particulier par rapport à l’anti-IL12/IL-23p40 (ustékinumab). |
Perspectives : inhibition de l’interleukine 22 L’IL-22 était considérée comme étant la caractéristique des lymphocytes Th17, jusqu’à ce que deux études [49, 50] révèlent l’existence d’une sous-population de lymphocytes distincte caractérisée par sa capacité à produire principalement de l’IL-22 et pas, ou très peu, d’IL-17. Cette population est associée à un tropisme cutané de part l’expression des récepteurs CCR4, CCR6 et CCR10 (c-c chemokine receptors 4, 6, 10), même si les preuves de ce tropisme restent discutables, puisque des ligands de ces récepteurs sont également exprimés au niveau d’autres tissus que la peau [6] (→).
(→) Voir la Nouvelle de H. Yssel et A. Bensussan, m/s n°1, janvier 2010, page 12
Le rôle potentiel de l’IL-22 dans le psoriasis est cependant soutenu par plusieurs études, faisant des inhibiteurs de la voie IL-22/IL-22R1 de nouvelles biothérapies potentielles. |
Les progrès dans la compréhension de l’immunopathologie du psoriasis ont entraîné l’avènement de biothérapies extrêmement efficaces, dont les premières furent les inhibiteurs du TNF-α. Plus récemment, la découverte du rôle majeur joué par les lymphocytes T CD4 de type Th17 dans la maladie a engendré le développement d’inhibiteurs de l’IL-23, cytokine impliquée dans la différenciation lymphocytaire de type Th17, et de l’IL-17, cytokine produite notamment par les lymphocytes Th17. Actuellement, de nombreux inhibiteurs de la sous-unité p19 de l’IL-23 sont en développement avec des études de phase I prometteuses. La caractérisation fine des populations lymphocytaires et de leur implication en physiopathologie des maladies cutanées ouvre la voie à des avancées immunothérapeutiques majeures. |
Adèle de Masson, Martine Bagot et Jean-David Bouaziz déclarent avoir bénéficié de la prise en charge de frais de congrès par Janssen. Jean-David Bouaziz et Martine Bagot déclarent avoir reçu des honoraires de la part de Novartis. Martine Bagot déclare avoir bénéficié du paiement de frais de congrès par Pfizer et Novartis. Armand Bensussan est cofondateur de la société OREGA Biotech.
|
Adèle de Masson a bénéficié du soutien de l’Institut National du Cancer/Institut Thématique Multi-organismes Cancer. Nous remercions également la Société Française de Dermatologie pour son soutien.
|
Footnotes |
1.
Marrakchi S, Guigue P, Renshaw BR, et al. Interleukin-36-receptor antagonist deficiency and generalized pustular psoriasis . N Engl J Med. 2011; ; 365 : :620.–628. 2.
Stern RS, Nijsten T, Feldman SR, Margolis DJ, Rolstad T. Psoriasis is common, carries a substantial burden even when not extensive, and is associated with widespread treatment dissatisfaction . J Investig Dermatol. 2004; ; 9 : :136.–139. 3.
Dubertret L, Mrowietz U, Ranki A, et al. European patient perspectives on the impact of psoriasis: the EUROPSO patient membership survey . Br J Dermatol. 2006; ; 155 : :729.–736. 4.
Acosta-Rodriguez EV, Rivino L, Geginat J, et al. Surface phenotype and antigenic specificity of human interleukin 17-producing T helper memory cells . Nat Immunol. 2007; ; 8 : :639.–646. 5.
Leung-Theung-Long S, Guerder S. Les cellules Th17 cells, une nouvelle population de cellules T CD4 effectrices pro-inflammatoires . Med Sci (Paris). 2008; ; 24 : :972.–976. 6.
Yssel H, Bensussan A. Existe-t-il dans la peau une nouvelle population lymphocytaire Th22 distincte des lymphocytes Th17 ? Med Sci (Paris). 2010; ; 26 : :12.–14. 7.
Bettelli E, Carrier Y, Gao W, et al. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells . Nature. 2006; ; 441 : :235.–238. 8.
Aggarwal S, Ghilardi N, Xie MH, et al. Interleukin-23 promotes a distinct CD4 T cell activation state characterized by the production of interleukin-17 . J Biol Chem. 2003; ; 278 : :1910.–1914. 9.
Langrish CL, Chen Y, Blumenschein WM, et al. IL-23 drives a pathogenic T cell population that induces autoimmune inflammation . J Exp Med. 2005; ; 201 : :233.–240. 10.
Ma HL, Liang S, Li J, et al. IL-22 is required for Th17 cell-mediated pathology in a mouse model of psoriasis-like skin inflammation . J Clin Invest. 2008; ; 118 : :597.–607. 11.
Leonardi CL, Kimball AB, Papp KA, et al. Efficacy and safety of ustekinumab, a human interleukin-12/23 monoclonal antibody, in patients with psoriasis: 76-week results from a randomised, double-blind, placebo-controlled trial (PHOENIX 1) . Lancet. 2008; ; 371 : :1665.–1674. 12.
Krueger JG, Ferris LK, Menter A, et al. Anti-IL-23A mAb BI 655066 for treatment of moderate-to-severe psoriasis: Safety, efficacy, pharmacokinetics, and biomarker results of a single-rising-dose, randomized, double-blind, placebo-controlled trial . J Allergy Clin Immunol. 2015; ; 136 : :116.–124.e7. 13.
Papp K, Thaçi D, Reich K, et al. Tildrakizumab (MK-3222), an anti- IL-23p19 monoclonal antibody, improves psoriasis in a phase 2b randomized placebo-controlled trial . Br J Dermatol. 2015; ; 173 : :930.–939. 14.
Kopp T, Riedl E, Bangert C, et al. Clinical improvement in psoriasis with specific targeting of interleukin-23 . Nature. 2015; ; 521 : :222.–226. 15.
Wolk K, Witte E, Wallace E, et al. IL-22 regulates the expression of genes responsible for antimicrobial defense, cellular differentiation, and mobility in keratinocytes: a potential role in psoriasis . Eur J Immunol. 2006; ; 36 : :1309.–1323. 16.
Zheng Y, Danilenko DM, Valdez P, et al. Interleukin-22, a T(H)17 cytokine, mediates IL-23-induced dermal inflammation and acanthosis . Nature. 2007; ; 445 : :648.–651. 17.
Papp KA, Langley RG, Sigurgeirsson B, et al. Efficacy and safety of secukinumab in the treatment of moderate-to-severe plaque psoriasis: a randomized, double-blind, placebo-controlled phase II dose-ranging study . Br J Dermatol. 2013; ; 168 : :412.–421. 18.
Leonardi C, Matheson R, Zachariae C, et al. Anti-interleukin-17 monoclonal antibody ixekizumab in chronic plaque psoriasis . N Engl J Med. 2012; ; 366 : :1190.–1199. 19.
Papp KA, Leonardi C, Menter A, et al. Brodalumab, an anti-interleukin-17-receptor antibody for psoriasis . N Engl J Med. 2012; ; 366 : :1181.–1189. 20.
Nestle FO, Conrad C, Tun-Kyi A, et al. Plasmacytoid predendritic cells initiate psoriasis through interferon-α production . J Exp Med. 2005; ; 202 : :135.–143. 21.
Lowes MA, Kikuchi T, Fuentes-Duculan J, et al. Psoriasis vulgaris lesions contain discrete populations of Th1 and Th17 T cells . J Invest Dermatol. 2008; ; 128 : :1207.–1211. 22.
Oppmann B, Lesley R, Blom B, et al. Novel p19 protein engages IL-12p40 to form a cytokine, IL-23, with biological activities similar as well as distinct from IL-12 . Immunity. 2000; ; 13 : :715.–725. 23.
Cua DJ, Sherlock J, Chen Y, et al. Interleukin-23 rather than interleukin-12 is the critical cytokine for autoimmune inflammation of the brain . Nature. 2003; ; 421 : :744.–748. 24.
Yawalkar N, Karlen S, Hunger R, et al. Expression of interleukin-12 is increased in psoriatic skin . J Invest Dermatol. 1998; ; 111 : :1053.–1057. 25.
Bruch-Gerharz D, Fehsel K, Suschek C, et al. A proinflammatory activity of interleukin 8 in human skin: expression of the inducible nitric oxide synthase in psoriatic lesions and cultured keratinocytes . J Exp Med. 1996; ; 184 : :2007.–2012. 26.
Goebeler M, Toksoy A, Spandau U, et al. The C-X-C chemokine Mig is highly expressed in the papillae of psoriatic lesions . J Pathol. 1998; ; 184 : :89.–95. 27.
Gottlieb AB, Luster AD, Posnett DN, Carter DM. Detection of a gamma interferon-induced protein IP-10 in psoriatic plaques . J Exp Med. 1988; ; 168 : :941.–948. 28.
Griffiths CE, Voorhees JJ, Nickoloff BJ. Characterization of intercellular adhesion molecule-1 and HLA-DR expression in normal and inflamed skin: modulation by recombinant gamma interferon and tumor necrosis factor . J Am Acad Dermatol. 1989; ; 20 : :617.–629. 29.
Lemster BH, Carroll PB, Rilo HR, et al. IL-8/IL-8 receptor expression in psoriasis and the response to systemic tacrolimus (FK506) therapy . Clin Exp Immunol. 1995; ; 99 : :148.–154. 30.
Groves RW, Ross EL, Barker JN, MacDonald DM. Vascular cell adhesion molecule-1: expression in normal and diseased skin and regulation in vivo by interferon gamma . J Am Acad Dermatol. 1993; ; 29 : :67.–72. 31.
Xia YP, Li B, Hylton D, et al. Transgenic delivery of VEGF to mouse skin leads to an inflammatory condition resembling human psoriasis . Blood. 2003; ; 102 : :161.–168. 32.
Lee E, Trepicchio WL, Oestreicher JL, et al. Increased expression of interleukin 23 p19 and p40 in lesional skin of patients with psoriasis vulgaris . J Exp Med. 2004; ; 199 : :125.–130. 33.
Luo J, Wu S-J, Lacy ER, et al. Structural basis for the dual recognition of IL-12 and IL-23 by ustekinumab . J Mol Biol. 2010; ; 402 : :797.–812. 34.
Wilson NJ, Boniface K, Chan JR, et al. Development, cytokine profile and function of human interleukin 17-producing helper T cells . Nat Immunol. 2007; ; 8 : :950.–957. 35.
Segura E, Touzot M, Bohineust A, et al. Human inflammatory dendritic cells induce Th17 cell differentiation . Immunity. 2013; ; 38 : :336.–348. 36.
Brembilla NC, Montanari E, Truchetet M-E, et al. Th17 cells favor inflammatory responses while inhibiting type I collagen deposition by dermal fibroblasts: differential effects in healthy and systemic sclerosis fibroblasts . Arthritis Res Ther. 2013; ; 15 : :R151.. 37.
Cheung PFY, Wong CK, Lam CWK. Molecular mechanisms of cytokine and chemokine release from eosinophils activated by IL-17A, IL-17F, and IL-23: implication for Th17 lymphocytes-mediated allergic inflammation . J Immunol. 2008; ; 180 : :5625.–5635. 38.
Schwarzenberger P, Huang W, Ye P, et al. Requirement of endogenous stem cell factor and granulocyte-colony-stimulating factor for IL-17-mediated granulopoiesis . J Immunol. 2000; ; 164 : :4783.–4789. 39.
Ogura H, Murakami M, Okuyama Y, et al. Interleukin-17 promotes autoimmunity by triggering a positive-feedback loop via interleukin-6 induction . Immunity. 2008; ; 29 : :628.–636. 40.
Farhi D, Dupin N. Les biothérapies dans le psoriasis . Presse Med. 2009; ; 38 : :832.–843. 41.
Viguier M, Richette P, Bachelez H, et al. Paradoxical adverse effects of anti-TNF-alpha treatment: onset or exacerbation of cutaneous disorders . Exp Rev Clin Immunol. 2009; ; 5 : :421.–431. 42.
Tauber M, Beneton N, Reygagne P, et al. Alopecia areata developing during ustekinumab therapy: report of two cases . Eur J Dermatol. 2013; ; 23 : :912.–913. 43.
Tauber M, Buche S, Reygagne P, et al. Alopecia areata occurring during anti-TNF therapy: a national multicenter prospective study . J Am Acad Dermatol. 2014; ; 70 : :1146.–1149. 44.
Shale M, Kanfer E, Panaccione R, Ghosh S. Hepatosplenic T cell lymphoma in inflammatory bowel disease . Gut. 2008; ; 57 : :1639.–1641. 45.
Griffiths CEM, Reich K, Lebwohl M, et al. Comparison of ixekizumab with etanercept or placebo in moderate-to-severe psoriasis (UNCOVER-2 and UNCOVER-3): results from two phase 3 randomised trials . Lancet. 2015; ; 386 : :541.–551. 46.
Langley RG, Elewski BE, Lebwohl M, et al. Secukinumab in plaque psoriasis: results of two phase 3 trials . N Engl J Med. 2014; ; 371 : :326.–338. 47.
Bonnet MC, Bagot M, Bensussan A. Anticorps monoclonaux ciblant l’IL-17A ou son récepteur dans le psoriasis : une nouvelle approche thérapeutique ? Med Sci (Paris). 2012; ; 28 : :1035.–1037. 48.
Bachelez H, van de Kerkhof PC, Strohal R, et al. OPT compare investigators. Tofacitinib versus etanercept or placebo in moderate-to-severe chronic plaque psoriasis: a phase 3 randomised non-inferiority trial . Lancet. 2015; ; 386 : :552.–561. 49.
Duhen T, Geiger R, Jarrossay D, et al. Production of interleukin 22 but not interleukin 17 by a subset of human skin-homing memory T cells . Nat Immunol. 2009; ; 10 : :857.–863. 50.
Trifari S, Kaplan CD, Tran EH, et al. Identification of a human helper T cell population that has abundant production of interleukin 22 and is distinct from T(H)-17, T(H)1 and T(H)2 cells . Nat Immunol. 2009; ; 10 : :864.–871. |