| |
| Med Sci (Paris). 2016 March; 32(3): 246–248. Published online 2016 March 23. doi: 10.1051/medsci/20163203007.Des cellules NK mémoire découvertes chez les primates Thierry Walzer1* and Antoine Marçais1 1CIRI, centre international de recherche en infectiologie, université de Lyon, Inserm, U1111, École Normale Supérieure de Lyon, CNRS, UMR5308, Lyon, France MeSH keywords: Animaux, Haplorhini, Humains, Mémoire immunologique, Cellules tueuses naturelles, Souris, Primates, immunologie, cytologie |
Cellules NK mémoire chez la souris Un nombre grandissant d’articles prête aux cellules natural killer (NK) des propriétés dites adaptatives [13] (→).
(→) Voir la Synthèse de E. Narni-Mancinelli et al. m/s n° 4, avril 2013, page 389
Les cellules NK, identifiées dans les années 1970, constituent pourtant le membre fondateur de la famille des cellules lymphoïdes innées (ILC, innate lymphoid cells) [14] (→).
(→) Voir la Synthèse de M. Cherrier, m/s n° 3, mars 2014, page 280
Leur système de reconnaissance des cellules cibles repose sur un jeu de récepteurs, activateurs et inhibiteurs, exprimés de façon combinatoire, chaque récepteur étant exprimé sur tout ou partie des cellules NK, constituant ainsi un répertoire de diversité limitée. Le concept de « NK mémoire » est né de l’observation que des souris dépourvues de lymphocytes T et B étaient capables de réponses « mémoire » (c’est-à-dire de répondre plus rapidement à des antigènes auxquelles elles avaient été précédemment exposées) après une immunisation par des haptènes1, dans un modèle d’hypersensibilité de contact2 [1]. La réponse mémoire décrite dans cette étude reposait en effet sur les cellules NK. Même si certaines de ces observations initiales n’ont pas été reproduites [2], de nombreux articles ont maintenant confirmé que les cellules NK se rapprochaient des lymphocytes T par différents aspects, comme la possibilité d’expansion clonale et de persistance à long terme après une activation, la capacité de réponse mémoire, notamment suite à des changements des marques épigénétiques, et enfin dans différents contextes, l’habilité à répondre de façon spécifique à l’antigène [3]. Le modèle de l’infection par le virus MCMV (mouse cytomegalovirus), dans lequel les cellules NK Ly49H+3, prolifèrent lors de la reconnaissance de la protéine m157 du virus exprimée sur les cellules infectées, a notamment permis de bien mieux comprendre les mécanismes de la mémoire NK [3]. De façon importante, chez la souris et dans plusieurs modèles expérimentaux, les cellules NK mémoire sont capables de conférer une protection contre des virus précédemment rencontrés, ce qui suscite un intérêt croissant, notamment dans le domaine de la recherche sur les vaccins. |
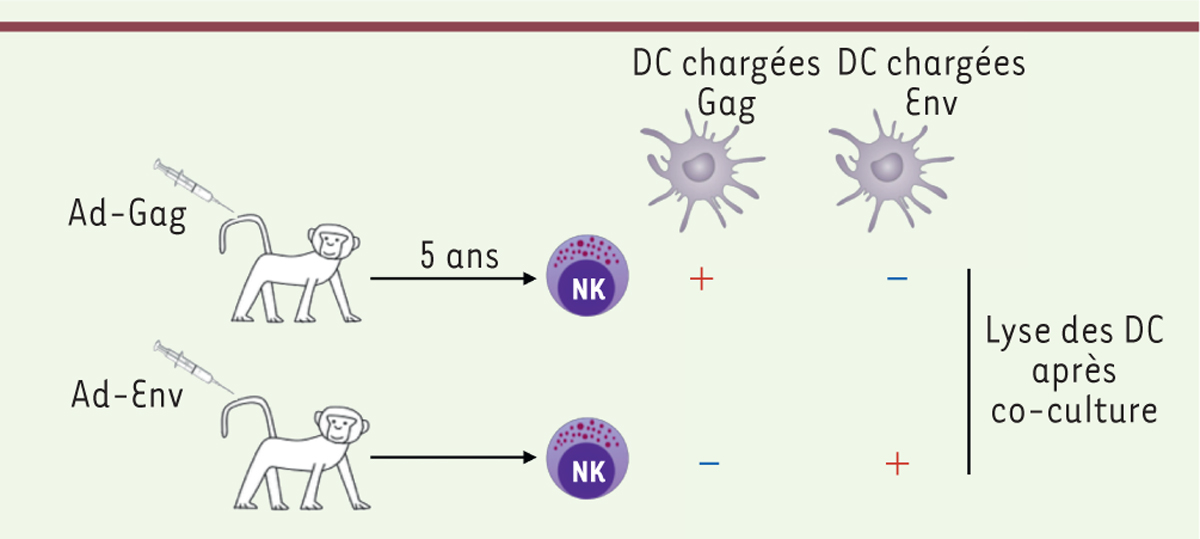
Cellules NK mémoire chez les singes Un article récent publié dans Nature Immunology rapporte l’identification de cellules NK mémoire antigène spécifiques, chez les macaques rhésus [4]. Dans cet article, les auteurs ont d’abord montré que les cellules NK de singes chroniquement infectés par deux souches de SIV (simian immunodeficiency virus, l’équivalent du virus de l’immunodéficience humaine - VIH) étaient capables de lyser, de façon beaucoup plus efficace que des cellules NK naïves, des cellules dendritiques autologues chargées avec les antigènes Gag ou Env4, provenant du virus SIV afin qu’elles les présentent. Les cellules dendritiques non chargées étaient en revanche ignorées par ces cellules NK. Dans une deuxième série d’expériences, les auteurs ont utilisé des singes vaccinés avec des particules virales d’adénovirus non réplicatif exprimant les antigènes Gag ou Env. Cinq ans après la vaccination, les cellules NK isolées de ces singes étaient capables de lyser des cellules dendritiques chargées avec l’antigène (Gag ou Env) pour lequel les singes avaient été vaccinés, mais pas des cellules dendritiques chargées avec un autre antigène (Figure 1). Ces résultats démontrent ainsi, premièrement, la capacité de persistance à très long terme de la mémoire NK, mais aussi la capacité des cellules NK mémoire à répondre de façon spécifique de l’antigène. Dans cet article, et compte tenu des limites du modèle d’étude, les auteurs ont réalisé un grand nombre de contrôles indirects visant à exclure la possibilité que des cellules T mémoire contaminantes soient à l’origine des résultats observés. Il reste que plusieurs points de cette étude sont contestables, notamment le système expérimental in vitro, utilisant une culture de 18h des cellules NK avec les cibles, qui paraît plus approprié pour mesurer la cytotoxicité des lymphocytes T que celle des cellules NK, classiquement mesurée en 4h. Mais le point le plus important concerne les bases de la spécificité des cellules NK mémoire. Les auteurs montrent que des anticorps anti-NKG2A ou anti-NKG2C5 bloquent la lyse des cellules dendritiques par les cellules NK, ce qui suggère que NKG2A et NKG2C pourraient participer à la reconnaissance des cellules-cibles. Il est cependant difficile d’imaginer comment ces seules molécules permettraient de reconnaître et de discriminer différents antigènes tels que Gag et Env, ce qui n’est pas discuté dans l’article.
 | Figure 1.
Mémoire NK antigène-spécifique chez le singe. Des singes rhésus ont été vaccinés avec des particules adénovirales exprimant Gag ou Env. Cinq ans après, les cellules NK ont été extraites et purifiées de la rate ou du foie et leur capacité à lyser des DC autologues préalablement chargées avec Gag ou Env a été mesurée après co-culture. Le « + » rouge indique la lyse. Ad-Gag : particule adénovirale exprimant Gag ; Ad-Env : particule adénovirale exprimant Env ; DC : cellule dendritique. |
|
Cellules NK mémoire chez l’homme ? L’expression de NKG2C est caractéristique d’une population de cellules NK, très augmentée chez les patients humains séropositifs pour le cytomégalovirus humain (HCMV) [5, 6]. Ces cellules NK NKG2C+, qui co-expriment souvent CD57 (un marqueur des cellules NK cytotoxiques), sont maintenues à long terme chez les patients ayant déjà été infectés par HCMV et prolifèrent lors d’une réinfection ou d’une co-infection par d’autres virus. La prolifération de ces cellules NKG2C+ nécessite notamment l’expression, induite par le HCMV, de HLA-E (HLA [human leukocyte antigen] class I histocompatibility antigen, alpha chain E), le ligand de NKG2C, ainsi que de l’interleukine (IL)-12 produite par les monocytes [7]. De plus, l’expansion des cellules NK NKG2C+ suite à une infection par des virus comme celui de l’hépatite C [8] ou le chikungunya [9], n’est observée que chez les patients précédemment infectés par le HCMV, ce qui suggère que les cellules NK NKG2C+ sont bien spécifiques du HCMV et pourraient proliférer par réaction hétérologue ou suite à une réactivation infra-clinique du HCMV lors des co-infections. De nombreuses questions demeurent cependant concernant ces cellules NKG2C+.
-
Sont-elles vraiment efficaces dans la réponse antivirale ? Certaines données suggèrent notamment qu’elles pourraient avoir une fonction diminuée [10], à la manière des lymphocytes T victimes d’« épuisement » lors des infections chroniques.
-
Quelle est la base de leur spécificité ? Un article récent a montré qu’une population de cellules négatives pour FcεRIγ (Fc receptor, IgE, high affinity I, gamma polypeptide), et présentant des similarités avec les cellules NK NKG2C+, montrait des capacités de cytotoxicité dépendante des anticorps (ADCC) très augmentées vis-à-vis de cellules cibles infectées par des virus et recouvertes d’anticorps [11]. Ces données suggèrent que la spécificité des cellules NK mémoire pourrait être conférée par les anticorps qu’elles reconnaissent via leur récepteur des immunoglobulines, FCγRIIIA (Fc gamma receptor type IIIA ou CD16). Une autre possibilité serait que des combinaisons particulières de récepteurs activateurs et inhibiteurs soient à la base de la spécificité NK. De nouveaux outils comme la cytométrie de masse, qui permettent de mesurer simultanément l’expression de plusieurs dizaines de récepteurs, ont récemment permis de montrer l’évolution du répertoire des populations NK, lors des infections ou avec l’âge, et de mieux estimer sa complexité [12]. Ces nouvelles techniques apporteront peut-être des explications quant aux bases de la spécificité NK.
-
Sont-elles issues d’une sous-population particulière ? La localisation strictement hépatique des cellules NK mémoire chez la souris, liée à l’expression de CXCR6 (chemokine [C-X-C motif] receptor 6), et la localisation strictement hépatosplénique chez le singe [3], suggèrent que les cellules NK mémoire pourraient constituer un lignage de cellules lymphoïdes innées (ILC) à part, peuplant majoritairement le foie. Dans cette hypothèse, il reste à déterminer si ces ILC adaptatives seraient liées aux cellules NKG2C+ circulant chez l’homme. Ces dernières n’ont pas encore été étudiées ailleurs que dans le sang.
|
Les auteurs déclarent n’avoir aucun conflit d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
O’Leary JG, Goodarzi M, Drayton DL, et al. T cell- and B cell-independent adaptive immunity mediated by natural killer cells . Nat Immunol. 2006; ; 7 : :16.. 2.
Rouzaire P, Luci C, Blasco E, et al. Natural killer cells and T cells induce different types of skin reactions during recall responses to haptens . Eur J Immunol. 2012; ; 42 : :80.–88. 3.
O’Sullivan TE, Sun JC, Lanier LL. Natural killer cell memory . Immunity. 2015; ; 43 : :634.–645. 4.
Reeves RK, Li H, Jost S, et al. Antigen-specific NK cell memory in rhesus macaques . Nat Immunol. 2015; ; 16 : :927.–932. 5.
Gumá M, Angulo A, Vilches C, et al. Imprint of human cytomegalovirus infection on the NK cell receptor repertoire . Blood. 2004; ; 104 : :3664.–3671. 6.
Lopez-Vergès S, Milush JM, Schwartz BS, et al. Expansion of a unique CD57+NKG2Chi natural killer cell subset during acute human cytomegalovirus infection . Proc Natl Acad Sci USA. 2011; ; 108 : :14725.–14732. 7.
Rölle A, Pollmann J, Ewen EM, et al. IL-12-producing monocytes and HLA-E control HCMV-driven NKG2C+ NK cell expansion . J Clin Invest. 2014; ; 124 : :5305.–5316. 8.
Béziat V, Dalgard O, Asselah T, et al. CMV drives clonal expansion of NKG2C+ NK cells expressing self-specific KIRs in chronic hepatitis patients . Eur J Immunol. 2012; ; 42 : :447.–457. 9.
Petitdemange C, Becquart P, Wauquier N, et al. Unconventional repertoire profile is imprinted during acute chikungunya infection for natural killer cells polarization toward cytotoxicity . PLoS Pathog. 2011; ; 7 : :e1002268.. 10.
Schlums H, Cichocki F, Tesi B, et al. Cytomegalovirus infection drives adaptive epigenetic diversification of NK cells with altered signaling and effector function . Immunity. 2015; ; 42 : :443.–456. 11.
Zhang T, Scott JM, Hwang I, et al. Cutting edge: antibody-dependent memory-like NK cells distinguished by FcRγ deficiency . J Immunol. 1950; ; 2013 ((190)) : :1402.–1406. 12.
Strauss-Albee DM, Fukuyama J, Liang EC, et al. Human NK cell repertoire diversity reflects immune experience and correlates with viral susceptibility . Sci Transl Med. 2015; ; 7 : :297ra115.. 13.
Narni-Mancinelli E, Ugolini S, Vivier E. Les cellules natural killer. Med Sci (Paris). 2013; ; 29 : :389.–395. 14.
Cherrier M. Les cellules lymphoïdes innées. Med Sci (Paris). 2014; ; 30 : :280.–288. |