| |
| Med Sci (Paris). 2016 March; 32(3): 244–246. Published online 2016 March 23. doi: 10.1051/medsci/20163203006.Lymphocytes T et cellules myéloïdes coopèrent au sein de la tumeur après vaccination Maxime Thoreau,1* Nadège Bercovici,1 and Alain Trautmann1 1Institut Cochin, université Paris-Descartes, Sorbonne Paris Cité, CNRS UMR 8104, Inserm U1016, département Infection, Immunité, Inflammation, 22, rue Méchain, 75014Paris, France MeSH keywords: Animaux, Lymphocytes T CD8+, Vaccins anticancéreux, Communication cellulaire, Humains, Souris, Mimétisme moléculaire, Cellules myéloïdes, Tumeurs, Lymphocytes T, Vaccination, Vaccins antiviraux, physiologie, immunologie |
Depuis quelques années, l’immunothérapie anti-tumorale est considérée comme un traitement d’avenir [12] (→).
(→) Voir la Synthèse de E. Tartour E et al., m/s n° 10, octobre 2011, page 833
À la différence des traitements standards en oncologie, cette approche permettrait de mettre en place une mémoire immunitaire, c’est-à-dire une protection à long terme de l’organisme contre les cellules tumorales. La plupart des recherches dans ce domaine se concentrent sur deux notions : le potentiel cytotoxique des lymphocytes T CD8 [1] et l’inhibition de ces réponses T par les cellules myéloïdes (monocytes/macrophages), considérées comme des cellules pro-tumorales [2]. Les essais de traitements dérivés de ces notions visent à réduire le potentiel « suppresseur » des cellules myéloïdes et à stimuler la réponse T cytotoxique. Dans des modèles murins de tumeurs, de tels traitements ne provoquent, la plupart du temps, que des ralentissements de la croissance tumorale et non des régressions. Leur efficacité reste donc limitée. Notre objectif a été de nous placer dans un contexte de régression tumorale, dans lequel la réponse immune est vraiment efficace, et d’analyser les rôles et les cinétiques d’infiltration intra-tumorale des populations immunitaires impliquées dans cette régression. |
Mimer une réponse antivirale peut provoquer une régression tumorale Nous avons induit la régression de tumeurs murines TC11 transplantées, en nous inspirant des travaux de W. Coley. Au début du XXe siècle, ce pionnier de l’immunothérapie avait en effet observé des régressions de tumeurs chez ses patients après injection de bactéries inactivées [3]. Nous avons donc mimé une réponse anti-infectieuse, capable de provoquer une fonte de la masse tumorale, à l’aide d’un vaccin composé d’une sous-unité de la toxine de Shiga2 couplée à un peptide long (E7), exprimé par les cellules tumorales TC1 [4]. Ce vaccin a été combiné à l’interféron-α (IFN-α) afin de mimer une infection virale [5] au niveau du foyer tumoral. Après 8 jours de ce traitement combiné, la régression est systématiquement amorcée [6]. |
La coexistence intra-tumorale des lymphocytes T CD8 et des cellules myéloïdes est nécessaire à la régression L’analyse d’un infiltrat tumoral à un instant donné ne fournit aucune information sur les caractéristiques dynamiques de la réponse immune. En outre, la rareté des prélèvements de tumeurs humaines en régression ne permet pas de bien documenter les réponses immunitaires efficaces. Le modèle murin que nous avons choisi permet d’analyser en détail la cinétique de la réponse immunitaire induite à la suite d’une vaccination anti-tumorale. Dans ce modèle, le couplage de l’antigène E7 à une sous-unité B non toxique d’un mutant de toxine Shiga favorise une présentation croisée par les molécules du complexe majeur d’histocompatibilité (MHC, major histocompatibility complex) de classe I [4]. En considérant ce résultat, ainsi que le rôle des lymphocytes T CD8 dans l’élimination des pathogènes lors d’infections bactériennes ou virales, nous nous attendions à observer une forte augmentation du nombre de ces cellules lors de la réponse immune. Ce fut en effet le cas, à ceci près que l’infiltration massive par des lymphocytes T CD8 débutait 8 jours après la vaccination, après que la tumeur ait amorcé sa régression. Cette observation a été déterminante dans la suite de notre exploration. L’analyse de l’infiltrat myéloïde révèle que les cellules myéloïdes, déjà présentes en nombre non négligeable dans les tumeurs en progression, infiltrent fortement la tumeur trois jours avant les lymphocytes. Leur abondance, avant la phase de régression et l’infiltration tardive des lymphocytes T CD8, amène à s’interroger sur les rôles respectifs de chacune de ces populations dans la régression tumorale induite par la vaccination. Pour répondre à cette question, nous avons éliminé les lymphocytes T CD8 in vivo, ce qui a eu pour effet d’abolir l’efficacité du vaccin. Les mécanismes potentiels de recrutement de ces cellules lymphoïdes incluent les chimiokines CXCL9 et CXCL10 (chemokine [C-X-C motif] ligand 9/10), sécrétées par les cellules myéloïdes. L’action de ces chimiokines implique le récepteur CXCR3 (chemokine [C-X-C motif] receptor 3) présent à la surface des lymphocytes T. Dans des souris déficientes en CXCR3, nous avons montré que l’infiltration des lymphocytes T CD8 dans la tumeur est inhibée d’un facteur 4, sans que cela affecte pour autant la régression induite par le vaccin. L’ensemble de ces résultats permet de tirer deux conclusions: (1) même en faible nombre, les lymphocytes T CD8 ont une importante efficacité anti-tumorale, et (2) dans ces conditions, ils ne peuvent pas être les seuls effecteurs directs anti-tumoraux. Ce résultat inattendu, combiné à celui de l’infiltration précoce des cellules myéloïdes, nous a conduits à supprimer une partie de ces cellules dans la tumeur en utilisant le PLX3397, un inhibiteur de la signalisation CSF1/CSF1R (colony stimulating factor 1/CSF1 receptor) [7]. Le CSF1 (ou M-CSF, macrophage colony stimulating factor) est un facteur de croissance induisant la différenciation, la prolifération et la migration des monocytes/macrophages dans les tissus [8]. Suite au traitement par le PLX3397, qui réduit d’un facteur 5 le nombre de macrophages intra-tumoraux, le vaccin ne provoque plus de régression mais seulement une stabilisation de la tumeur. Ainsi, une suppression partielle des cellules myéloïdes a davantage de conséquences sur la régression tumorale qu’une suppression partielle des lymphocytes T CD8. Mais ce qui altère le plus l’efficacité vaccinale est la suppression totale des lymphocytes T CD8. Malgré de nombreux essais, il n’a pas été possible d’obtenir une suppression totale des cellules myéloïdes intra-tumorales. Cependant, ces résultats montrent que les infiltrations intra-tumorales des cellules lymphoïdes et myéloïdes sont toutes deux nécessaires à l’efficacité de la réponse anti-tumorale. |
Lymphocytes T et cellules myéloïdes coopèrent dans la tumeur Certains macrophages intra-tumoraux sont capables de faciliter l’extravasation3 des cellules tumorales, et donc l’apparition de métastases, et de promouvoir la néo-angiogénèse [9, 14] (→). De plus, ces cellules ont le potentiel de neutraliser les lymphocytes T via de multiples mécanismes dont l’expression, par exemple, des ligands de PD-1 (programmed cell death-1) et CTLA-4 (cytotoxic T lymphocyte-associated protein 4) [13] (→).
(→) Voir la Synthèse de L. Treps et J. Gavard, m/s n° 11, novembre 2015, page 989
(→) Voir l’Éditorial de J.L. Teillaud, m/s n° 8-9, août-septembre 2015, page 707
Cependant, dans d’autres contextes, les macrophages sont nécessaires au bon déroulement d’une réponse immunitaire, par exemple lors d’une infection. L’analyse phénotypique des cellules myéloïdes présentes durant la régression a révélé l’expression de marqueurs d’activation tels que CD86 ou des molécules du complexe majeur d’histocompatibilité (MHC) de classe II. Un résultat remarquable, obtenu chez les souris vaccinées et traitées avec des anti-CD8, est la diminution de l’acquisition de ces marqueurs du CMH de classe II par les cellules myéloïdes. Ces dernières ont donc besoin des lymphocytes T CD8 pour être pleinement activées. L’interféron gamma (IFNγ) fait partie des cytokines sécrétées par les lymphocytes T CD8, capables d’activer les cellules myéloïdes lors de réponses anti-infectieuses [10]. Dans des souris déficientes pour l’IFNγ, les monocytes/macrophages ne sont plus activés après vaccination et le vaccin perd une grande partie de son efficacité puisqu’il ne provoque plus de régression. Cela suggère fortement que l’activation des cellules myéloïdes est en partie due aux lymphocytes T CD8 et dépend de la sécrétion d’IFNγ. |
Les cellules myéloïdes peuvent contribuer directement à l’élimination des cellules tumorales Afin de tester les capacités cytotoxiques des macrophages intra-tumoraux, nous avons effectué des expériences in vitro avec des macrophages purifiés de tumeurs en progression ou en régression. Ces cellules ont été cultivées pendant 48h en présence de cellules tumorales. Seuls des monocytes/macrophages provenant de tumeurs vaccinées pouvaient provoquer la mort d’une partie des cellules tumorales. Cette cytotoxicité était abolie par des anticorps bloquant le TNFα (tumor necrosis factor alpha), mais n’était pas altérée par des inhibiteurs de ROS (reactive oxygen species), deux médiateurs toxiques produits par les macrophages. |
Il ne fait pas de doute que l’implication des macrophages dans la maintenance des tissus et dans les phénomènes inflammatoires leur permet d’avoir des effets pro-tumoraux dans des tumeurs en croissance. Cette réalité fait trop souvent oublier (sauf quelques exceptions [11]) que les macrophages peuvent aussi contribuer activement aux réponses immunitaires, y compris anti-tumorales. Notre équipe a montré, dans un modèle de régression tumorale causée par une vaccination mimant une infection virale, que la réponse immune mise en place requiert la présence des cellules myéloïdes, incluant les macrophages, et des lymphocytes au cœur de la tumeur. Cette coopération efficace des macrophages et des lymphocytes est schématisée dans la Figure 1. Nous défendons l’idée que les futurs traitements par immunothérapie devraient plus prendre en compte la possibilité de telles coopérations entre cellules T et macrophages, dont l’efficacité n’est plus à démontrer dans les réponses anti-infectieuses.
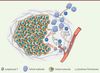 | Figure 1.
Coopération lymphocytes T/cellules myéloïdes lors de la réponse immunitaire anti-tumorale induite par la vaccination. La vaccination provoquant une régression tumorale implique une réponse immune qui peut être schématisée ainsi : (1) une infiltration précoce de cellules myéloïdes fait suite à la vaccination, (2) ces monocytes/macrophages recrutent les lymphocytes T CD8 grâce à la production de CXCL9/CXCL10, (3) les lymphocytes et les cellules myéloïdes engagent une coopération dépendante de l’IFNγ aboutissant à l’activation myéloïde, (4) la régression tumorale est provoquée par la double cytotoxicité directe des cellules lymphocytes T CD8 et des monocytes/macrophages (notamment via la sécrétion de TNFα). CXCL9/CXCL10 : chemokine [C-X-C motif] ligand 9/10 ; IFNγ : interféron gamma ; TNFα : tumor necrosis factor alpha. |
|
Les auteurs déclarent n’avoir aucun conflit d’intérêt concernant les données publiées dans cet article.
|
Les auteurs remercient Jeanne Froehlich et Nicolas Abraham pour la relecture de cette nouvelle.
|
Footnotes |
1.
Restifo NP, Dudley ME, Rosenberg SA. Adoptive immunotherapy for cancer: harnessing the T cell response . Nat Rev Immunol. 2012; ; 12 : :269.–281. 2.
Hoves S, Krause SW, Schütz C, et al. Monocyte-derived human macrophages mediate anergy in allogeneic T cells and induce regulatory T cells . J Immunol. 2006; ; 177 : :2691.–2698. 3.
Cann H, A S, Netten V, et al. Dr William Coley and tumour regression: a place in history or in the future . Postgrad Med J. 2003; ; 79 : :672.–680. 4.
Vingert B, Adotevi O, Patin D, et al. The Shiga toxin B-subunit targets antigen in vivo to dendritic cells and elicits anti-tumor immunity . Eur J Immunol. 2006; ; 36 : :1124.–1135. 5.
Müller U, Steinhoff U, Reis LF, et al. Functional role of type I and type II interferons in antiviral defense . Science. 1994; ; 264 : :1918.–1921. 6.
Thoreau M, Penny HL, Tan K, et al. Vaccine-induced tumor regression requires a dynamic cooperation between T cells and myeloid cells at the tumor site . Oncotarget. 2015; ; 6 : :27832.–27846. 7.
Zhu Y, Knolhoff BL, Meyer MA, et al. CSF1/CSF1R blockade reprograms tumor-infiltrating macrophages and improves response to T-cell checkpoint immunotherapy in pancreatic cancer models . Cancer Res. 2014; ; 74 : :5057.–5069. 8.
Hamilton JA. Colony-stimulating factors in inflammation and autoimmunity . Nat Rev Immunol. 2008; ; 8 : :533.–544. 9.
Noy R, Pollard JW. Tumor-associated macrophages: from mechanisms to therapy . Immunity. 2014; ; 41 : :49.–61. 10.
Dalton DK, Pitts-Meek S, Keshav S, et al. Multiple defects of immune cell function in mice with disrupted interferon-gamma genes . Science. 1993; ; 259 : :1739.–1742. 11.
Long KB, Beatty GL. Harnessing the antitumor potential of macrophages for cancer immunotherapy . Oncoimmunology. 2013; ; 2 : :e26860.. 12.
Tartour E, Sandoval F, Bonnefoy JY, Fridman WH. Immunothérapie des cancers . Med Sci (Paris). 2011; ; 27 : :833.–841. 13.
Teillaud JL. Quand les anticorps rencontrent l’immunité antitumorale : fin de partie pour la cellule cancéreuse ? Med Sci (Paris). 2015; ; 31 : :707.–708. 14.
Treps L, Gavard J. L’angiogenèse tumorale : quand l’arbre de vie tourne mal . Med Sci (Paris). 2015; ; 31 : :989.–995. |


