| |
| Med Sci (Paris). 2016 February; 32(2): 152–155. Published online 2016 March 2. doi: 10.1051/medsci/20163202006.La sépiaptérine réductase Une nouvelle cible pour traiter les douleurs neuropathiques Alban Latrémolière1* 1Kirby neurobiology center, Boston children’s hospital and department of neurobiology, Harvard medical school, 3 Blackfan Circle, Boston, MA02115, États-Unis MeSH keywords: Alcohol oxidoreductases, Analgésiques, Animaux, Antienzymes, Variation génétique, Humains, Souris, Thérapie moléculaire ciblée, Névralgie, Nociception, Rodentia, antagonistes et inhibiteurs, génétique, usage thérapeutique, physiologie, méthodes, tendances, thérapie, effets des médicaments et substances chimiques |
La majorité des nouvelles molécules à visée analgésique développées au cours des deux dernières décennies a échoué au stade des essais cliniques de phase 2. Les recherches précliniques ont identifié de très nombreux facteurs essentiels pour la transmission de l’information douloureuse. Cependant, parmi les molécules efficaces pour bloquer le développement de douleurs chroniques chez les rongeurs, très peu ont conservé leurs propriétés analgésiques chez les patients [1]. Le constat de ces échecs est que, à quelques exceptions près, les traitements contre les douleurs chroniques n’ont fondamentalement pas changé, et ne visent que très peu de cibles biologiques. Les douleurs neuropathiques sont des douleurs chroniques survenant suite à une atteinte du système nerveux, notamment une lésion du système somatosensoriel1,. Les patients souffrant de douleurs neuropathiques présentent des symptômes dits « négatifs » (perte du tact fin) ainsi que « positifs » (hyperalgésie2,, allodynie3 et douleurs spontanées, permanentes ou bien paroxystiques). À l’heure actuelle, la première ligne de médication pour traiter ces douleurs est constituée par les anticonvulsivants (pregabalin/gabapentin), les antidépresseurs (inhibiteur de recapture spécifiques ou mixtes) ou encore les opiacés (morphine). Ces traitements présentent une efficacité modérée et sont associés à de très nombreux effets secondaires indésirables, à tel point que les patients sont parfois obligés d’arrêter leur prise médicamenteuse. La morphine, particulièrement, pose un grave problème de santé publique, surtout aux États-Unis, où le nombre de cas d’addiction ou de décès par dépression respiratoire à la suite d’overdose médicamenteuse a explosé au cours des dernières années. Il est donc extrêmement important de développer de nouvelles stratégies médicamenteuses dirigées contre des cibles biologiques inédites. |
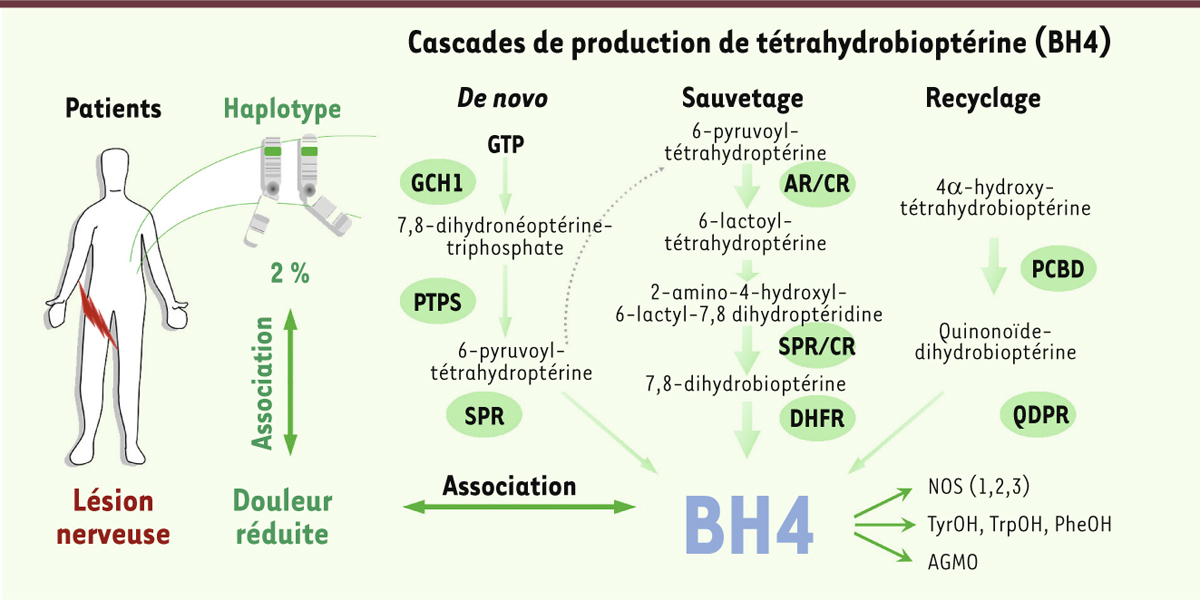
Une variation génétique protectrice Afin d’augmenter les chances de succès sur le plan translationnel, nous nous sommes basés sur des résultats génétiques chez des patients pour choisir une cible cellulaire potentielle [2]. Notre hypothèse était que des variations génétiques, possédant un effet modeste mais bien représentées dans la population, étaient plus susceptibles de conduire à des traitements médicamenteux réduisant les douleurs pathologiques tout en conservant la nociception4. En 2006, des analyses d’associations génétiques, réalisées par les laboratoires de Clifford Woolf et Mitchell Max aux États-Unis, ont identifié un haplotype5 situé dans le locus du gène GTP cyclohydrolase 1 (Gch1), présent à l’état homozygote dans environ 2 % de la population générale, qui conférait aux porteurs une certaine protection contre les douleurs chroniques après une chirurgie pour traiter leur hernie discale [3]. Alors que la majorité des patients nécessitaient un suivi post-opératoire pour traiter une douleur persistante, les porteurs de l’haplotype « protecteur » récupéraient beaucoup plus rapidement (Figure 1).
 | Figure 1.
Découverte d’un haplotype dans le locus du gène Gch1 chez des patients après une lésion nerveuse. Les patients porteurs de cet haplotype, présent à l’état homozygote dans environ 2 % de la population générale, développent moins de douleurs chroniques. GCH1 fait partie de la voie de synthèse de la tétrahydrobioptérine (BH4), un cofacteur essentiel pour le fonctionnement des NOS, tryrosine-, tryptophane- et phénylalanine hydroxylase ainsi que l’enzyme AGMO. Les porteurs de l’haplotype « protecteur » de GCH1 produisent moins de BH4 in vitro, suggérant qu’une réduction des niveaux de BH4 pourrait réduire les manifestations douloureuses. GCH1 : GTP cyclohydrolase 1; PTPS : pyruvoyl-tétrahydrobioptérine synthase; SPR : sépiaptérine réductase ; AR : aldokéto réductase ; CR : carbonyl réductase; DHFR : dihydrofolate réductase; PCBD : ptérine-4α-carbinolamine déhydratase; QDPR : quinoïde dihydroptéridine réductase ; NOS : monoxyde d’azote synthase ; TyrOH : tyrosine hydroxylase ; TrpOH : tryptophane hydroxylase ; PheOH : phénylalanine hydroxylase ; AGMO : alkyl glycérol mono-oxygénase. |
GCH1 est la première enzyme (et l’enzyme limitante) de la cascade synthétique pour la production de la tétrahydrobioptérine (BH4), un cofacteur essentiel pour le fonctionnement de nombreuses autres enzymes : les trois isoformes de la monoxyde d’azote synthase (NOS), la phénylalanine hydroxylase (PheOH), la tyrosine hydroxylase (TyrOH), les deux isoformes de la tryptophane hydroxylase (TrpOH), ainsi que l’alkyl glycérol mono-oxygénase (AGMO) (Figure 1). Les niveaux cellulaires de BH4 sont de fait critiques pour la production d’oxyde nitrique, dopamine, noradrénaline, sérotonine et des éthers de glycérol. Cet haplotype « protecteur » de Gch1 a depuis été confirmé dans plus de 10 cohortes indépendantes de patients souffrant de douleurs chroniques aux étiologies variées [4, 5], confirmant que GCH1, et les niveaux de BH4, étaient pertinents au niveau clinique. En parallèle de ces études, des analyses d’expression génétique du génome entier, réalisées chez le rat à partir de ganglions des racines dorsales6, dans différents modèles précliniques de douleurs neuropathiques, ont confirmé que, chez cette espèce, il y avait une surproduction de GCH1 ainsi que d’autres enzymes responsables de la production de BH4 dans ce tissu [3]. |
La tétrahydrobioptérine influence les douleurs neuropathiques périphériques chez le rongeur Afin de mieux caractériser le rôle de BH4 dans les douleurs neuropathiques, et tester si cibler la production de ce cofacteur représentait une stratégie viable pour traiter cette pathologie, nous nous sommes tournés vers les outils génétiques disponibles chez la souris. En utilisant des souris rapportrices pour la transcription de Gch1, nous avons découvert que deux types cellulaires surexpriment ce gène, engageant la cascade synthétique de BH4 après une lésion nerveuse: les neurones sensoriels axotomisés7 et les macrophages « activés » qui infiltrent le site de lésion. De façon intéressante, la protéine GCH1 synthétisée par les neurones sensoriels est transportée le long de l’axone vers la périphérie, donc vers la lésion. Les neurones et les macrophages participent ainsi à l’augmentation de BH4 au niveau du tissu nerveux lésé. En revanche, aucun changement dans la voie de production de BH4 n’est décelé dans la moelle épinière ou le cerveau après une lésion nerveuse, suggérant que le rôle de BH4 dans le développement des douleurs neuropathiques a une origine principalement périphérique. Pour tester ceci nous avons utilisé une approche par gain/perte de fonction, en développant des souris transgéniques, tissu-spécifiques et inductibles, avec la technique de recombinaison Cre-lox [6] (→).
(→) Voir la Figure 4 de la Synthèse de G.P. Dugué et L. Tricoire, m/s n° 3, mars 2015, page 291
L’utilisation de ces souris nous a permis de démontrer qu’une élévation des niveaux intracellulaires de BH4, uniquement dans les neurones sensoriels, induit une hypersensibilité aux stimulus nocifs thermiques et chimiques. Cette hypersensibilité est principalement produite par une surproduction d’oxyde nitrique NO (probablement via la NOS neuronale, NOS1), qui pourrait sensibiliser les canaux de type TRPV1 (transient receptor potential cation channel subfamily V member 1). Bloquer la production de BH4 dans ces cellules peut prévenir, mais aussi inverser, le développement de symptômes d’hypersensibilité mécanique (allodynie mécanique) causés par une lésion nerveuse, sans altérer la douleur nociceptive. Ces résultats représentent la preuve formelle que BH4, produit par les neurones sensoriels, joue un rôle clé dans le développement mais également la maintenance des douleurs neuropathiques [2]. L’utilisation d’outils génétiques, permettant une modulation de la production de BH4 restreinte à des tissus périphériques, indique également qu’une approche thérapeutique systémique serait efficace sans franchissement de la barrière hémato-encéphalique, ce qui pourrait limiter l’apparition d’effets secondaires centraux. |
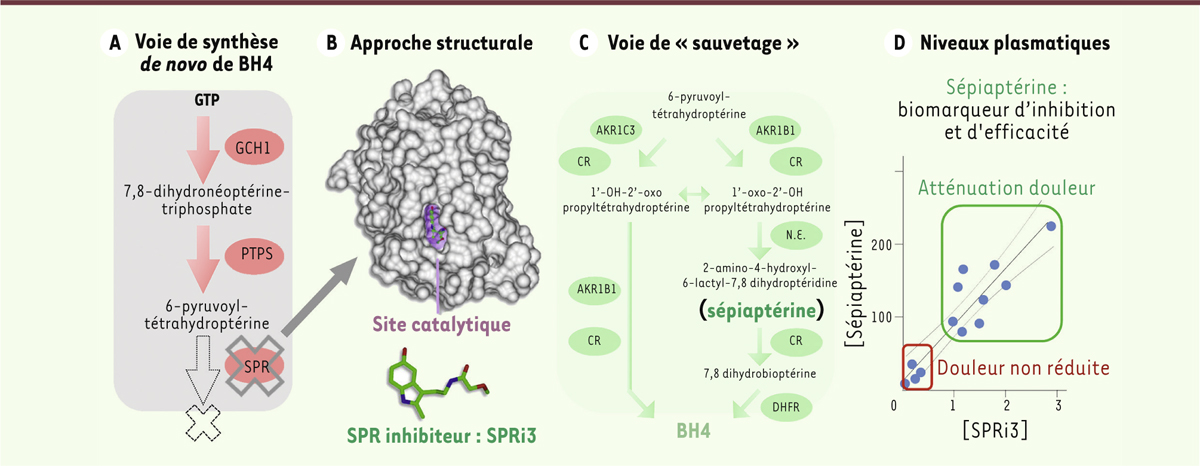
La sépiaptérine réductase : une nouvelle cible pharmacologique L’enzyme GCH1, que nous avons visée jusqu’à présent, ne représente pas une cible pertinente pour une inhibition pharmacologique systémique. En effet, GCH1 étant l’enzyme limitante dans la cascade de production de BH4, son inhibition présenterait un risque élevé de bloquer toute synthèse de BH4, ce qui précipiterait l’apparition d’effets secondaires, liés à une perte de NO ou de la production de monoamines. Une autre cible pharmacologique possible est la sépiaptérine réductase (SPR), dernière enzyme de la voie de production de novo de BH4 (Figures 1 et 2A). Cette enzyme présente deux avantages notoires. Tout d’abord, son site actif est relativement accessible pour des petites molécules. Des prédictions cristallographiques suggèrent d’ailleurs qu’une modification de son inhibiteur N-acétyl-sérotonine (NAS) permettrait d’augmenter son affinité pour l’enzyme [7]. De plus, des analyses génétiques ont récemment montré que, même en absence de SPR, la plupart des cellules sont capables de produire un niveau minimum de BH4, permettant aux enzymes nécessitant ce cofacteur de fonctionner. Cette production alternative est le fruit de plusieurs enzymes collectivement regroupées dans la voie dite de « sauvetage » [8, 9] (Figure 2C). Chez des patients déficients en SPR, les cellules hépatiques produisent ainsi suffisamment de BH4 pour que la phénylalanine hydroxylase fonctionne, permettant d’éviter l’accumulation de phénylalanine dans le sang (hyperphénylalaninémie)[8]. Ces cascades cellulaires de « sauvetage » pourraient donc représenter un filet de sécurité pour éviter une sur-inhibition de la production de BH4.
 | Figure 2.
Sélection de SPR comme cible pharmacologique pour réduire la production de BH4. A. SPR est la dernière enzyme de la voie de novo de synthèse de BH4. B. SPRi3 a été créé à partir de N-acétyl-sérotonine pour mieux occuper le site catalytique de l’enzyme (en violet), ce qui a été confirmé par l’analyse du co-crystal SPR-SPRi3. SPR est représenté en gris. SPRi3 est représenté en vert, et sa structure est présentée dans la partie basse (en vert carbones, en rouge oxygènes et en bleu azotes). C. Lorsque SPR est bloquée, plusieurs enzymes regroupées dans la voie de « sauvetage » permettent la production d’un niveau minimal de BH4. L’une des cascades implique la formation de 2-amino-4-hydroxyl-6-lactyl-7,8 dihydroptéridine, aussi appelée sépiaptérine (en vert). D. Les niveaux de sépiaptérine dans le plasma sont corrélés aux taux d’inhibiteur, ce qui fait de sépiaptérine un excellent biomarqueur de l’inhibition de SPR in vitro et in vivo. La sensibilité obtenue permet de distinguer les souris ayant reçu une dose efficace (qui inhibe l’enzyme, encadré vert) d’une dose inefficace car trop faible (encadré rouge). Concentration en [sépiaptérine] en nmol/l, [SPRi3] en µM. GCH1 : GTP cyclohydrolase 1 ; PTPS : pyruvoyl-tétrahydrobioptérine synthase; SPR : sépiaptérine réductase ; AKR1B1/C3 : aldokéto réductase (AR) family 1 member b1/c3 ; CR : carbonyl réductase; DHFR : dihydrofolate réductase ; N.E. : non-enzymatique ; BH4 : tétrahydrobioptérine. |
Nous avons créé un inhibiteur de SPR, SPRi3 (SPR inhibitor 3), en modifiant NAS pour améliorer son occupation du site actif, ce que nous avons confirmé en analysant le co-crystal SPR-SPRi3 (Figure 2B) [2]. L’administration systémique de cet inhibiteur réduit de façon dose-dépendante les signes d’allodynie mécanique dans deux modèles précliniques de douleur neuropathique. Cette réduction de l’hypersensibilité est concomitante avec une réduction, chez les animaux traités, de l’activité de SPR et des niveaux cellulaires de BH4 dans les tissus à l’origine des douleurs neuropathiques : les nerfs lésés et les ganglions des racines dorsales (DRG, dorsal root ganglia). L’inhibition systémique de SPR ne cause pas d’effets secondaires comportementaux, y compris pour des tests sensibles à des changements des niveaux cérébraux de sérotonine et dopamine, et ne produit aucune altération du rythme ou de la pression cardiaque. En outre, l’administration de ce composé chez des animaux ayant reçu une lésion nerveuse plusieurs semaines auparavant conserve la même efficacité. Ce résultat confirme que la surproduction de BH4 dans les nerfs/DRG participe à la maintenance des symptômes d’allodynie mécanique, et que réduire cette surproduction est efficace pour réduire la douleur même longtemps après leur apparition. Enfin, un régime de deux injections quotidiennes à la dose maximale testée, pendant trois ou quatre jours, conserve son efficacité, suggérant que ce traitement ne cause pas de tolérance rapide, un profil très différent des composés opiacés. Nous avons ensuite cherché à identifier un marqueur de l’activité de l’inhibiteur SPRi3. L’inhibition de SPR engageant la voie de « sauvetage », nous avons analysé les différents métabolites formés, notamment la 2-amino-4-hydroxyl-6-lactyl-7,8 dihydroptéridine (également appelée sépiaptérine), qui est produite à partir de 1’-oxo-2’-OH propyltétrahydroptérine de façon non-enzymatique, et ce uniquement lorsque SPR est bloquée [10, 11] (Figure 2C). La sépiaptérine est très stable et donc facilement mesurable, contrairement à BH4 qui est extrêmement labile. Effectivement, nous avons détecté ce métabolite dans les nerfs lésés et les DRG après injection de SPRi3, confirmant ainsi l’inhibition de l’enzyme dans les tissus cibles. De façon inattendue, nous avons également été capables de mesurer la sépiaptérine dans le surnageant provenant de cultures primaires de neurones sensoriels traités avec l’inhibiteur, indiquant que ce métabolite est libéré par les neurones. Nous avons donc testé si la sépiaptérine pouvait être détectée dans le plasma de souris traitées avec l’inhibiteur de SPR, et nous avons trouvé une très forte corrélation entre la concentration plasmatique en inhibiteur et celle de la sépiaptérine (Figure 2D). La concentration en sépiaptérine représente de fait un excellent biomarqueur de l’inhibition de l’enzyme SPR. Ainsi, les niveaux plasmatiques de ce métabolite, qui est non détectable chez des animaux naïfs, permettent de distinguer des animaux ayant reçu une dose anti-allodynique de l’inhibiteur de ceux qui ont reçu une dose non efficace. Il est tentant d’envisager que ce biomarqueur pourrait représenter un outil très utile pour titrer le degré d’inhibition de SPR nécessaire pour réduire les symptômes neuropathiques, tout en évitant de trop inhiber la production de BH4 et ainsi limiter le risque d’effets secondaires. |
De nombreuses études génétiques chez l’humain ont montré l’importance de BH4 dans les douleurs neuropathiques en se basant sur des variations génétiques du gène Gch1 codant pour une enzyme de production de BH4. Nous montrons que cibler une autre enzyme de la cascade synthétique de BH4, SPR, permet de réduire significativement la production de BH4 et les manifestations d’hypersensibilité mécaniques causées par une lésion nerveuse, en agissant sur les neurones sensoriels et les macrophages infiltrant le nerf lésé, et ceci sans causer d’effets secondaires majeures ou de tolérance rapide. Le métabolite sépiaptérine constitue de plus un biomarqueur extrêmement fiable pour mesurer l’inhibition de SPR in vitro mais également in vivo [2]. Le développement d’un inhibiteur de SPR représente donc une approche pharmacologique viable afin de développer de nouvelles stratégies médicamenteuses pour le traitement des douleurs neuropathiques. |
Alban Latremoliere est actionnaire de Quartet Medicine, une compagnie basée à Cambridge, MA (USA), qui crée et synthétise de nouveaux inhibiteurs contre SPR pour traiter les douleurs chroniques.
|
Footnotes |
1.
Arrowsmith J, Miller P. Trial watch: phase II and phase III attrition rates 2011–2012 . Nat Rev Drug Discov. 2013; ; 12 : :569.. 2.
Latremoliere A, Latini A, Andrews N, et al. Reduction of neuropathic and inflammatory pain through inhibition of the tetrahydrobiopterin pathway . Neuron. 2015; ; 86 : :1393.–1406. 3.
Tegeder I, Costigan M, Griffin RS, et al. GTP cyclohydrolase and tetrahydrobiopterin regulate pain sensitivity and persistence . Nat Med. 2006; ; 12 : :1269.–1277. 4.
Costigan M, Latremoliere A, Woolf CJ. Analgesia by inhibiting tetrahydrobiopterin synthesis . Curr Opin Pharmacol. 2012; ; 12 : :92.–99. 5.
Latremoliere A, Costigan M. GCH1, BH4 and pain . Curr Pharm Biotechnol. 2011; ; 12 : :1728.–1741. 6.
Dugué GP, Tricoire L. Principes et applications de l’optogénétique en neuroscience . Med Sci (Paris). 2015; ; 31 : :291.–303. 7.
Smith GK, Duch DS, Edelstein MP, Bigham EC. New inhibitors of sepiapterin reductase. Lack of an effect of intracellular tetrahydrobiopterin depletion upon in vitro proliferation of two human cell lines . J Biol Chem. 1992; ; 267 : :5599.–5607. 8.
Bonafé L, Thöny B, Penzien JM, et al. Mutations in the sepiapterin reductase gene cause a novel tetrahydrobiopterin-dependent monoamine-neurotransmitter deficiency without hyperphenylalaninemia . Am J Hum Genet. 2001; ; 69 : :269.–277. 9.
Hirakawa H, Sawada H, Yamahama Y, et al. Expression analysis of the aldo-keto reductases involved in the novel biosynthetic pathway of tetrahydrobiopterin in human and mouse tissues . J Biochem. 2009; ; 146 : :51.–60. 10.
Milstien S, Kaufman S. The biosynthesis of tetrahydrobiopterin in rat brain. Purification and characterization of 6-pyruvoyl tetrahydropterin (2’-oxo)reductase . J Biol Chem. 1989; ; 264 : :8066.–8073. 11.
Nichol CA, Lee CL, Edelstein MP, et al. Biosynthesis of tetrahydrobiopterin by de novo and salvage pathways in adrenal medulla extracts, mammalian cell cultures, and rat brain in vivo . Proc Natl Acad Sci USA. 1983; ; 80 : :1546.–1550. |