| |
| Med Sci (Paris). 2016 January; 32(1): 85–92. Published online 2016 February 5. doi: 10.1051/medsci/20163201014.L’expérience sensorielle et nutritionnelle des parents et leur état métabolique orientent le comportement alimentaire de leur descendance Patricia Parnet,1* Vincent Paillé,1 Francisco Bolaños Jimenez,1 Bertrand Kaeffer,1 Benoist Schaal,2 Sébastien G. Bouret,3,4 and Valérie Amarger 1 1UMR 1280, Inra, université de Nantes, institut des maladies de l’appareil digestif, centre de recherche en nutrition humaine, CHU Hôtel Dieu, 1, place Ricordeau, 44000Nantes, France 2Équipe d’éthologie développementale, centre des sciences du goût et de l’alimentation, CNRS (UMR 6265), université de Bourgogne-Inra, 9E, boulevard Jeanne d’Arc, 21000Dijon, France 3Inserm U837, centre de recherche Jean-Pierre Aubert, université Lille 2, Lille, 59045, France 4The Saban Research Institute, Neuroscience program, Children Hospital Los Angeles, University of Southern California, Los Angeles, CA 90027, États-Unis |

Dans un environnement où les ressources nutritionnelles sont suffisantes, le poids d’un individu adulte reste quasi constant, manifestation de l’équilibre entre consommation et dépense énergétique. Le comportement alimentaire est initialement déterminé par les besoins nutritionnels, mais les corrélats sensoriels, la motivation, la prise de décision, les émotions et le contexte social l’influencent largement. In utero, le fœtus dépend des ressources, des choix et des rythmes alimentaires de sa mère. À la naissance, les besoins énergétiques de l’enfant dictent le rythme et le volume des tétées. Par la suite, lors de l’exposition progressive à la palette alimentaire locale, l’enfant affine ses prédilections pour finir par acquérir ses propres habitudes de consommation. L’idée que l’alimentation de la mère et son état métabolique peuvent notablement influencer la santé de sa descendance, en agissant en premier lieu sur la croissance fœtale puis en créant un terrain favorable à l’émergence de maladies métaboliques, est apparue grâce aux travaux épidémiologiques initiés par Barker [1] et a été confirmée par un grand nombre d’études expérimentales sur des modèles animaux [2]. Cependant, les données épidémiologiques qui révèlent un lien entre nutrition précoce et déterminants du comportement alimentaire sont rares. On peut mentionner deux études réalisées à la suite de la famine hollandaise (1944-1945) et qui ont mis en lumière un lien entre restriction alimentaire pendant la grossesse et préférence accrue pour les aliments gras à l’âge adulte, ainsi qu’une moindre activité physique [3, 4]. Depuis, de nombreuses expériences sur modèles animaux ont tenté d’élucider les mécanismes sous-jacents à ce lien [5]. |
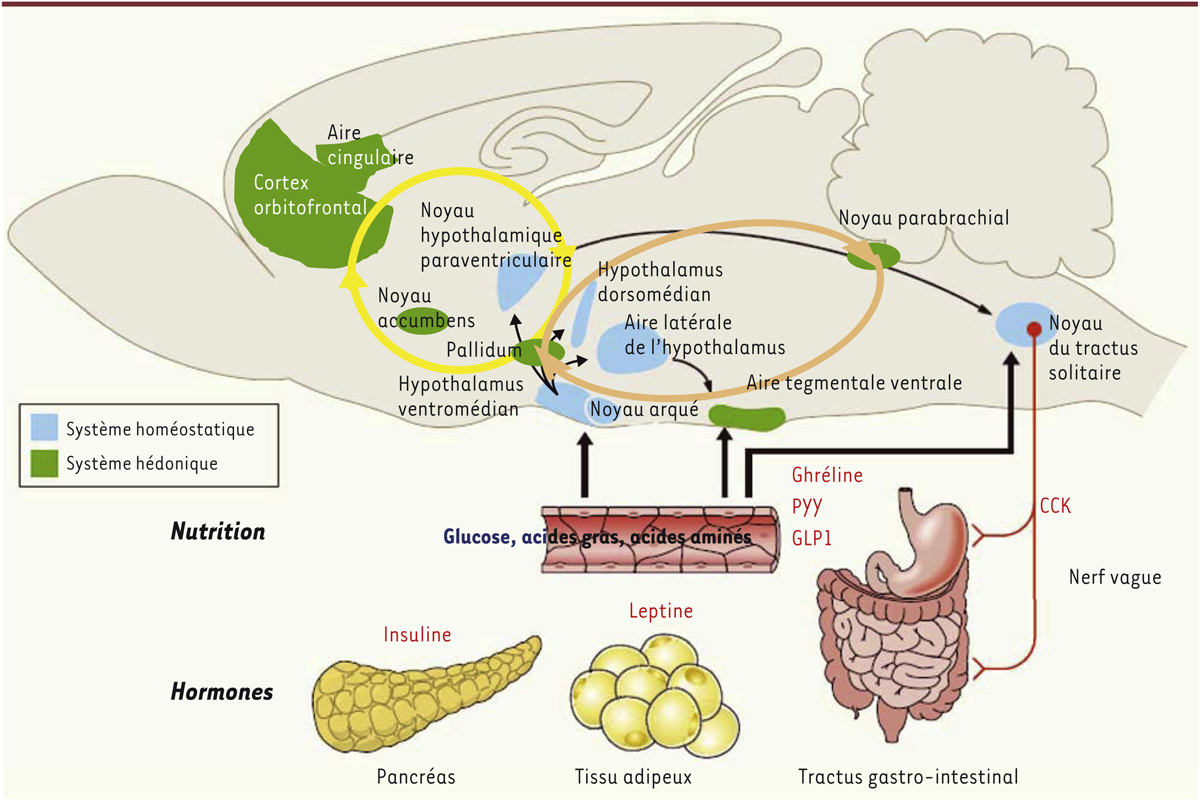
Influences maternelles sur la régulation neuronale du comportement alimentaire : coopération ou antagonisme entre les modulations énergétique et hédonique de l’ingestion ? La régulation de la prise alimentaire résulte de processus complexes entre les activités sécrétoires et électriques de structures cérébrales telles que l’hypothalamus et le tronc cérébral, où sont intégrés les signaux circulants de faim et de satiété, le système mésolimbique dopaminergique où s’élaborent les conséquences hédoniques de la prise alimentaire, et les structures corticales d’intégration des entrées sensorielles [6] (Figure 1). Des travaux expérimentaux sur les rongeurs ont ainsi tenté de démontrer l’importance de l’état nutritionnel maternel sur le développement optimal des réseaux neuronaux impliqués dans les régulations métaboliques des descendants, les structures les plus étudiées étant l’hypothalamus et le système impliquant la mélanocortine [7] (→).
(→) Voir la Nouvelle de S. Luquet, m/s n° 8-9, août-septembre 2008, page 680
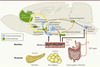 | Figure 1.
Représentation schématique simplifiée du cerveau de rongeur faisant apparaître les structures cérébrales et les circuits neuronaux impliqués dans l’homéostasie énergétique, la prise de décision alimentaire et la récompense. CCK : cholécystokinine ; PYY : peptide tyrosine tyrosine ; GLP1 : glucagon-like peptide 1. |
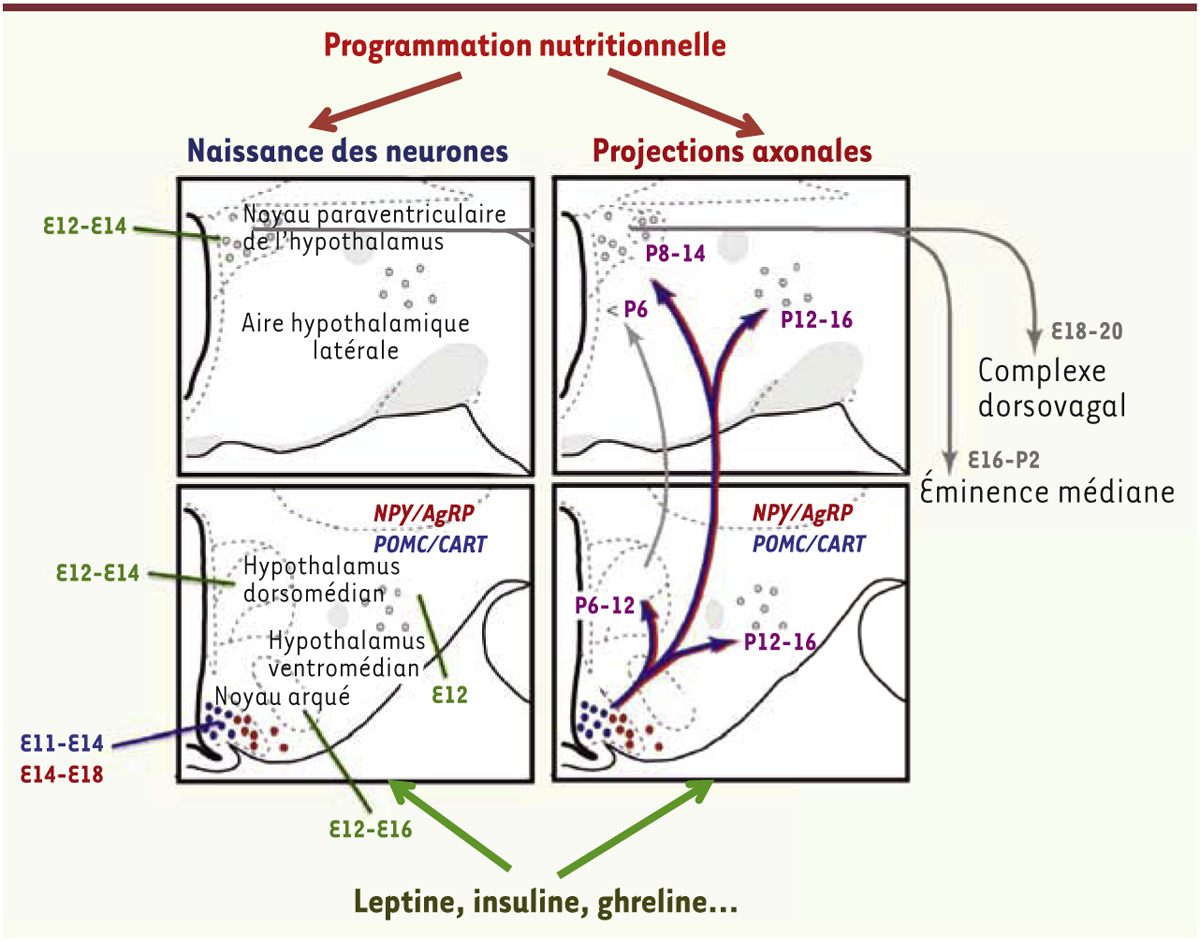
L’hypothalamus est considéré comme une région clé dans l’intégration des fonctions homéostatiques et endocrines. L’organisation architecturale de cette structure complexe (Figure 2) [8] (→) se façonne chez le rongeur de la 2e semaine in utero jusqu’au 20e jour après la naissance et dépend de signaux trophiques tels que l’insuline et la leptine. Des études de traçage axonal chez des souris génétiquement déficientes en leptine (souche ob/ob) démontrent que la leptine favorise la croissance des fibres nerveuses émanant du noyau arqué et innervant le noyau paraventriculaire pendant une courte période postnatale [9]. Le taux de leptine augmente dans le plasma du rongeur nouveau-né au cours de la deuxième semaine de vie. Ce pic de leptine est accru lors d’une surnutrition maternelle [9] et fortement diminué lors de la malnutrition maternelle. Cette diminution des concentrations plasmatiques chez le nouveau-né entraîne une réduction de la densité des projections axonales hypothalamiques [11, 12]. De même, les taux périnatals d’insuline influencent positivement l’architecture de l’hypothalamus en augmentant le nombre de neurones et l’élongation des prolongements axonaux [13, 14].
(→) Voir la Nouvelle de S.G. Bouret, m/s n° 11, novembre 2004, page 958
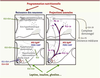 | Figure 2.
Représentation schématique du développement des circuits hypothalamiques de la régulation de la prise alimentaire chez le rongeur. Les neurones hypothalamiques à l’origine des noyaux hypothalamiques migrent du neuroépithélium et se mettent en place vers le 12 e jour de vie embryonnaire (E12). Les projections axonales se construisent des jours postnatals 6 à 16 (P6-P16). Les apports nutritionnels maternels influencent ces étapes en modulant les concentrations plasmatiques d’hormones comme la leptine, l’insuline ou la ghreline. Des actions spécifiques de certains nutriments sur ces différentes étapes peuvent être envisagées mais nécessitent des études plus approfondies. Figure adaptée des travaux de Bouret [ 51, 52]. NPY : neuropeptide Y ; AgRP : Agouti-related peptide ; POMC : pro-opiomélanocortine ; CART : cocaïne-and amphétamine regulated transcript. |
L’ensemble de ces travaux met en exergue l’importance de l’état nutritionnel maternel sur le développement des réseaux neuronaux impliqués dans les régulations métaboliques des descendants. Cependant, au-delà de l’observation d’altérations métaboliques de la descendance (apparition d’une résistance à l’insuline, d’un état prédiabétique, d’une résistance à la leptine), il est crucial d’identifier également les conséquences sur les caractéristiques comportementales de la prise alimentaire, c’est-à-dire les rythmes alimentaires, la séquence du rassasiement ou encore les préférences sensorielles. Le Tableau I résume, de manière non exhaustive, quelques expériences réalisées dans des modèles animaux mettant en relation un effet de la nutrition maternelle sur la séquence du rassasiement ou les rythmes des repas chez la descendance, en fonction de la période d’exposition (gestation et/ou lactation), avec parfois des résultats contradictoires.
Tableau I.
| Période d’exposition |
Nature du régime maternel |
|
Conséquences métaboliques et comportementales |
Référence |
|
Gestation (G6-G21)*
|
50 % gras |
↑ |
Consommation calorique après la puberté, préférence pour le gras |
[42] |
|
|
Gestation (G12-G21) et lactation
|
30 % gras |
↑ |
Préférence pour le gras |
[21] |
|
|
Trois mois avant conception, gestation et lactation
|
60 % gras |
↑ |
Préférence pour le gras/sucré |
[35] |
|
|
Lactation
|
Régime « cafétéria » 55 % gras |
↑ ↑ |
Consommation calorique Préférence pour le gras |
[43] |
|
|
Après sevrage
|
44,9 % gras |
↓ ↑ |
Consommation de glucides Préférence pour le gras |
[44] |
|
|
Lactation
|
32 % gras |
↑ |
Consommation d’un régime hypercalorique à l’âge adulte |
[45] |
|
|
Gestation
|
Restriction calorique 70 % |
|
Altération des rythmes alimentaires |
[46] |
|
|
Gestation seulement Gestation et lactation
|
Restriction protéique (8 % vs 20 %) |
↑ ↑ |
Préférence pour le gras Altération des rythmes alimentaires et de la survenue de la satiété Hyperphagie après sevrage |
[47] [48] [49] |
|
|
Lactation
|
Restriction calorique par augmentation de la taille des portées |
↑ |
Hypophagie |
[50] |
Tableau récapitulatif résumant les résultats de quelques études chez les rongeurs qui ciblent les périodes du développement précoce auxquelles un changement de régime alimentaire maternel affecte le métabolisme, l’appétit et les préférences de la descendance. * G6 : jour 6 de la gestation (qui dure 21 jours). |
Le plaisir sensoriel induit par les aliments est une motivation puissante de l’ingestion qui peut surpasser les signaux homéostatiques [15]. Cette composante hédonique met en jeu des régions cérébrales impliquées dans les comportements de recherche de nourriture et les addictions [16]. Deux composantes psychologiques de la récompense sont sensibles à l’environnement nutritionnel : la satisfaction et la perception du plaisir (le liking), et la motivation consciente ou inconsciente à le reproduire (le wanting). Au niveau neurobiologique, les systèmes opioïdes, endocannabinoïdes et GABA (acide γ-aminobutyrique) gèrent le liking [17, 18] et, pour le wanting, ce sont les systèmes opioïdes, la dopamine et ses interactions avec les circuits glutamatergiques corticolimbiques qui sont mis en jeu [19, 53] (→).
(→) Voir la Synthèse de L. Venance et al., m/s n° 1, janvier 2004, page 45
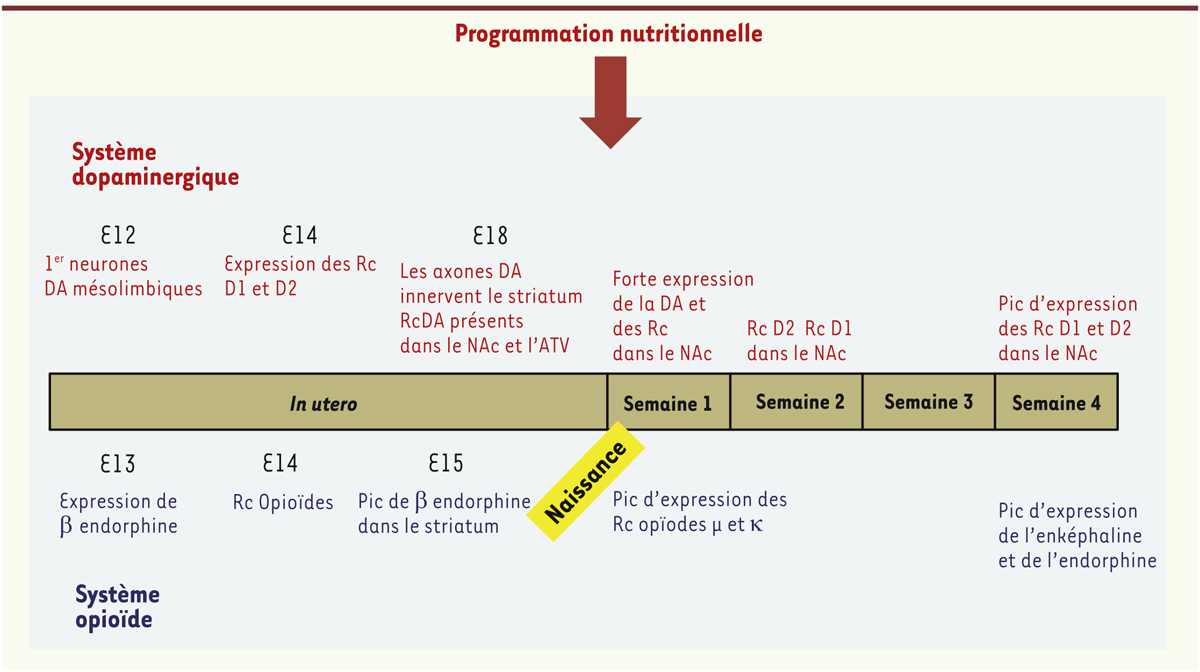
Parce que les projections dopaminergiques se développent en grande partie après la naissance [20], il est tout à fait envisageable que les circuits de la récompense (wanting et liking) soient modulés par l’expérience précoce (Figure 3). Chez le rat, l’exposition à un régime riche en graisses pendant la gestation et l’allaitement atténue l’hyperactivité locomotrice induite par l’injection d’amphétamine et réduit l’expression présynaptique des récepteurs dopaminergiques D2, démontrant un effet du régime de la mère sur les centres dopaminergiques de sa descendance [21]. Cet effet s’accompagne d’une altération de l’expression des transcrits des récepteurs mu des opiacés, des récepteurs dopaminergiques et du transporteur de la dopamine au niveau du noyau accumbens. La conséquence de ces altérations neurochimiques est une préférence plus marquée de la descendance pour des aliments riches en calories après le sevrage et jusqu’à l’âge adulte [22]. Quelques-uns de ces travaux expérimentaux sont résumés dans le Tableau I.
 | Figure 3.
Représentation schématique simplifiée de l’ontogenèse des systèmes cérébraux dopaminergique et opioïdergique chez le rongeur au cours de la période périnatale. La nutrition de la mère peut interagir avec la programmation des différentes phases ontogéniques de ces systèmes et ainsi influencer le comportement alimentaire de la descendance (adapté de [ 43]). DA : dopamine ; Rc : récepteur ; D1 : dopamine récepteur 1 ; D2 : dopamine récepteur 2 ; NAc : noyau accumbens ; ATV : aire tegmentale ventrale. |
|
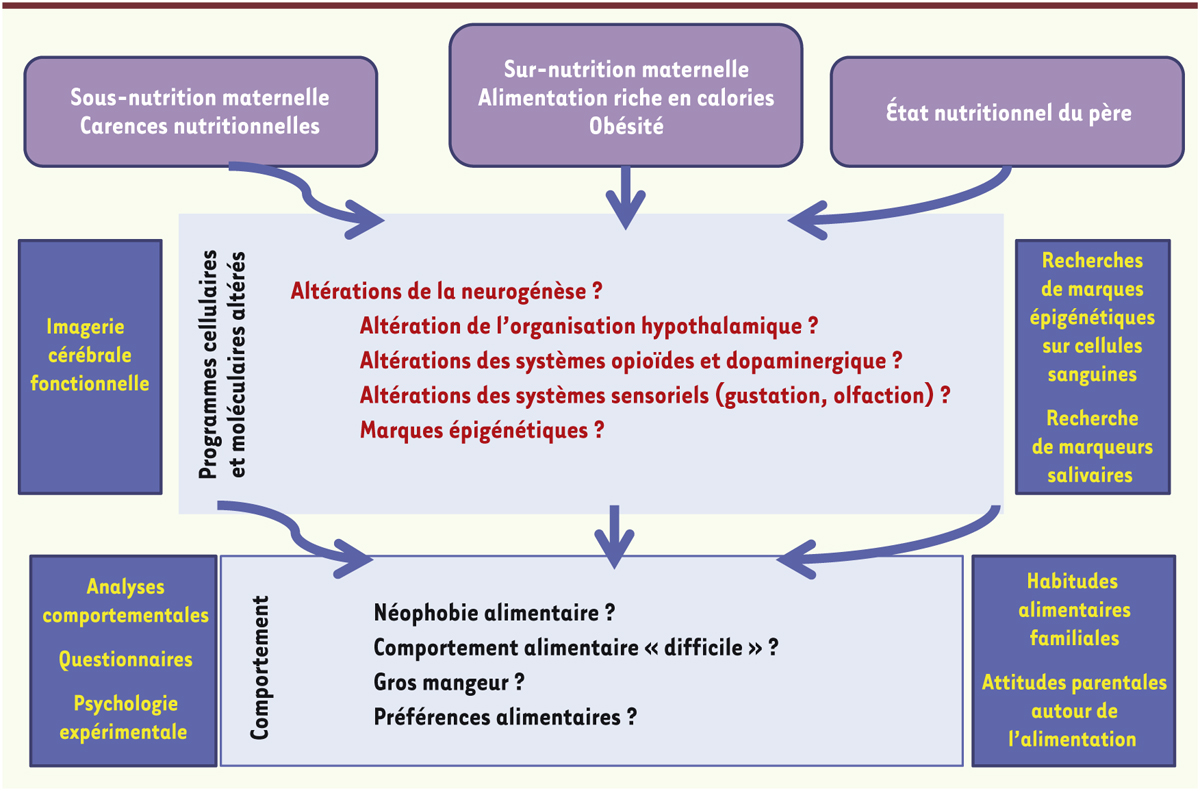
Transposer les études sur les modèles animaux et les recherches chez l’homme ? Il est important de noter que la plupart des études montrant une relation entre la plasticité des réseaux hypothalamiques et des circuits de la récompense et les apports nutritionnels de la mère proviennent d’études réalisées chez les rongeurs (rat, souris), dont le développement cérébral est tardif et difficilement transposable à celui de l’homme. La mise en relation temporelle du développement neuronal du rongeur avec celui de l’homme n’est pas toujours pertinente. De plus, les recherches cliniques par essais randomisés sont rarement envisageables, car il n’est pas éthiquement acceptable de demander à des femmes de consommer des régimes enrichis ou appauvris en énergie pendant leur grossesse afin d’étudier le devenir de leur enfant. Il faut donc se tourner vers des approches épidémiologiques qui prennent en compte plusieurs périodes de développement de l’individu. Nous avons ainsi pu montrer récemment que des enfants nés avec un retard de croissance intra-utérin (nés à terme ou prématurés) manifestaient, à l’âge de deux ans, un comportement alimentaire considéré comme « difficile », car plus sujet à la néophobie1 et au refus de diversifier leurs choix alimentaires [23]. Par ailleurs, l’étude d’une cohorte de 5 717 couples mère/enfant et 3 009 couples père/enfant montre une forte corrélation entre la consommation d’aliments gras par la mère et la préférence pour le gras chez l’enfant à 10 ans, alors qu’aucune corrélation n’existe avec le régime du père. Cette étude permet également de favoriser l’hypothèse de l’impact de l’alimentation de la mère pendant la grossesse plutôt qu’une origine génétique de cette préférence [24]. Toutefois, la démonstration chez l’enfant de modifications cérébrales en relation avec ces préférences constitue pour l’instant une gageure et nécessiterait d’investir dans des recherches d’imagerie cérébrale fonctionnelle (Figure 4).
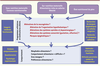 | Figure 4.
Schéma de présentation des pistes de recherches nécessaires à une meilleure appréhension et compréhension de la programmation sensorielle et nutritionnelle du comportement alimentaire de la descendance chez l’homme.
|
|
Des préférences alimentaires programmées avant la naissance et/ou pendant l’allaitement ? L’expérience sensorielle périnatale oriente le comportement individuel à long terme. En effet, des associations précoces entre des stimulus et des états cérébraux assimilables au plaisir-déplaisir (sensations détectables in utero par les mimiques faciales du fœtus) participent à l’élaboration de préférences alimentaires durables. Les fœtus de mammifères réagissent aux odeurs et saveurs de leur environnement amniotique et des couplages non aléatoires entre odeurs et réponses oro-faciales sont observés dès 2 mois avant terme chez le nouveau-né humain prématuré2. Les composés odorants/sapides de l’alimentation maternelle transférés à travers le placenta sont alors en mesure d’engager des préférences ou des aversions chimiosensorielles chez le fœtus. Les supports nerveux de ces couplages stimulus-réponse restent mal connus en particulier dans le cas de la gustation, même si des travaux récents réalisés chez la souris montrent que l’expérience fœtale du sucré influence le développement des bourgeons linguaux du goût et détermine un appétit accru pour le sucré qui perdure jusqu’à l’âge adulte [25]. Les liens stimulus-réponse impliqués dans l’olfaction sont mieux connus. Chez le fœtus murin, les arômes dominants modifient la chaîne nerveuse de traitement des odeurs, de la typologie moléculaire des neurorécepteurs olfactifs aux mécanismes centraux, en particulier au niveau du bulbe olfactif [26, 27]. Ce façonnage neural par l’expérience sensorielle directe ne s’arrête pas à la naissance mais se poursuit tout au long du développement précoce, à travers l’expérience sensorielle reçue par le lait maternel et les premières expositions aux aliments non lactés. |
Quelle persistance des préférences ou aversions chimiosensorielles acquises précocement ? L’expérience chimiosensorielle pré- ou périnatale induit des effets comportementaux stables chez l’animal après le sevrage, voire persistants chez l’adulte. De tels effets durables de l’expérience précoce, fœtale et/ou postnatale, sont également suggérés chez l’homme. Ainsi, l’exposition périnatale à la flaveur de carotte engendre une préférence pour cet arôme chez les nourrissons de 5-6 mois [28]. De même, l’odeur de camomille associée aux premières tétées induit une préférence pour des objets portant cette odeur à 21 mois [29], et le fait d’avoir été exposé à l’ail in utero en modifie positivement l’appréciation à l’âge de 8-9 ans [30]. L’exposition à des formules lactées vanillées favorise une préférence pour la vanille détectable, en moyenne, à 28 ans [31]. Enfin, l’exposition précoce à des laits acides ou amers (hydrolysats de protéines) augmente une acceptabilité généralisée des boissons acides à 4-5 ans [32]. En ce qui concerne les macronutriments, la consommation de protéines et de lipides chez des enfants de 10 ans est corrélée à la consommation de ces mêmes nutriments par leur mère pendant la grossesse [24]. Bien qu’encore limités et partiels, ces résultats soulignent la possibilité de traces stables de l’expérience chimiosensorielle précoce chez l’homme, de sorte que certaines « empreintes » olfactives et/ou gustatives pourraient se maintenir toute la vie. Il est cependant difficile de départager les effets plus ou moins stables des expositions sensorielles précoces de ceux de l’influence culturelle et familiale sur les préférences alimentaires (Figure 4). Des recherches expérimentales longitudinales et des suivis épidémiologiques sériant les périodes d’exposition (préconception, gestation, lactation, diversification, puberté) sont à présent nécessaires pour mieux cerner la persistance des préférences acquises au cours du développement précoce et comprendre les mécanismes neurocognitifs sous-jacents. |
Que sait-on des mécanismes cellulaires et moléculaires de la programmation du comportement alimentaire ? Il est maintenant admis que l’alimentation est une source d’information biologique dont la signification physiologique est décodée et potentiellement gardée en mémoire à plus ou moins long terme par le génome lui-même. Même si les mécanismes sous-tendant ces phénomènes de programmation restent largement inexplorés, les marques épigénétiques qui contrôlent la structure et l’accessibilité de la chromatine et donc l’expression du génome, constitueraient une forme de « mémoire ». Au niveau de l’hypothalamus, l’environnement hormonal agit sur l’expression et la régulation des gènes de contrôle du comportement alimentaire. Ainsi, le gène Pomc (pro-opiomélanocortine), codant pour un peptide anorexigène, est naturellement surexprimé, quel que soit l’âge, en réponse à une augmentation du taux de leptine et d’insuline. Cette régulation positive fait suite à la fixation des facteurs de transcription Sp1 et Stat3 sur son promoteur [33], laquelle dépend de son niveau de méthylation. En cas de suralimentation postnatale des petits, le niveau de méthylation du promoteur de Pomc est augmenté dans l’hypothalamus au moment du sevrage, ce qui se traduit par une baisse d’expression du gène malgré une hyperinsulinémie et une hyperleptinémie [34] ; il est au contraire diminué lors d’une restriction protéique maternelle [11]. Un régime maternel hyperlipidique induit également une hypométhylation des promoteurs de certains gènes du système de récompense chez la descendance à l’âge adulte et est corrélé à une préférence pour des aliments hyperénergétiques [35]. Mais une supplémentation maternelle en donneurs de méthyles normalise le niveau de méthylation de ces gènes et rétablit durablement le comportement alimentaire [36]. L’exposition périnatale aux stimulations olfactives engagerait également l’expression de gènes codant certains récepteurs olfactifs. Ainsi, chez la souris, un conditionnement olfactif aversif des mâles F0 entraîne chez la descendance adulte (F1, F2) une réactivité accrue envers l’odeur conditionnée. Cette transmission intergénérationnelle d’une aversion olfactive serait liée à l’expression accrue de certains récepteurs olfactifs, et serait véhiculée par l’hypométhylation dans le génome des spermatozoïdes du gène Olfr151 codant les récepteurs olfactifs M71 [37]. Enfin, le comportement alimentaire est indissociable des rythmes circadiens et des horloges internes (cérébrale, tissulaire) correspondant à des systèmes moléculaires complexes sensibles aux apports énergétiques. Chez l’homme, la rythmicité circadienne du fœtus serait entraînée non seulement par des signaux maternels induits par les cycles d’activité (jour/nuit, repos/activité), mais aussi par la concentration variable de certains nutriments (repas/jeûne) induisant des variations rythmiques des métabolites sanguins. Ainsi, dans un modèle de restriction alimentaire maternelle, la rythmicité des repas est modifiée chez la descendance, et l’expression de certains gènes de l’horloge tels que Bmal1 et Period 1 ou rev-erb-alpha est fortement altérée à l’âge adulte [38, 54] (→).
(→) Voir la Synthèse de A. Goldbeter et al., m/s n° 1, janvier 2010, page 49
Certains nutriments apportés par l’alimentation maternelle, en particulier ceux impliqués dans la voie des folates (méthionine, acide folique, zinc, bétaïne, choline), sont capables d’annuler les effets programmateurs d’un régime hyperlipidique sur la préférence pour une nourriture hyperénergétique. Au contraire, un excès d’acide folique associé à un régime équilibré en macronutriments entraîne une hyperphagie chez la descendance [39]. Mais l’effet du régime maternel pendant la gestation peut parfois être aboli par le régime fourni après le sevrage, ce qui suggère une possible réversibilité du phénomène [40]. Les mécanismes épigénétiques constituent vraisemblablement un mécanisme majeur dans l’établissement de l’empreinte nutritionnelle. Toutefois, leur étude chez l’homme se heurte à des limites inhérentes à leur caractère tissu-spécifique et donc à l’indisponibilité de tissus humains. L’identification de marques épigénétiques dans des tissus accessibles, comme le sang, qui seraient le reflet de l’empreinte apposée au niveau des tissus fonctionnels, constitue un espoir [41], mais cette approche est encore loin d’être validée. |
Perspectives et conclusions Une prise alimentaire excessive et un mode de vie sédentaire sont les principales causes de l’épidémie de maladies métaboliques qui sévit actuellement sur tous les continents. Si l’influence du contexte familial sur les habitudes alimentaires ne fait aucun doute, le fait que les états nutritionnel, métabolique et hormonal des parents avant la conception, puis de la mère pendant la gestation et l’allaitement, puissent également influencer le comportement alimentaire futur de l’enfant est un concept novateur, qui devrait ouvrir la voie à des mesures de prévention. En raison de ses déterminants multifactoriels, l’amélioration des habitudes alimentaires est une tâche complexe qui nécessite l’implication des partenaires sociaux et industriels, ainsi que des professionnels de santé. La santé et la nutrition maternelles pendant la période périconceptionnelle, la grossesse et l’allaitement devraient être des préoccupations majeures pour les femmes et les intervenants politiques, sociaux et médicaux impliqués (contrôle du poids, conseils nutritionnels, suppléments diététiques appropriés). La susceptibilité de l’enfant à l’environnement maternel et la santé des femmes au cours de ces périodes sensibles représentent les défis majeurs de l’Organisation mondiale de la santé (OMS) pour la santé de la femme et des enfants3. Chez l’homme, la période fœtale, l’allaitement, la petite enfance et l’adolescence représentent des fenêtres temporelles déterminantes pour la construction des habitudes alimentaires du fait de la plasticité cérébrale des structures d’intégration sensorielle et « homéostatique », et de celles liées aux addictions. Les politiques publiques doivent continuer à cibler ces populations afin de promouvoir une alimentation saine pour les enfants et les adolescents, réduire la pression publicitaire à leur égard et la disponibilité de nourritures enrichies en sucre/sel et en gras dans leurs milieux de vie familiaux et extrafamiliaux (scolaires, loisirs). En recherche fondamentale, il apparaît primordial que les spécialistes de la biologie du développement, encore très peu intéressés par les concepts de programmation sensorielle et nutritionnelle, apportent leur expertise à l’analyse des régulations épigénétiques qui déterminent le devenir des cellules souches des différents organes de la chimiosensorialité et du métabolisme afin d’accélérer l’élaboration des connaissances dans ce domaine. Dans ce cadre, des essais d’intervention randomisés sur des populations à risque (femmes obèses, diabétiques, malnutries ou sous-nutries) doivent être conçus afin de fournir des informations sur (1) les fenêtres critiques au cours desquelles les paramètres environnementaux ont un impact maximal, et (2) la nature des apports ou aménagements nutritionnels spécifiques (allaitement maternel encouragé, supplémentations alimentaires à la mère ou au nouveau-né). Les connaissances dans le domaine de la programmation sensorielle et nutritionnelle des conduites alimentaires progressent indéniablement, mais l’étude d’un comportement humain aussi complexe se heurte à la difficulté d’intégrer et de démêler les contributions de la neurophysiologie, du métabolisme, des mécanismes génétiques et épigénétiques, tout autant que celles de la sensorialité, de la cognition et de la culture. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Hales CN, Barker DJ. The thrifty phenotype hypothesis . Br Med Bull. 2001; ; 60 : :5.–20. 2.
Ravelli AC, van der Meulen JH, Michels RP, et al. Glucose tolerance in adults after prenatal exposure to famine . Lancet. 1998; ; 351 : :173.–177. 3.
Lussana F, Painter RC, Ocke MC, et al. Prenatal exposure to the Dutch famine is associated with a preference for fatty foods and a more atherogenic lipid profile . Am J Clin Nutr. 2008; ; 88 : :1648.–1652. 4.
Stein AD, Rundle A, Wada N, et al. Associations of gestational exposure to famine with energy balance and macronutrient density of the diet at age 58 years differ according to the reference population used . J Nutr. 2009; ; 139 : :1555.–1561. 5.
Amarger V, Parnet P, Vaiserman A, Lumey LH. Early life nutrition and long term appetite regulation . Early life nutrition, adult health, and development: Lessons from changing dietary patterns, famines, and experimental studies . New york: : Nova Science Publishers; , 2012. 6.
Gao Q, Horvath TL. Neurobiology of feeding and energy expenditure . Ann Rev Neurosci. 2007; ; 30 : :367.–398. 7.
Du Luquet S. nouveau dans la régulation de la prise alimentaire ? Med Sci (Paris). 2008; ; 24 : :680.–682. 8.
Bouret SG. Être connecté pour mieux manger . Med Sci (Paris). 2004; ; 20 : :958.–959. 9.
Bouret SG, Draper SJ, Simerly RB. Trophic action of leptin on hypothalamic neurons that regulate feeding . Science. 2004; ; 304 : :108.–110. 10.
Delahaye F, Breton C, Risold P-Y, et al. Maternal perinatal undernutrition drastically reduces postnatal leptin surge and affects the development of arcuate nucleus proopiomelanocortin neurons in neonatal male rat pups . Endocrinology. 2008; ; 149 : :470.–475. 11.
Coupe B, Amarger V, Grit I, et al. Nutritional programming affects hypothalamic organization and early response to leptin . Endocrinology. 2010; ; 151 : :702.–713. 12.
Davidowa H, Plagemann A. Decreased inhibition by leptin of hypothalamic arcuate neurons in neonatally overfed young rats . Neuroreport. 2000; ; 11 : :2795.–2798. 13.
Desai M, Li T, Ross MG. Hypothalamic neurosphere progenitor cells in low birth-weight rat newborns: Neurotrophic effects of leptin and insulin . Brain Res. 2011; ; 1378 : :29.–42. 14.
Toran-Allerand CD, Ellis L, Pfenninger KH. Estrogen and insulin synergism in neurite growth enhancement in vitro: mediation of steroid effects by interactions with growth factors? Dev Brain Res. 1988; ; 41 : :87.–100. 15.
Zheng H, Lenard NR, Shin AC, et al. Appetite control and energy balance regulation in the modern world: reward-driven brain overrides repletion signals . Int J Obes. 2009; ; 33 : (Suppl 2)
:S8.–13. 16.
Rolls ET. Taste, olfactory and food texture reward processing in the brain and obesity . Int J Obes. 2011; ; 35 : :550.–561. 17.
Mahler SV, Smith KS, Berridge KC. Endocannabinoid hedonic hotspot for sensory pleasure: anandamide in nucleus accumbens shell enhances ‘liking’ of a sweet reward . Neuropsychopharmacology. 2007; ; 32 : :2267.–2278. 18.
Pecina S, Berridge KC. Hedonic hot spot in nucleus accumbens shell: where do mu-opioids cause increased hedonic impact of sweetness? J Neurosci. 2005; ; 25 : :11777.–11786. 19.
Petit O, Basso F, Huguet P, et al. Apport des neurosciences de la décision à l’étude des comportements alimentaires et de l’obésité : imagerie et cognition . Med Sci (Paris). 2011; ; 27 : :1000.–1008. 20.
Antonopoulos J, Dori I, Dinopoulos A, et al. Postnatal development of the dopaminergic system of the striatum in the rat . Neuroscience. 2002; ; 110 : :245.–256. 21.
Naef L, Moquin L, Dal Bo G, et al. Maternal high-fat intake alters presynaptic regulation of dopamine in the nucleus accumbens and increases motivation for fat rewards in the offspring . Neuroscience. 2011; ; 176 : :225.–236. 22.
Ong ZY, Muhlhausler BS. Maternal “junk-food” feeding of rat dams alters food choices and development of the mesolimbic reward pathway in the offspring . FASEB J. 2011; ; 25 : :2167.–2179. 23.
Migraine A, Nicklaus S, Parnet P, et al. Effect of preterm birth and birth weight on eating behavior at 2 y of age . Am J Clin Nutr. 2013; ; 97 : :1270.–1277. 24.
Brion MJ, Ness AR, Rogers I, et al. Maternal macronutrient and energy intakes in pregnancy and offspring intake at 10 y: exploring parental comparisons and prenatal effects . Am J Clin Nutr. 2010; ; 91 : :748.–756. 25.
Zhang GH, Chen ML, Liu SS, et al. Effects of mother’s dietary exposure to acesulfame-K in pregnancy or lactation on the adult offspring’s sweet preference . Chem Senses. 2011; ; 36 : :763.–770. 26.
Todrank J, Heth G, Restrepo D. Effects of in utero odorant exposure on neuroanatomical development of the olfactory bulb and odour preferences . Proc Biol Sci. 2011; ; 278 : :1949.–1955. 27.
Youngentob SL, Kent PF, Sheehe PR, et al. Experience-induced fetal plasticity: the effect of gestational ethanol exposure on the behavioral and neurophysiologic olfactory response to ethanol odor in early postnatal and adult rats . Behav Neurosci. 2007; ; 121 : :1293.–1305. 28.
Mennella JA, Griffin CE, Beauchamp GK. Flavor programming during infancy . Pediatrics. 2004; ; 113 : :840.–845. 29.
Delaunay-El Allam M, Soussignan R, Patris B, et al. Long-lasting memory for an odor acquired at the mother’s breast . Dev Sci. 2010;; 13 : :849.–863. 30.
Hepper PG, Wells DL, Dornan JC, et al. Long-term flavor recognition in humans with prenatal garlic experience . Dev Psychobiol. 2013; ; 55 : :568.–574. 31.
Haller R, Rummel C, Henneberg S, et al. The influence of early experience with vanillin on food preference later in life . Chem Senses. 1999; ; 24 : :465.–467. 32.
Liem DG, Westerbeek A, Wolterink S, et al. Sour taste preferences of children relate to preference for novel and intense stimuli . Chem Senses. 2004; ; 29 : :713.–720. 33.
Yang G, Lim CY, Li C, et al. FoxO1 inhibits leptin regulation of pro-opiomelanocortin promoter activity by blocking STAT3 interaction with specificity protein 1 . J Biol Chem. 2009; ; 284 : :3719.–3727. 34.
Plagemann A, Harder T, Brunn M, et al. Hypothalamic POMC promoter methylation becomes altered by early overfeeding: An epigenetic model of obesity and the metabolic syndrome . J Physiol. 2009; ; 587 : :4963.–4976. 35.
Vucetic Z, Kimmel J, Totoki K, et al. Maternal high-fat diet alters methylation and gene expression of dopamine and opioid-related genes . Endocrinology. 2010; ; 151 : :4756.–4764. 36.
Carlin J, George R, Reyes TM. Methyl donor supplementation blocks the adverse effects of maternal high fat diet on offspring physiology . PLoS One. 2013; ; 8 : :e63549.. 37.
Dias BG, Ressler KJ. Parental olfactory experience influences behavior and neural structure in subsequent generations . Nat Neurosci. 2014; ; 17 : :89.–96. 38.
Orozco-Solis R, Matos RJ, Guzman-Quevedo O, et al. Nutritional programming in the rat is linked to long-lasting changes in nutrient sensing and energy homeostasis in the hypothalamus . PLoS One. 2010; ; 5 : :e13537.. 39.
Szeto IM, Das PJ, Aziz A, et al. Multivitamin supplementation of Wistar rats during pregnancy accelerates the development of obesity in offspring fed an obesogenic diet . Int J Obes. 2009; ; 33 : :364.–372. 40.
Cho CE, Sanchez-Hernandez D, Reza-Lopez SA, et al. High folate gestational and post-weaning diets alter hypothalamic feeding pathways by DNA methylation in Wistar rat offspring . Epigenetics. 2013; ; 8 : :710.–719. 41.
Heijmans BT, Tobi EW, Stein AD, et al. Persistent epigenetic differences associated with prenatal exposure to famine in humans . Proc Natl Acad Sci USA. 2008; ; 105 : :17046.–17049. 42.
Chang GQ, Gaysinskaya V, Karatayev O, et al. Maternal high-fat diet and fetal programming: increased proliferation of hypothalamic peptide-producing neurons that increase risk for overeating and obesity . J Neurosci. 2008; ; 28 : :12107.–12119. 43.
Gugusheff JR, Vithayathil M, Ong ZY, et al. The effects of prenatal exposure to a ‘junk food’ diet on offspring food preferences and fat deposition can be mitigated by improved nutrition during lactation . J Dev Orig Health Dis. 2013; ; 4 : :348.–357. 44.
Teegarden SL, Scott AN, Bale TL. Early life exposure to a high fat diet promotes long-term changes in dietary preferences and central reward signaling . Neuroscience. 2009; ; 162 : :924.–932. 45.
Gorski JN, Dunn-Meynell AA, Hartman TG, et al. Postnatal environment overrides genetic and prenatal factors influencing offspring obesity and insulin resistance . Am J Physiol Regul Integr Comp Physiol. 2006; ; 291 : :R768.–R778. 46.
Breton C, Lukaszewski MA, Risold PY, et al. Maternal prenatal undernutrition alters the response of POMC neurons to energy status variation in adult male rat offspring . Am J Physiol Endocrinol Metab. 2009; ; 296 : :E462.–E472. 47.
Coupe B, Grit I, Hulin P, et al. Postnatal growth after intrauterine growth restriction alters central leptin signal and energy homeostasis . PLoS One. 2012; ; 7 : :e30616.. 48.
Coupe B, Grit I, Darmaun D, et al. The timing of “catch-up growth” affects metabolism and appetite regulation in male rats born with intrauterine growth restriction . Am J Physiol Regul Integr Comp Physiol. 2009; ; 297 : :R813.–R824. 49.
Orozco-Solis R, Lopes de Souza S, Barbosa Matos RJ, et al. Perinatal undernutrition-induced obesity is independent of the developmental programming of feeding . Physiol Behav. 2009; ; 96 : :481.–492. 50.
Remmers F, Verhagen LA, Adan RA, et al. Hypothalamic neuropeptide expression of juvenile and middle-aged rats after early postnatal food restriction . Endocrinology. 2008; ; 149 : :3617.–3625. 51.
Bouret SG, Simerly RB. Development of leptin-sensitive circuits . J Neuroendocrinol. 2007; ; 19 : :575.–582. 52.
Ishii Y, Bouret SG. Embryonic birthdate of hypothalamic leptin-activated neurons in mice . Endocrinology. 2012; ; 153 : :3657.–3667. 53.
Venance L, Maldonado R, Manzoni O. Le système endocannabinoïde central . Med Sci (Paris). 2004; ; 20 : :45.–53. 54.
Goldbeter A, Gérard C, Leloup JC. Biologie des systèmes et rythmes cellulaires . Med Sci (Paris). 2010; ; 26 : :49.–56. |