| |
| Med Sci (Paris). 2015 December; 31(12): 1109–1114. Published online 2015 December 16. doi: 10.1051/medsci/20153112014.L’intolérance musculaire aux statines Antoine Boulanger-Piette,1 Jean Bergeron,1 Joël Desgreniers,2 Michèle Côté-Levesque,2 Dominic Brassard,2 Denis R. Joanisse,3 and Jérôme Frenette1* 1Centre de recherche du CHU de Québec-CHUL, université Laval, 2705, boulevard Laurier, Québec, QC, G1V 4G2Canada 2Faculté de médecine, département de réadaptation, université Laval, 1050, avenue de la Médecine, Québec, QC, G1V 0A6Canada 3Pavillon éducation physique et sports, université Laval, 2300, rue de la Terrasse, Québec, QC, G1V 0A6, Canada |
La prise en charge de l’hypercholestérolémie est une priorité médicale de par son statut de facteur de risque majeur dans le développement des maladies cardiovasculaires [1]. À la lumière des résultats de l’enquête canadienne sur les mesures de santé de 2012-2013, une dyslipidémie a été mesurée, ou autodéclarée, chez 38 % des répondants âgés de 18 à 79 ans. Parmi les personnes dyslipidémiques, 51 % étaient au fait de leur état de santé et 30 % de ces derniers contrôlaient leur taux de cholestérol sanguin au moyen de médicaments (Statistique Canada, 2014)1. Selon l’American College of Cardiology, l’American Heart Association et le Canadian Working Group Consensus, les statines demeurent le traitement de choix en matière de dyslipidémie grâce à leur effet de réduction des risques cardiovasculaires reconnu et fondé sur des évidences scientifiques. Dans cet article de synthèse, nous aborderons (1) l’usage et la sécurité associés aux statines, (2) l’incidence des symptômes musculaires reliés à leur prise, (3) la relation entre les symptômes et l’entraînement physique, (4) les mécanismes moléculaires et cellulaires proposés qui contribuent aux effets musculaires et, finalement, (5) l’approche clinique actuelle et désirée. |
Les statines : usage et sécurité L’approche pharmacologique préconisée dans le traitement de l’hypercholestérolémie est de compromettre la production de cholestérol hépatique afin d’augmenter l’utilisation de celui qui est en circulation. Les statines sont des médicaments qui inhibent de façon compétitive la 3-hydroxy-3-méthylglutaryl-CoA (HMG-CoA) réductase, une coenzyme permettant la synthèse du mévalonate, une molécule limitante dans la biosynthèse hépatique du cholestérol. Conjointement à cette étape, l’activité des récepteurs des lipoprotéines de basse densité (LDL) est augmentée, ce qui permet l’abaissement, par endocytose, du niveau de cholestérol circulant. Il a été démontré que l’usage de cette classe de molécules est efficace pour prévenir les événements cardiovasculaires majeurs (infarctus ou accident vasculaire cérébral), diminuant ainsi la mortalité et la morbidité qui leur sont associées [2]. Au Canada, six statines sont actuellement autorisées : la lovastatine, la simvastatine, la pravastatine, l’atorvastatine, la fluvastatine ainsi que la rosuvastatine (Santé Canada, 2014)2 et toutes sont maintenant disponibles en version générique. En dépit de la démonstration claire des bénéfices de la prise de statines sur la diminution du risque d’événements et de mortalité cardiovasculaires (CV), l’utilisation de statines demeure controversée en prévention primaire, lorsque le risque cardiovasculaire n’est pas très élevé et que le traitement s’accompagne en plus d’effets secondaires significatifs. Ainsi, malgré la sécurité rapportée dans les essais cliniques randomisés, plusieurs effets indésirables ont été répertoriés depuis leur introduction sur le marché pharmaceutique. Certains effets secondaires connus sont sévères. Par exemple, la cérivastatine a été retirée du marché canadien en 2004 à cause de son incidence élevée sur l’apparition de rhabdomyolyse3, parfois fatale, établie aux États-Unis et en Allemagne. Aujourd’hui, on suggère que les statines pourraient également accélérer, entre autres, le développement d’un diabète de type 2, favoriser l’élévation des niveaux circulants d’enzymes hépatiques, favoriser les douleurs articulaires (arthralgie) et, surtout, augmenter le risque de présenter des symptômes musculo-squelettiques divers [3–6]. Ces derniers sont les effets secondaires les plus souvent rapportés. Ils se manifesteraient généralement au cours des premières semaines suivant l’initiation de la prise de la médication [7]. Se présentant de façon très hétérogène, les effets secondaires constituent une des principales raisons de non-respect du traitement, abandonnant certains patients à des risques cardiovasculaires non maîtrisés. |
Incidence de symptômes musculaires suivant la prise de statines Bien que l’incidence des symptômes musculaires indésirables attribués à la prise de statines ait été observée dans plusieurs études, il est difficile de la généraliser à l’ensemble de la population. L’éventail possible de symptômes musculaires est vaste. Il est donc difficile d’établir une définition commune et acceptée du portrait clinique de ces effets. Les critères permettant de conclure à la présence d’une dysfonction musculaire dans les études randomisées sont également très variables. Il est aussi parfois difficile d’établir un lien de cause à effet entre la prise de statines et les symptômes observés. Ainsi, la concordance entre la prise de statines et les plaintes musculaires est remise en doute dans certaines études, particulièrement dans une population déjà à risque de présenter des douleurs ou des dysfonctions musculosquelettiques. En effet, en plus de la possibilité d’interactions pharmacologiques avec d’autres médications de prévention cardiovasculaire, plusieurs substances capables de provoquer des altérations musculaires comme l’alcool, les opioïdes, les agents psychotropes ou immunosuppresseurs, sont souvent associées au traitement [7–11]. L’étude PRIMO (prédiction du risque musculaire en observationnel) rapportait, chez les utilisateurs de statines, une incidence de 11 % de dysfonctions musculaires, tous symptômes confondus, dont 4 % avec symptômes suffisamment handicapants pour limiter les activités de la vie quotidienne (AVQ) et 0,4 % nécessitant un alitement complet [12]. Une revue de littérature plus récente indique, quant à elle, une prévalence de myopathies comprise entre 1 et 5 % dans le cadre d’essais cliniques contrôlés, et de 11 à 29 % dans le cadre d’études de cohortes [7]. Une autre étude a démontré que la prise quotidienne d’une haute dose d’atorvastatine (80 mg) doublait l’incidence des myalgies, contrairement au placebo, la faisant passer de 4,6 % à 9,4 % [9]. Face à l’émergence de symptômes musculaires réels suivant la prise de statines, les membres de la Statin Muscle Safety Task Force ont proposé une classification en cinq catégories des symptômes musculaires associés aux statines : (1) les myalgies, (2) les myopathies, (3) les myosites, et (4-5) les myonécroses avec ou sans insuffisance rénale. Par ailleurs, le Canadian Working Group Consensus représente une source de référence où sont répertoriés de façon exhaustive les possibles effets adverses du traitement ainsi que les facteurs de risques connus [5]. Pour des définitions et descriptions de ces problèmes musculaires, on pourra se référer aux articles énumérés dans la revue de Mancini et al. [5] (Tableau I).
Tableau I.
| Facteurs endogènes |
Facteurs exogènes |
| Âge élevé (> 80 ans) |
Haute dose de statines |
|
| Sexe féminin |
Abus d’alcool |
|
| Ethnie asiatique |
Utilisation de drogues illicites |
|
| Indice de masse corporelle bas, petite taille, faiblesse |
Antipsychotiques |
|
| Historique de douleurs musculaires, articulaires et tendineuses inexpliquées |
Interactions en polypharmacie |
|
| Historique d’élévations de la
créatine kinase |
Fibrates |
|
| Historique familial de myopathie |
Acide nicotinique |
|
| Historique familial de myopathie
associée aux statines |
Amiodarone |
|
| Maladies neuromusculaires |
Vérapamil |
|
| Insuffisance rénale sévère |
Warfarine |
|
| Maladie hépatique aiguë/
décompensée |
Cyclosporine |
|
| Hypertension/insuffisance cardiaque |
Antibiotiques macrolides |
|
| Hypothyroïdie |
Antifongiques azolés |
|
| Diabète |
Inhibiteurs de protéases |
|
| Polymorphismes génétiques |
Nefazodone |
|
|
|
Grandes quantités de jus de pamplemousse/grenade |
|
|
|
Chirurgie avec grande demande métabolique |
|
|
|
Exercice inhabituel/intense |
Prédispositions à développer des effets secondaires musculaires (d’après [ 5]). |
|
Entraînement et atteintes musculaires associées aux statines Les myalgies causées par les statines peuvent s’apparenter à de la fatigue musculaire à la suite d’un effort physique ou à d’autres blessures musculo-squelettiques [12]. Il est d’ailleurs rapporté que ces manifestations sont plus probables chez les individus actifs consommant des statines que chez les sujets sédentaires [13]. En effet, dans l’étude PRIMO, 26 % des patients disaient éprouver des faiblesses et des pertes de force musculaire pendant l’exercice, avec ou sans autres symptômes. Fait intéressant, la prévalence des symptômes musculaires serait de 10,8 % chez les patients s’adonnant à une activité physique légère ; elle s’élèverait à 14,7 % chez les patients pratiquant un sport intense [12]. Sizinger et O’Grady ont observé, quant à eux, que 78 % des sujets d’un groupe d’athlètes de haut niveau, traités pour l’hypercholestérolémie familiale, n’ont toléré aucune statine [14]. L’impact des statines sur la force musculaire est controversé. Alors que des évidences cliniques montrent un accroissement des myalgies avec l’exercice physique, d’autres ont plutôt démontré que la force musculaire et la performance à l’exercice n’étaient pas influencées par la prise d’atorvastatine chez des individus sains [8, 9]. En ce qui concerne la réponse du muscle à l’entraînement en résistance (en anglais, high intensity resistance exercise training [RET]), la consommation de statines n’aurait pas d’influence significative sur le gain de masse musculaire ou le gain de force suivant un tel programme d’entraînement [15]. La fonction musculaire pourrait même ne pas être altérée par la prise chronique d’atorvastatine lors d’exercices musculaires excentriques [16]. Une revue récente de la littérature abonde dans le même sens et avance que les statines n’auraient pas d’influence sur l’adaptation musculaire à l’entraînement en résistance [17]. Toutefois, l’exercice physique en général et, particulièrement, les contractions musculaires excentriques, pourraient aggraver les myopathies et les myalgies déjà en place. Certains auteurs suggèrent donc que la prise de statines puisse prédisposer à des dommages musculaires à l’exercice [18] et que l’incidence des myopathies augmenterait en fonction de l’intensité de l’activité physique pratiquée [12]. Les sujets sous prescription de statines seraient ainsi à risque de développer des myalgies à la suite de l’initiation d’un programme d’exercices de renforcement. Bien que maintes fois observé dans des modèles animaux, l’effet délétère des statines sur la capacité aérobie n’a pas clairement été démontré chez l’humain [17]. Certains suggèrent que la prise de simvastatine pourrait atténuer l’amélioration de la condition cardiorespiratoire suivant l’entraînement aérobie [19]. D’autres n’ont pas observé de différence dans l’évolution de la capacité aérobie maximale et de la force de préhension entre les patients qui suivent un programme de réadaptation cardiaque et qui sont traités avec des statines et ceux qui n’en consomment pas [20]. Il est important de souligner que l’entraînement aérobie, qui permet l’amélioration de la condition physique générale, a un effet direct sur les facteurs de risque de l’hypercholestérolémie même si les adaptations à l’effort aérobie pourraient être moindres chez les gens consommant des statines [19]. Dans tous les cas, les mécanismes précis en cause restent à confirmer, mais l’activité physique et son intensité pourraient prédisposer à développer des symptômes musculaires suivant la prise de statines. Si on considère les données de la littérature qui suggèrent que les statines n’affectent pas les adaptations à l’exercice, ce traitement ne devrait pas être envisagé d’emblée comme un obstacle à l’initiation d’un programme d’exercices, il serait même associée à un meilleur niveau fonctionnel suivant des programmes de réadaptation ou d’entraînement en résistance, encadrés et contrôlés par des professionnels de la santé [21]. |
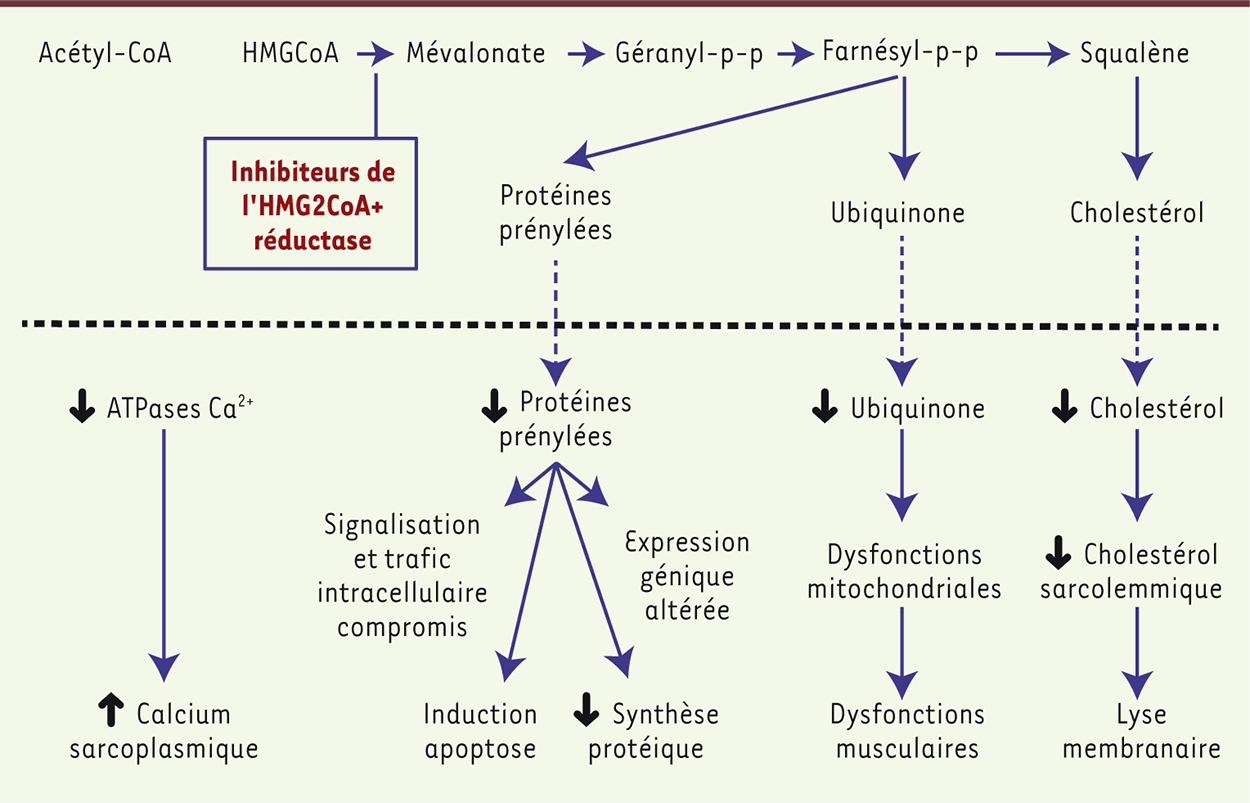
Myotoxicité reliée aux statines : mécanismes cellulaires et moléculaires Les mécanismes cellulaires et moléculaires expliquant la myotoxicité reliée aux statines sont vraisemblablement complexes et restent encore peu compris. Principalement étudiés chez l’animal, en particulier le rongeur, ces mécanismes seraient multifactoriels et toucheraient plusieurs systèmes physiologiques et voies de signalisation. D’abord, la diminution du cholestérol sarcolemmal et des isoprénoïdes par les statines pourrait contribuer à rendre les membranes cellulaires instables, influençant ainsi leur conduction ionique. L’inhibition de la synthèse du mévalonate aurait aussi pour effet de diminuer les concentrations de dolichols, d’ubiquinones et de protéines prénylatées [22]. Ces différents composés participent respectivement à la croissance cellulaire et à la synthèse des glycoprotéines, à la réduction des taux d’acide carboxylique issu de la phosphorylation oxydative, et à la modulation de la transcription et du trafic intracellulaire. Leur inhibition pourrait donc perturber à la fois l’architecture cellulaire et son métabolisme. Le traitement engendrerait également une hausse de l’activité des protéases dépendantes du calcium, les calpaïnes, la répression de la synthèse protéique et l’activation de la voie de dégradation ubiquitine/protéasome, ces voies de signalisation modulant l’équilibre protéique intracellulaire [23]. Ces événements seraient accompagnés, et possiblement causés, par une perte de l’homéostasie calcique résultant en une élévation chronique des concentrations de calcium cytosolique de repos, activant les voies cataboliques et apoptotiques, à l’origine d’atrophie et d’apoptose, et ce, particulièrement au niveau des fibres musculaires rapides [23]. La perte d’homéostasie calcique, et l’altération de la conduction ionique, pourraient favoriser les symptômes de crampes rencontrés chez des utilisateurs de statines. Des dysfonctions mitochondriales pourraient également exacerber la condition myopathique en perturbant le transport de la coenzyme Q10 (CoQ10). Les statines entraîneraient ainsi une déficience des fonctions oxydatives mitochondriales, ce qui altèrerait la production d’énergie issue de la phosphorylation oxydative [24]. Ensemble, ces observations qui concernent des atteintes des fibres rapides ainsi qu’une fonction mitochondriale compromise, pourraient expliquer les faiblesses et la fatigabilité rapportées par certains patients traités par les statines. Au-delà des mécanismes d’action intracellulaires responsables des effets indésirables musculaires, les mécanismes de transport et d’élimination des statines dans l’organisme pourraient également être impliqués dans le risque de développer des effets délétères systémiques. Ces mécanismes musculaires et hépatiques pourraient être à l’origine de concentrations très variables, parfois très élevées, de statines plasmatiques chez des sujets recevant pourtant la même posologie. Cette concentration plasmatique des statines fragiliserait les cellules musculaires, augmentant ainsi le risque de développer les symptômes associés [25] (Figure 1).
 | Figure 1.
Voies de signalisation possiblement affectées par les statines et leurs effets en aval (adapté de [ 29]). |
Une problématique perdurant depuis plusieurs années en clinique est d’identifier objectivement les patients souffrant d’intolérance aux statines. En 2014, le National Lipid Association’s Muscle Safety Expert Panel identifie l’éventail des effets indésirables reliés aux statines. Il fournit des lignes directrices combinées à un algorithme de prédiction de la probabilité d’intolérance au traitement. Dans ce rapport, Rosenson et son équipe établissent une probabilité à partir d’un score relié à un index symptomatique clinique, accompagné de tests et de critères permettant de confirmer et appuyer le diagnostic. Ils élaborent également une stratégie clinique pour l’évaluation et la prise en charge selon l’apparition des symptômes [7]. |
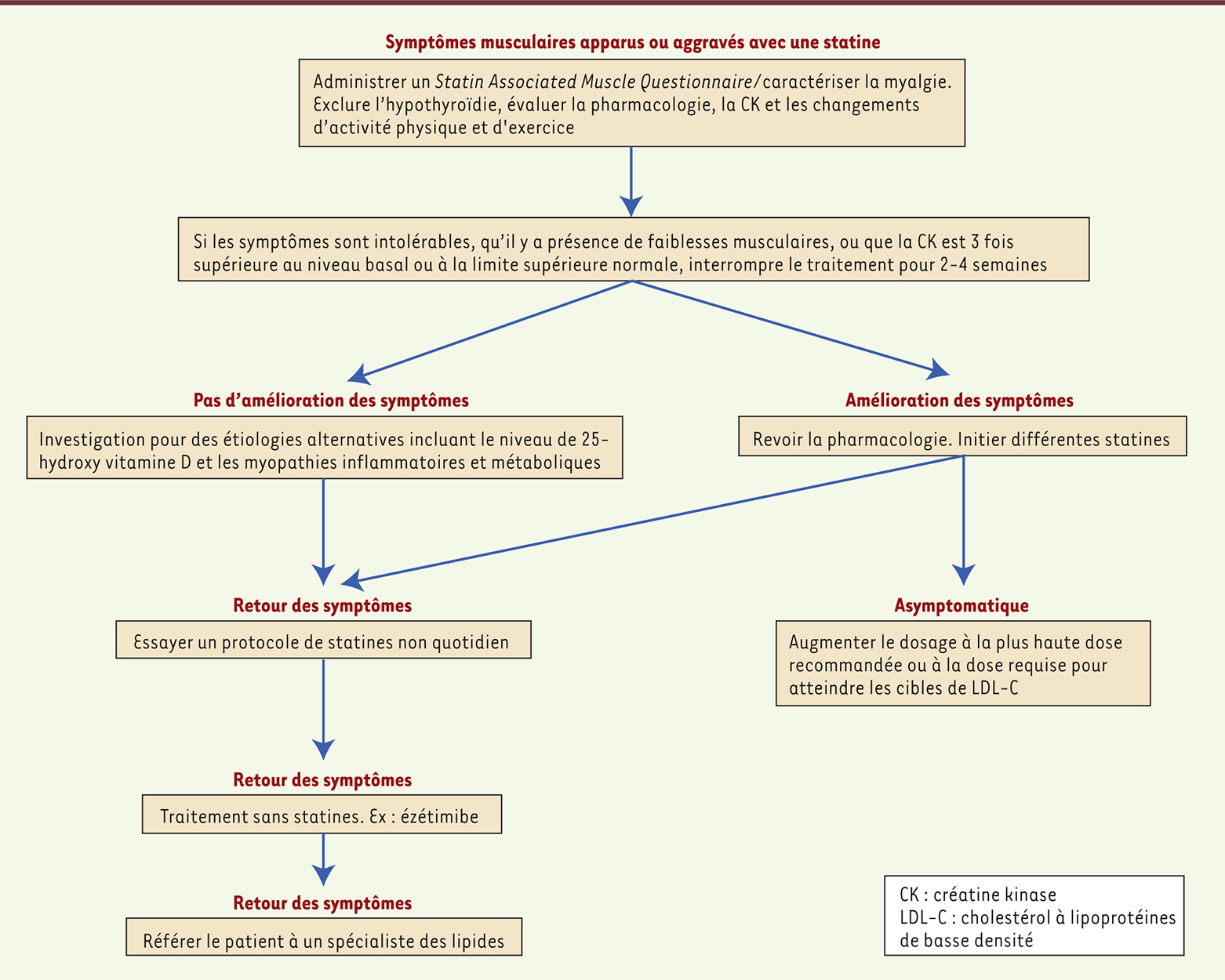
Approche clinique actuelle L’approche clinique actuelle se base sur l’historique cardiovasculaire du patient en prévention secondaire, ou sur les facteurs de risque cardiovasculaire traditionnels en prévention primaire, afin d’ajuster le niveau d’intervention pharmacologique avec les statines. Ainsi, le clinicien se réfèrera à un seuil absolu de risque cardiovasculaire ainsi qu’à des facteurs de risques supplémentaires, comme l’historique cardiovasculaire familial ou la présence d’un syndrome métabolique en évolution, pour décider devant des symptômes d’intolérance, de continuer le traitement à la statine ou non. Il aura alors, avec le patient, une discussion ouverte basée sur des évidences ainsi que sur les bénéfices et les risques potentiels reliés à la prise de statines. Cette démarche centrée sur le patient tiendra également compte de son âge, de son historique en rapport à sa tolérance aux différentes statines, de son degré d’activité physique et de sa polypharmacothérapie. La prise en compte de ce contexte permettra d’évaluer si la statine représente la meilleure voie thérapeutique [26]. Le European Atherosclerosis Society Consensus Panel statuait récemment sur l’évaluation, l’étiologie et la prise en charge de symptômes musculaires associés aux statines [31]. Ses conclusions et recommandations rejoignent certains points de la Statin Muscle Safety Task Force illustrés dans la
Figure 2
, c’est-à-dire de tenir compte de la nature des symptômes et de la chronologie d’apparition de ces derniers. Il conseille également l’exploitation de la dose maximale tolérable, des alternatives thérapeutiques, l’essai d’une prise pharmacologique intermittente et l’essai de trois statines différentes, avant de référer à un spécialiste.
 | Figure 2.
Algorithme d’évaluation de l’intolérance associée aux statines par le Statin muscle safety task force 2014 (adapté de [ 7]). |
|
Regard sur l’approche clinique future Étant donnée l’absence d’outils de mesure reconnus, les effets musculaires associés aux statines sont difficiles à identifier cliniquement et à quantifier avec précision. La variété de symptômes, la chronologie variable entre individus et l’hétérogénéité des mécanismes physiopathologiques proposés, expliquent en grande partie cette difficulté. De plus, les connaissances fondamentales souffrent du manque d’études mécanistiques réalisées chez l’humain. Elles seraient pourtant nécessaires à l’établissement d’une stratégie d’action appropriée. Les techniques moléculaires poussées, permettant notamment l’analyse spécifique des prédispositions génétiques, rendraient possible la prescription personnalisée en fonction de la tolérance, selon le génotype du patient, comme le laissent entrevoir plusieurs études dont une étude pharmacogénétique d’ampleur publiée dans Nature en 2014, une étude de prédiction pharmacogénétique dans Circulation en 2013, ainsi que l’étude SEARCH publiée dans le New England Journal of Medicine [26–29]. L’émergence de molécules pharmacologiques alternatives, comme par exemple les anticorps monoclonaux inhibiteurs de PCSK9 (proprotein convertase subtilisin/kexin type 9) qui agit sur l’abondance des récepteurs aux LDL (low-density lipoprotein), élargira les possibilités thérapeutiques. Quoi qu’il en soit, il est maintenant admis qu’une prise en charge accrue des habitudes de vie, en prévention cardiovasculaire, est primordiale et incontournable dans le cas de dyslipidémie en lien avec l’environnement et le comportement individuel. Le professionnel de la santé devrait prodiguer un encadrement multidisciplinaire permettant, pour l’individu, d’atteindre les valeurs lipidiques cibles (cholestérol total, LDL, HDL [high-density lipoprotein] et triglycérides). Des outils cliniques permettant d’identifier objectivement les individus intolérants aux statines doivent ainsi être validés. Cet encadrement multidisciplinaire, constitué d’interventions portant sur l’hygiène de vie, la nutrition et l’activité physique, et ce, avant la survenue d’un premier événement cardiovasculaire, peut s’avérer être d’un bénéfice supérieur à celui des statines dans certaines situations. Certains travaux comme ceux de Estruch et de ses collaborateurs montrent en effet que, chez les diabétiques et sujets à haut risque cardiovasculaire, la diète méditerranéenne, particulièrement riche en huile d’olive et en noix, pourrait être aussi efficace pour abaisser le risque cardiovasculaire qu’une statine [30]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Joffres M, Shields M, Tremblay MS. Connor Gorber S. Dyslipidemia prevalence, treatment, control and awareness in the Canadian health measures survey . Can J Public Health. 2013; ; 104 : :252.–257. 2.
Baigent C, Keech A, Kearney PM, et al. Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90,056 participants in 14 randomized trials of statins . Lancet. 2005; ; 366 : :1267.–1278. 3.
Macedo AF, Taylor FC, Casas JP, et al. Unintended effects of statins from observational studies in the general population: systematic review and meta-analysis . BMC Med. 2014; ; 12 : :51.. 4.
Maki KC, Ridker PM, Brown WV, et al. An assessment by the Statin Diabetes Safety Task Force: 2014 update . J Clin Lipidol. 2014; ; 8 : :17.–29. 5.
Mancini GB, Tashakkor AY, Baker S, et al. Diagnosis, prevention, and management of statin adverse effects and intolerance: Canadian Working Group Consensus update . Can J Cardiol. 2013; ; 29 : :1553.–1568. 6.
Mansi I, Frei CR, Pugh MJ, et al. Statins and musculoskeletal conditions, arthropathies, and injuries . JAMA Intern Med. 2013; ; 173 : :1318.–1326. 7.
Rosenson RS, Baker SK, Jacobson TA, et al. An assessment by the Statin Muscle Safety Task Force: 2014 update . J Clin Lipidol. 2014; ; 8 ((suppl 3)) : :S8.–71. 8.
Thompson PD, Parker B. Statins, exercise, and exercise training . J Am Coll Cardiol. 2013; ; 62 : :715.–716. 9.
Parker BA, Capizzi JA, Grimaldi AS, et al. Effect of statins on skeletal muscle function . Circulation. 2013; ; 127 : :96.–103. 10.
Ganga HV, Slim HB, Thompson PD. A systematic review of statin-induced muscle problems in clinical trials . Am Heart J. 2014; ; 168 : :6.–15. 11.
Finegold JA, Manisty CH, Goldacre B, et al. What proportion of symptomatic side effects in patients taking statins are genuinely caused by the drug? Systematic review of randomized placebo-controlled trials to aid individual patient choice . Eur J Prev Cardiol. 2014; ; 21 : :464.–474. 12.
Bruckert E, Hayem G, Dejager S, et al. Mild to moderate muscular symptoms with high-dosage statin therapy in hyperlipidemic patients: the PRIMO study . Cardiovasc Drugs Ther. 2005; ; 19 : :403.–414. 13.
Di Stasi SL, MacLeod TD, Winters JD, Binder-Macleod SA. Effects of statins on skeletal muscle: a perspective for physical therapists . Phys Ther. 2010; ; 90 : :1530.–1542. 14.
Sinzinger H, O’Grady J. Professional athletes suffering from familial hypercholesterolaemia rarely tolerate statin treatment because of muscular problems . Br J Clin Pharmacol. 2004; ; 57 : :525.–528. 15.
Riechmann SE, Andrews RD, MacLean DA, Sheather S. Statins and dietary and serum cholesterol are associated with increased lean mass following resistance training . J Gerontol Biol Sci Med Sci. 2007; ; 62 : :1164.–1171. 16.
Panayiotou G, Paschalis V, Nikolaidis MG, et al. No adverse effects of statins on muscle function and health-related parameters in the elderly: an exercise study . Scand J Med Sci Sports. 2013; ; 23 : :556.–567. 17.
Murlastis Z, Radak Z. The effects of statin medications on aerobic exercise capacity and training tdaptations . Sports Med. 2014; ; 44 : :1519.–1530. 18.
Meador BM, Huey KA. Statin-associated myopathy and its exacerbation with exercise . Muscle Nerve. 2010; ; 42 : :469.–479. 19.
Mikus CR, Boyle LJ, Borengasser SJ, et al. Simvastatin impairs exercise training adaptations . J Am Coll Cardiol. 2013; ; 62 : :709.–714. 20.
Rengo JL, Savage PD, Toth MJ, Ades PA. Statin therapy does not attenuate exercise training response in cardiac rehabilitation . J Am Coll Cardiol. 2014; ; 63 : :2050.–2055. 21.
Morandi A, Girard TD, Shintani A, et al. Association between statin use at admission to inpatient rehabilitation and functional status at discharge among older patients . Rejuvenation Res. 2014; ; 17 : :490.–495. 22.
Bitzur R, Cohen H, Kamari Y, Harats D. Intolerance to statins: mechanisms and management . Diabetes Care. 2013; ; 36 : :325.–330. 23.
Taha DA, De Moor CH, Barrett DA, Gershkovich P. Translational insight into statin-induced muscle toxicity: from cell culture to clinical studies . Transl Res. 2014; ; 164 : :85.–109. 24.
Moßhammer D, Schaeffeler E, Schwab M, Mörike K. Mechanisms and assessment of statin-related muscular adverse affects . Br J Clin Pharmacol. 2014; ; 78 : :454.–466. 25.
Postmus I, Trompet S, Deshmukh HA, et al. Pharmacogenetic meta-analysis of genome-wide association studies of LDL cholesterol response to statins . Nat Commun. 2014; ; 5 : :5068.. 26.
Goff DC Jr, Lloyd-Jones DM, Bennett G, et al. ACC/AHA guideline on the assessment of cardiovascular risk: a report of the American college of cardiology/American heart association task force on practice guidelines . J Am Coll Cardiol. 2014; ; 63 : :2935.–2959. 27.
DeGorter MK, Tirona RG, Schwarz UI, et al. Clinical and pharmacogenetic predictors of circulating atorvastatin and rosuvastatin concentrations in routine clinical care . Circ Cardiovasc Genet. 2013; ; 6 : :400.–408. 28.
Search Collaborative Group. , Link E, Parish S, et al. SLCO1B1 variants and statin-induced myopathy - a genomewide study . N Engl J Med. 2008; ; 359 : :789.–799. 29.
Needham M, Mastaglia FL. Statin myotoxicity: a review of genetic susceptibility factors . Neuromuscul Disord. 2014; ; 24 : :4.–15. 30.
Estruch R, Ros E, Salas-Salvadó J, et al. Primary prevention of cardiovascular disease with a Mediterranean diet . N Engl J Med. 2013; ; 368 : :1279.–1290. 31.
Stroes ES, Thompson PD, Corsini A, et al. Statin-associated muscle symptoms: impact on statin therapy - European atherosclerosis society consensus panel statement on assessment, aetiology and management . Eur Hearth J. 2015; ; 36 : :1012.–1022. |