| |
| Med Sci (Paris). 2015 December; 31(12): 1092–1101. Published online 2015 December 16. doi: 10.1051/medsci/20153112012.Infection par le virus de l’immunodéficience humaine Rôle majeur du tissu lymphoïde de la muqueuse digestive (GALT) Delphine Vergnon-Miszczycha,1,2 Frédéric Lucht,1,2 Xavier Roblin,1,3 Bruno Pozzetto,1,4 Stéphane Paul,1,5 and Thomas Bourlet1,4* 1GIMAP/EA3064, Inserm CIC 1408 vaccinologie, université de Saint-Étienne, COMUE de Lyon, 42023Saint-Étienne, France 2Service de maladies infectieuses et tropicales, CHU de Saint-Étienne, 42055Saint-Étienne Cedex 02, France 3Service de gastro-entérologie, CHU de Saint-Étienne, 42055Saint-Étienne Cedex 02, France 4Laboratoire des agents infectieux et d’hygiène, CHU de Saint-Étienne, 42055Saint-Étienne Cedex 02, France 5Laboratoire d’immunologie, CHU de Saint-Étienne, 42055Saint-Étienne Cedex 02, France |
Le GALT (gut associated lymphoid tissue) est à l’origine de nombreuses anomalies immunologiques au cours de l’infection par le virus de l’immunodéficience humaine de type 1 (VIH-1) [1]. Il constitue d’une part le principal réservoir pour le virus dont la persistance sous traitement antirétroviral (TARV) est un obstacle majeur à l’éradication du virus. Il pourrait être ainsi à l’origine du rebond de virémie observé à l’arrêt de la trithérapie. Seuls quelques patients, se caractérisant essentiellement par un réservoir viral faible, présentent une « guérison fonctionnelle », autrement dit un contrôle prolongé de l’infection après arrêt du traitement [2]. D’autre part, l’infection par le VIH-1 altère l’immunité muqueuse intestinale via une profonde déplétion en lymphocytes T (LT) CD4+ muqueux. Ceci conduit à un état d’hyperactivation immunitaire systémique qui favorise à la fois la progression de l’infection virale et la survenue de complications chroniques inflammatoires [3]. L’objectif de cette revue est de définir le rôle du GALT au cours de l’infection par le VIH-1 et de faire l’état des lieux des stratégies actuelles permettant de réduire la taille du réservoir intestinal et de restaurer une immunité muqueuse compétente. |
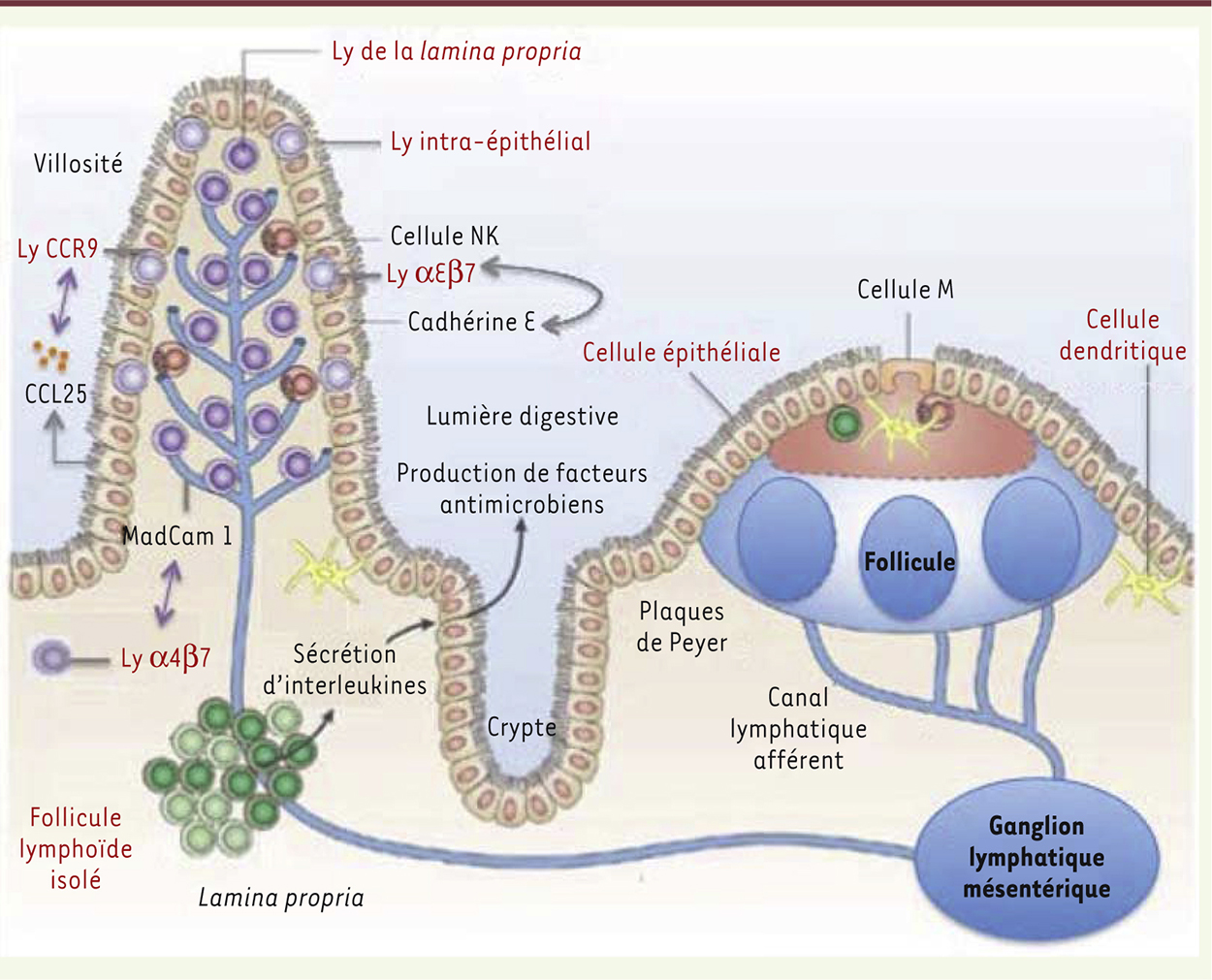
Le GALT, premier réservoir et sanctuaire anatomique pour le VIH-1 Dans la pathologie liée au VIH-1, la notion de réservoir correspond à des cellules du sang circulant (majoritairement des lymphocytes T CD4+ mémoires) infectées par un virus latent capable de se réactiver même chez des patients sous TARV. Cette latence est régulée par de multiples mécanismes incluant la séquestration de facteurs de transcription de l’hôte, de silencing épigénétique et d’interférence transcriptionnelle. Le réservoir se définit également comme un compartiment tissulaire constitué de cellules infectées dans lesquelles le virus persiste et continue de se répliquer. Le GALT est le principal réservoir pour le VIH. Il est constitué des plaques de Peyer, de la lamina propria, des lymphocytes intra-épithéliaux, des ganglions mésentériques et des follicules lymphoïdes isolés (Figure 1). Il comprend environ 80 % des lymphocytes de l’organisme [4] dont le plus important contingent de lymphocytes T CD4+/CCR5+ mémoires et activés, les cellules cibles préférentielles du VIH-1 [5]. Leur répartition n’est pas homogène dans l’intestin. Au niveau de l’intestin grêle, ils sont principalement regroupés dans les plaques de Peyer, en proportion plus importante dans l’iléon. Au niveau du gros intestin (cæcum, côlon et rectum), les lymphocytes sont préférentiellement regroupés dans les follicules lymphoïdes, majoritairement présents au niveau du rectum. La plupart de ces lymphocytes T expriment à leur surface des intégrines, α4β7 ou αEβ7, et le récepteur CCR9 (C-C chemokine receptor type 9) qui leur permettent de migrer du sang périphérique vers l’intestin, attirés par leurs ligands naturels respectifs MAdCAM-1 (mucosal addressin cell adhesion molecule-1), la E-cadhérine et la chimiokine CCL25 (chemokine [C-C motif] ligand 25) qui sont surtout exprimés par les cellules endothéliales et épithéliales de l’intestin grêle (Figure 1). Le VIH serait également capable d’infecter, en proportion beaucoup plus faible, d’autres types cellulaires au sein de la muqueuse digestive comme les macrophages, les cellules dendritiques, les mastocytes, les cellules NK (natural killer) et les lymphocytes T CD8+ et Tγδ [6]. Le GALT est ainsi le siège d’une réplication virale massive dès les premières heures de la primo-infection [7], qui persiste durant la phase chronique, y compris sous TARV. Le VIH-1 est encore détecté en quantité importante dans le GALT, chez des patients traités depuis plusieurs années et qui présentent pourtant une charge virale plasmatique indétectable [8]. Yukl et al. ont montré que le taux d’ADN total du VIH était 5 à 10 fois plus élevé dans l’intestin que dans le sang. Ils ont ainsi suggéré que le GALT contiendrait entre 80 et 95 % des lymphocytes T CD4+ infectés présents dans l’organisme [9]. Ceci pourrait s’expliquer en partie par une plus grande proportion, au niveau intestinal, de lymphocytes T mémoires transitoires, plus sensibles à l’infection par le VIH. Plusieurs éléments expliquent la formation et la persistance de ce réservoir. Tout d’abord, le VIH-1 est capable de rester à l’état latent au sein de certaines cellules à longue durée de vie, essentiellement les cellules mémoires centrales et transitionnelles, abondantes dans le tissu lymphoïde [10]. Le renouvellement constant de cette population cellulaire assure ainsi la stabilité du réservoir viral [11]. La latence virale résulte de phénomènes épigénétiques comme la méthylation de l’ADN et la déacétylation des histones, qui répriment la transcription de l’ADN viral (donc la production de virions) une fois qu’il est intégré dans la chromatine de la cellule hôte [12]. Cet ADN intégré, rendu « silencieux », est le principal obstacle à l’éradication du virus par les antirétroviraux actuels [10]. Les phénomènes de latence et de réplication virale ne semblent pas homogènes au sein de l’intestin. En effet, chez des patients traités, il a été détecté des taux croissants d’ADN du VIH du duodénum au rectum, et une réplication intracellulaire plus importante au niveau de l’iléon [9].
 | Figure 1.Représentation schématique du GALT. Les cellules cibles potentielles du virus VIH-1 sont représentées en gras et en rouge. Le GALT est constitué par les plaques de Peyer, la lamina propria, les lymphocytes intra-épithéliaux, les ganglions mésentériques et les follicules lymphoïdes isolés. Les cellules épithéliales participent également à la défense muqueuse en tant que barrière et via la sécrétion dans la lumière digestive de différents facteurs inflammatoires et antimicrobiens. Les cellules M sont capables de capter par endocytose des antigènes de la lumière digestive pour les présenter aux cellules dendritiques qui activent l’immunité spécifique dans les follicules lymphoïdes. Ly : lymphocyte T (adapté de Vivier et al. [ 61]). |
Une question importante est celle de la définition de marqueurs viraux permettant d’apprécier la taille du réservoir viral et par conséquent l’efficacité des stratégies à visée curative [13]. La mesure de l’ADN total du VIH-1 permet d’estimer la fréquence de cellules infectées au niveau systémique ou tissulaire. La quantité de provirus intégrés peut être appréciée par une amplification génique de type alu-gag (Alu-gag PCR)1,, ciblant une zone d’intégration du génome viral dans celui de la cellule. Actuellement, cette technique manque cependant de standardisation. La réplication virale intracellulaire peut, quant à elle, être évaluée par la recherche des formes 1- et 2-LTR (long terminal repeat)2 ainsi que de l’ARN du VIH-1. Des travaux sont nécessaires afin d’améliorer la sensibilité et la reproductibilité de ces méthodes qui permettraient de sélectionner au mieux les patients candidats pour des protocoles visant à réduire ou éradiquer le réservoir viral. La persistance du VIH-1 dans le tractus digestif peut également s’expliquer par la mauvaise diffusion de certaines molécules dans ce compartiment, véritable sanctuaire anatomique. En effet, la plupart des molécules antirétrovirales atteignent des concentrations intracellulaires beaucoup plus faibles dans le tissu lymphoïde par rapport à celles qui sont obtenues au niveau plasmatique ou dans les cellules mononucléées du sang périphérique (PBMC, peripheral blood mononuclear cell) [14]. Ceci favoriserait ainsi la réplication du VIH-1 à ce niveau [15]. Si cette hypothèse est très discutée, plusieurs arguments sont en faveur d’une réplication virale à bas bruit dans le GALT. Yukl et al. ont constaté une diminution de la transcription de l’ARN du VIH au niveau iléal chez 5 patients après intensification thérapeutique par le raltégravir [16]. Cet inhibiteur d’intégrase agit en empêchant l’intégration de l’ADN viral dans le génome de la cellule infectée. L’intensification thérapeutique par le raltégravir ainsi observée ne pouvait être efficace que s’il persistait des cycles d’intégration et de transcription de l’ADN viral dans le compartiment digestif. Par des analyses phylogénétiques, d’autres auteurs - qui ont montré une faible évolution génétique des virus présents dans le GALT au cours du temps - considèrent, à l’inverse, la réplication virale comme un phénomène mineur sous TARV [17]. Ces résultats discordants s’expliquent en partie par le fait que la réplication virale, au sein du tissu lymphoïde digestif, n’est pas homogène. Elle varie en fonction du site prélevé comme si le GALT se composait d’une juxtaposition de compartiments communicant entre eux et avec le sang périphérique, mais ayant chacun une dynamique virale propre [10]. La réplication virale persistante du VIH dans le GALT semble également dépendre de facteurs génétiques, du TARV, ou encore de l’environnement inflammatoire [3, 14]. Le GALT comprendrait donc, à la fois, un contingent de cellules infectées latentes, susceptibles de se réactiver à l’arrêt du traitement, et des cellules infectées actives, potentiellement responsables de nouveaux cycles d’infection en dépit du traitement. |
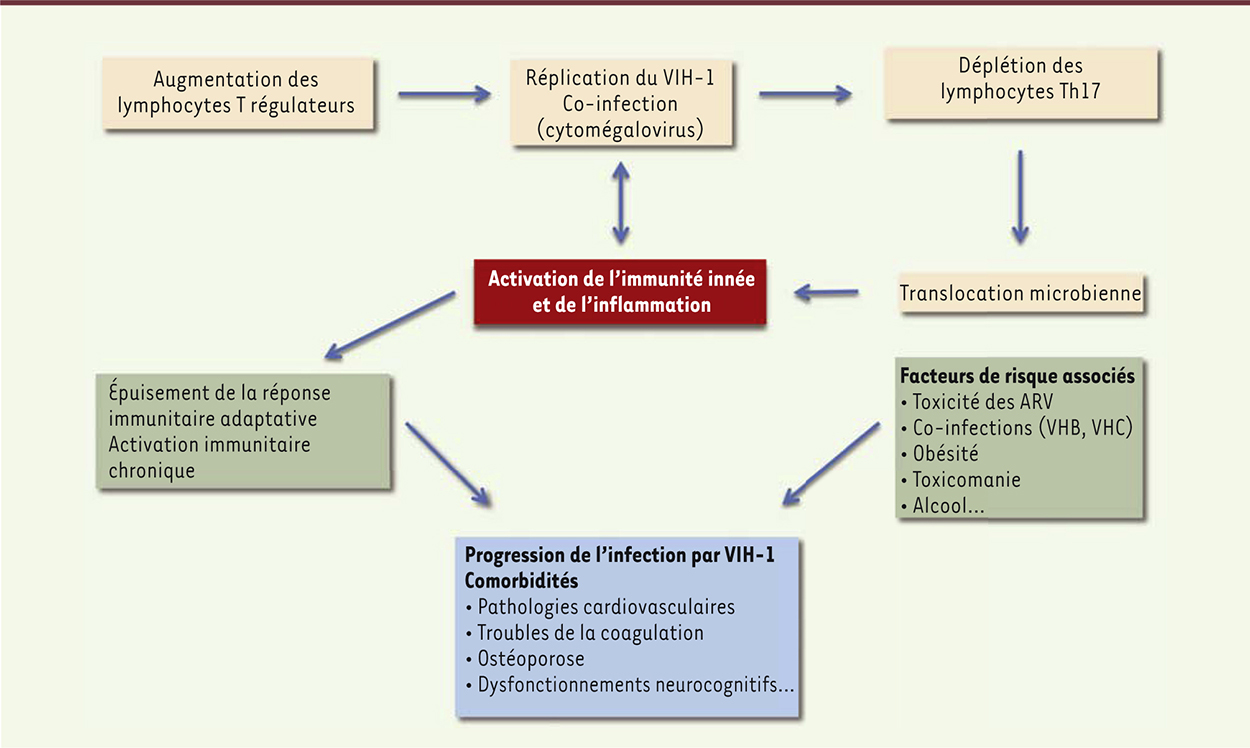
De la lymphopénie muqueuse digestive à l’hyperactivation immunitaire systémique L’altération de l’immunité digestive est un facteur important dans l’évolution de l’infection par le VIH-1. L’intensité de la réplication virale dans le GALT conduit, dès la phase aiguë de la maladie, à une déplétion massive et profonde de lymphocytes T CD4+ muqueux [7], plus marquée dans l’iléon que dans le rectum. En effet, le VIH-1 entraîne rapidement la mort des cellules infectées par lyse cellulaire ou apoptose, ou suite à une réponse immunitaire cytotoxique [3]. L’infection préférentielle des lymphocytes T du GALT est favorisée par l’expression à leur surface des intégrines α4β7 ou αEβ7 et du récepteur CCR9 [18], qui permettent l’adressage des lymphocytes du sang périphérique vers les sites inducteurs et effecteurs du GALT (Figure 2) [19]. Arthos et al. ont montré que la protéine d’enveloppe virale gp120 était capable de se fixer sur la forme activée de l’intégrine α4β7, facilitant ainsi l’infection lymphocytaire via l’activation d’une autre intégrine et la formation d’une synapse virologique [18]. L’intégrine α4β7 joue donc un rôle majeur dans l’infection virale et la déplétion des lymphocytes muqueux [20, 62] (→).
 | Figure 2. Réplication virale et altération de l’immunité muqueuse. Un véritable cercle vicieux au sein du GALT qui conduit à la progression de l’infection par le VIH-1. ARV : antirétroviraux ; VHB : virus de l’hépatite B ; VHC : virus de l’hépatite C. |
(→) Voir la Synthèse de A. Girard et al., m/s n° 10, octobre 2015, page 895
Les lymphocytes Th17 sont une sous-population de lymphocytes T CD4+ particulièrement impliqués dans l’immunité muqueuse. Ils sont à l’origine du recrutement, dans le GALT, des polynucléaires neutrophiles qui assurent la défense contre la microflore intestinale. Ils pallient également les dommages structuraux induits au niveau de l’intestin en stimulant la prolifération des entérocytes [21] et la production des protéines de jonctions serrées [22]. Ils se caractérisent par l’expression du récepteur CCR6 (C-C chemokine receptor type 6) et de l’intégrine α4β7, ce qui les rend sensibles à l’infection par le VIH [23]. Leur déplétion favorise le passage de bactéries digestives dans la muqueuse, stimulant ainsi en continu l’immunité innée et adaptative locale [24]. Il en résulte à la fois l’épuisement des fonctions phagocytaires des macrophages muqueux, et celui des lymphocytes T du GALT qui deviennent incapables de remplir leur fonction de cytotoxicité [24, 25]. L’inflammation locale produite conduit au recrutement de lymphocytes T régulateurs (Treg) qui, également, altèrent la qualité de la réponse antimicrobienne par leurs propriétés anti-inflammatoires et immunosuppressives [26]. Il se crée ainsi, au niveau de la muqueuse digestive, un déséquilibre entre populations lymphocytaires pro- et anti-inflammatoires. L’infection virale entraîne, en conséquence, des anomalies architecturales du tissu intestinal (perte des protéines de jonctions serrées entre entérocytes, fibrose), qui sont responsables d’une augmentation de la perméabilité muqueuse, d’une diminution de la résistance épithéliale et d’une désorganisation de la structure du tissu lymphoïde [27]. Ces altérations facilitent les translocations microbiennes de la lumière intestinale vers la circulation sanguine [21]. Ces stimulus microbiens, notamment les lipopolysaccharides (LPS) bactériens, activent les cellules de l’immunité innée systémique, en particulier par la voie des Toll like receptors (TLR) [24]. Il s’ensuit une sécrétion importante de facteurs pro-inflammatoires recrutant et activant les cellules de l’immunité adaptative, ce qui génère un état d’activation immunitaire chronique [24]. Cette hyperactivation immunitaire systémique conduit à une augmentation de la régénération des populations de lymphocytes T CD4+ et CD8+ et du nombre de lymphocytes T et B activés, qui représentent alors de nouvelles cibles potentielles pour le VIH-1 [3, 24]. Cela a pour conséquence d’accentuer la lymphopénie T CD4+ au stade chronique, le thymus étant devenu progressivement incapable de remplacer les lymphocytes T CD4+ infectés [3]. L’hyperactivation immunitaire favorise ainsi la progression de la maladie de même que le développement précoce de comorbidités non infectieuses, telles que les maladies cardio-vasculaires, l’ostéoporose, les cancers non liés au Sida (syndrome d’immunodéficience acquise) et les dysfonctionnements neurocognitifs [24]. Par exemple, l’implication de certains composés bactériens (LPS et endotoxines notamment), présents au niveau systémique après leur translocation, a été suggérée dans la genèse de l’athérome. Ces pathologies sont d’ailleurs plus fréquentes chez les patients infectés par le VIH traités au long cours que chez les personnes non infectées de même âge et de même sexe [24]. L’étude SMART (strategies for management of antiretroviral therapy) a montré, chez les patients sous TARV, qu’un taux élevé de sCD14 (le récepteur spécifique du LPS bactérien sous sa forme soluble), témoignant d’une importante activation monocytaire, était associé à un plus fort risque de décès [28]. En complément du TARV, la restauration de l’immunité cellulaire (en particulier des lymphocytes CD4+) et le contrôle du microbiote intestinal sont donc des objectifs importants à atteindre afin de réduire les causes de morbidités observées chez les personnes infectées par le VIH-1 [29]. |
Stratégies thérapeutiques ciblant le GALT Limiter la taille du réservoir viral Les recommandations françaises concernant la prise en charge des personnes infectées par le VIH-1 préconisent de débuter le traitement antiviral chez tout patient séropositif, quel que soit son taux de lymphocytes T CD4 + [ 30]. Ces recommandations s’appuient sur les résultats de plusieurs études qui ont montré une corrélation entre l’initiation précoce du traitement et une meilleure reconstitution en lymphocytes T CD4 + sanguins, ainsi qu’une réponse immunitaire antivirale plus efficace [ 30– 32]. Hocqueloux et al. ont également rapporté l’existence d’un réservoir viral sanguin moins important lorsque les patients étaient traités en primo-infection plutôt qu’en phase chronique [ 31]. Réduire la taille des réservoirs viraux est un premier pas vers l’éradication du virus, mais probablement aussi un prérequis à la « guérison fonctionnelle » qui correspond au contrôle de l’infection après l’arrêt du traitement antirétroviral. Cette notion est illustrée par l’exemple des post treatment controllers (PTC) de la cohorte ANRS EP 47 VISCONTI. Il s’agit de patients diagnostiqués au cours de leur primo-infection (dans les dix semaines suivant la contamination) et ayant commencé un TARV immédiatement après le diagnostic. Ce traitement a été poursuivi pendant trois ans en médiane, avant d’être arrêté par décision du patient lui-même. Depuis cet arrêt, les deux tiers de ces patients maintiennent une virémie indétectable depuis plus de 8 ans en moyenne. Ces patients présentent, au niveau sanguin, un réservoir viral ADN très peu important après l’interruption du TARV (soit environ 2 log 10 copies d’ADN VIH pour 10 6 cellules mononucléées sanguines [PBMC]) ainsi qu’une réponse lymphocytaire CD8 faible [ 33]. Les données concernant l’immunité muqueuse et le réservoir viral digestif sont beaucoup plus pauvres. Cependant, différents types d’interventions thérapeutiques ont déjà été envisagés pour réduire le réservoir viral digestif. La capacité de diffusion des antirétroviraux dans le tissu lymphoïde digestif est un paramètre important, mais il existe peu de données sur le sujet. A priori, des molécules comme le FTC (emtricitabine) et le ténofovir (inhibiteurs nucléos[t]idiques de la transcriptase inverse), le darunavir et le ritonavir (inhibiteurs de protéase), le raltégravir (inhibiteur d’intégrase) et le maraviroc (inhibiteur de co-récepteur) présentent une bonne pénétration dans le tissu colorectal [34]. Il existe néanmoins une grande hétérogénéité entre ces molécules en ce qui concerne leur séquestration par les protéines plasmatiques, leurs caractéristiques physico-chimiques et leur métabolisation intracellulaire [14, 35]. Le développement de nouvelles molécules ayant de meilleures propriétés d’absorption intestinale, de distribution tissulaire et une demi-vie allongée comme le ténofovir alafenamide (TAF), commencent à répondre au problème de sous-exposition du compartiment digestif au TARV [36]. Une autre option destinée à juguler la réplication virale dans le GALT est l’intensification thérapeutique (Tableau I). L’ajout de raltégravir au traitement aurait un intérêt possible, chez certains patients, pour diminuer l’intensité de la réplication virale et l’activation lymphocytaire muqueuse, mais pas le taux d’ADN total du VIH-1 au niveau du tissu [16]. Ananworanich et al. se sont intéressés à la fois à l’effet de l’intensification thérapeutique et à l’introduction précoce du TARV, dès la phase aiguë de l’infection. Dans cette étude, l’initiation, à la phase très précoce de l’infection, d’une pentathérapie, comprenant en particulier du raltégravir et du maraviroc, conduit à une réduction significative de la quantité d’ADN de VIH-1 au niveau du côlon sigmoïde [37].
Tableau I.
| Auteurs
[Références] |
Caractéristiques
des patients inclus |
Nombre de sujets inclus |
Schéma thérapeutique |
Site(s) du GALT étudié(s) |
Résultats principaux |
| Yukl et al. [16] |
Patients infectés par le VIH-1, contrôlés sous TARV (CV < 40 copies/ml depuis plus de 6 mois et lymphocytes T4 > 200/mm3) |
8 |
TARV + RAL (+/- IP ou INNTI pour 3 patients) pendant 12 semaines |
Duodénum iléon terminal, côlon droit et rectum (biopsies à J0 et semaine 12) |
Pas d’effet sur la quantité d’ADN du VIH dans l’iléon, le côlon et le rectum. Effet sur la réplication intracellulaire du VIH : diminution de l’ARN viral dans les lymphocytes T4 dans l’iléon terminal (baisse moyenne de -2 520 copies/106 lymphocytes T4) |
|
| Hatano et al. [55] |
Patients infectés par le VIH sous TARV, avec lymphocytes T4 < 350/mm3 depuis au moins 1 an malgré CV < 75 copies/ml depuis au moins 1 an |
30 (15 par bras) |
Bras placebo : TARV + placebo 24 semaines Bras RAL : TARV + RAL (400 mg 2 x/j) 24 semaines |
Rectum (biopsies 2 semaines avant RAL puis aux semaines 6 et 22) |
Absence d’effet du RAL aux semaines 6 et 22 sur la réponse cellulaire T spécifique du VIH au niveau rectal (sécrétion d’IFN-γ, TNF-α, IL-2 ou de CD107a) et sur la réplication virale |
|
| Chege et al. [56] |
Hommes infectés par le VIH sous TARV depuis au moins 4 ans avec CV < 50 copies/ml depuis au moins 4 ans. |
24 (12 par bras) |
Bras placebo : TARV + placebo 48 semaines Bras RAL : TARV + RAL 400 mg 2 x/j 48 semaines puis RAL pour tous jusqu’à la semaine 96 |
Sigmoïde (biopsies à J0, semaines 48 et 96) |
Semaine 48 : absence de différence significative entre les 2 bras pour l’ADN VIH total au niveau des biopsies à la semaine 96 ; bras RAL : absence de baisse significative du taux d’ADN-VIH total entre J0 et semaine 96 |
|
| Ananworanich et al. [37] |
Patients thaïlandais diagnostiqués en phase aiguë de l’infection par le VIH-1 (Fiebig stades I à IV)1
|
30 (15 par bras) |
Bras contrôle : 2 INTI+ INNTI 24 semaines Bras intensifié : 2 INTI + INNT + RAL + MVC 24 semaines |
Sigmoïde (biopsies à J0 et semaine 24) |
Semaine 24 : décroissance du taux d’ADN-VIH total à la semaine 24 de pentathérapie (de 319 à 39 copies pour106 cellules) |
Principales publications consacrées à l’étude de l’impact de l’intensification thérapeutique sur la taille du réservoir digestif du VIH. CV : charge virale ; TARV : traitement antirétroviral ; RAL : raltégravir (inhibiteur d’intégrase) ; IP : inhibiteur de protéase ; INNTI : inhibiteur non nucléosidique de la transcriptase inverse ; INTI : inhibiteur nucléos(t)idique de la transcriptase inverse ; MVC : maraviroc (inhibiteur du co-récepteur CCR5). |
L’impact de l’initiation précoce du TARV sur la taille du réservoir viral digestif a fait l’objet de plusieurs autres études chez l’homme (Tableau II). Ces essais concluent majoritairement à une élimination plus rapide et plus soutenue de l’ADN viral [38–40], voire à l’arrêt de la réplication virale [41] dans le GALT, lorsque la trithérapie est initiée en primo-infection. Buzon et al. ont ainsi récemment montré que, chez les patients traités dès les 6 premiers mois de l’infection, la clairance du réservoir viral sanguin était plus importante que chez les patients traités tardivement (plus de 2 ans après le début de l’infection) [42]. Initier le TARV en primo-infection semble avoir un impact sur la distribution du virus dans les sous-types de cellules mémoires T4 dont les demi-vies sont différentes [42]. Chez les PTC (post treatment controllers), le réservoir viral sanguin est constitué principalement de cellules mémoires transitionnelles au détriment des cellules mémoires centrales à demi-vie plus longue. Ainsi, leur réservoir viral décroît plus rapidement que chez les patients traités tardivement [11]. L’influence du traitement précoce sur la distribution cellulaire du virus dans le GALT reste à explorer. Cependant, par analogie avec des études similaires portant sur les cellules sanguines périphériques (PBMC), on peut envisager que cela restreindrait encore le pool de cellules mémoires centrales infectées.
Tableau II.
| Auteurs [Références] |
Caractéristiques des sujets inclus |
Nombre de sujets inclus |
Initiation du TARV |
Site(s) étudié(s) |
Principaux résultats |
|
PHI : infectés depuis 4 à 6 semaines |
3 |
Introduction du TARV chez PHI et |
Jéjunum |
ARN VIH indétectable dans le GALT dès le mois 6 pour les PHI, suppression virale incomplète pour les CHI au mois 30 |
| Guadalupe et al. [38] |
CHI : infectés depuis plus d’un an, non traités |
5 |
CHI puis prélèvements itératifs avec suivi de 36 mois |
(biopsies avant TARV puis 2 à 4 prélèvements entre le 4e et le 30e mois) |
|
|
CHI « contrôles » : traités depuis 5 à 6 ans avec CV indétectable |
2 |
|
|
Déplétion sévère en lymphocytes T4 digestifs pour les 2 groupes à J0, sans amélioration significative après 1 an de TARV |
|
| Tincati et al. [39] |
PHI symptomatiques |
9 |
En phase de primo-infection (6 mois de suivi) |
Recto-sigmoïde (biopsies à J0 et à 6 mois sous TARV) |
Mois 6 : absence de diminution significative de l’ADN-VIH dans le GALT |
|
| Koelsch et al. [40] |
PHI : au stade d’infection aiguë ou précoce |
8 |
Initiation du TARV (2 INTI + RAL) dans les 2 groupes, pendant 52 semaines |
Côlon gauche |
J0 : ADN-VIH dans le GALT comparable entre les 2 groupes |
|
CHI : infectés depuis 12 mois minimum, non traités |
8 |
|
(biopsies J0 et semaine 52) |
Semaine 52 : baisse significative du taux d’ADN-VIH dans les biopsies pour les 2 groupes (PHI et CHI) |
|
| Evering et al. [41] |
Patients en phase aiguë ou précoce de l’infection par le VIH |
3 |
Initiation du TARV en phase aiguë ou précoce de l’infection, suivi 15 à 25 mois |
Recto-sigmoïde (biopsies à J0, puis après 15 à 25 mois de TARV selon les patients) |
Séquences génétiques du gène env conservées entre J0 et 2 ans de TARV : absence de réplication virale sous thérapie |
Principales publications consacrées à l’étude de l’impact de l’initiation précoce d’un traitement antirétroviral sur la taille du réservoir digestif du VIH. CV : charge virale ; TARV : traitement antirétroviral ; PHI : patients en phase précoce de l’infection par VIH ; CHI : patients infectés chroniques par VIH. |
Restaurer le taux de lymphocytes T4 Les études réalisées chez les patients dits « contrôleurs », qui maintiennent une charge virale plasmatique très faible en l’absence de TARV, apportent d’autres pistes de réflexion pour limiter le réservoir viral digestif [ 43]. La taille du réservoir viral digestif de ces patients est significativement moins importante et elle est associée à une réponse immune muqueuse plus conservée grâce à une forte proportion de lymphocytes T4 et T8 fonctionnels [ 44, 45]. La correction de la déplétion en lymphocytes T4 dans le GALT, aurait donc un impact majeur sur la qualité de l’immunité muqueuse au cours de l’infection par le VIH-1. La question de la capacité du TARV à restaurer une immunité compétente dans le GALT a fait l’objet d’une revue très complète réalisée par Costiniuk et Angel [27]. Le TARV est partiellement efficace sur la reconstitution en lymphocytes T4, la normalisation de la production d’immunoglobulines et la composition en lymphocytes T8, Treg et Th17 et en cellules NK. Le traitement améliore également la qualité de la barrière intestinale, réduisant ainsi la translocation microbienne et l’activation lymphocytaire. Certaines anomalies secondaires à l’infection par le VIH-1, telles que la fibrose du GALT, persistent malgré un traitement prolongé [27]. Cette accumulation de collagène dans la zone T des follicules lymphoïdes muqueux (où sont localisés les lymphocytes T) perturbe la survie et la prolifération des lymphocytes T en diminuant leur exposition aux cytokines comme l’interleukine 7 (IL-7) [46]. Initier précocement le TARV présente l’avantage d’agir avant que les dommages architecturaux et immunitaires ainsi induits soient trop importants. Kök et al. ont montré récemment que l’instauration du traitement, dans les quatre mois suivant le diagnostic de la primo-infection, préservait la dégradation de la barrière épithéliale et des structures lymphoïdes intestinales [47]. Dans la majorité des études, le traitement précoce conduit également à une reconstitution plus importante en lymphocytes T4 muqueux. Le taux de ces cellules reste néanmoins inférieur à celui observé chez les patients séronégatifs, malgré cette prise en charge rapide [27]. D’autres pistes thérapeutiques sont actuellement en cours de développement pour améliorer la reconstitution immunitaire. L’IL-7 stimule la prolifération des lymphocytes T naïfs et mémoires et permet leur adressage vers la muqueuse digestive via l’activation de l’intégrine α4β7 [48]. Les traitements anti-fibrosants représentent également une option thérapeutique intéressante pour parer aux dommages architecturaux consécutifs à l’infection et donc à la déplétion lymphocytaire. Cela a été montré par exemple pour la pirfenidone chez des macaques rhésus infectés par le VIS (virus de l’immunodéficience simienne [en anglais SIV, simian immunodeficiency virus]), équivalent du VIH chez le singe [49]. L’intérêt d’autres molécules anti-fibrosantes comme la décorine, l’adalimumab, les antagonistes du récepteur de l’angiotensine, l’imatinib et autres inhibiteurs de tyrosine kinase, reste encore à préciser. Améliorer la réponse immunitaire muqueuse Les vaccins thérapeutiques pourraient parer à la dégradation de l’immunité muqueuse en augmentant la réponse immunitaire cytotoxique spécifique. Une étude d’immunisation de macaques rhésus, chroniquement infectés par le VIS et recevant un TARV, par un vaccin thérapeutique associant de l’ADN du VIS et un adjuvant à activité muqueuse (entérotoxine d’ Escherichia coli), a permis d’augmenter significativement la réponse lymphocytaire T4 et T8 anti-VIS et la production de TNF-α dans le GALT des animaux traités [ 50]. Trois semaines après l’arrêt du traitement, les singes vaccinés avaient une production virale, dans les ganglions périphériques et la lamina propria, significativement plus faible que les macaques non traités [ 50]. Le blocage du récepteur PD-1 ( programmed death receptor-1), surexprimé par les lymphocytes T en situation d’épuisement, est également une piste intéressante : l’utilisation d’anticorps anti-PD-1 chez les macaques rhésus infectés chroniquement par le VIS entraîne, en effet, une diminution de la translocation microbienne et augmente la survie des animaux, indépendamment de la charge virale et du taux plasmatique de lymphocytes T4 [ 51]. Limiter la translocation microbienne est une autre façon de lutter contre l’épuisement de l’immunité muqueuse et contre l’hyperactivation immunitaire systémique. Dans cette optique, plusieurs stratégies sont en cours d’évaluation (Tableau III). La barrière mécanique constituée par la paroi digestive est le premier rempart contre la translocation microbienne. Certaines molécules améliorent l’intégrité de cette barrière, comme la glutamine, via un effet anti-apoptotique sur les entérocytes, ou encore l’IL-17 et l’IL-22 qui stimulent la prolifération de ces cellules [24]. Par ailleurs, plusieurs études ont montré que, chez les patients infectés par le VIH, la microflore digestive était perturbée très précocement, avec une surreprésentation de bactéries « pro-inflammatoires » et de pathogènes opportunistes (Pseudomonas aeruginosa, Candida albicans) au détriment de bactéries « anti-inflammatoires » comme les bifidobactéries et les lactobacilles [24]. Les probiotiques, prébiotiques et symbiotiques3, sont des compléments alimentaires pouvant contribuer au rétablissement d’une microflore intestinale normale, à une diminution de la translocation microbienne et de l’activation immunitaire systémique, ainsi qu’à une meilleure reconstitution des lymphocytes T4 au niveau systémique et dans le GALT [24, 52]. La translocation peut également être diminuée grâce à des substances capables de réduire la charge microbienne dans la lumière digestive comme la rifaximine, un antibiotique à large spectre [2]. D’autres molécules ont la capacité de se fixer, dans la lumière digestive, aux endotoxines bactériennes et de les neutraliser avant leur translocation, comme le lactulose, le carbonate de sévélamer4 qui régule la phosphorémie [53], ou encore des immunoglobulines isolées de sérum bovin [54]. L’association de ces stratégies thérapeutiques pourrait permettre d’améliorer à la fois la qualité de la réponse antimicrobienne et la capacité de contrôler la réplication virale [29].
Tableau III.
| Stratégie |
Type de traitement évalué |
Mode d’action |
Principaux résultats |
|
IL-17/IL-22 |
Stimulation de la prolifération des entérocytes |
Réduction de l’inflammation intestinale sous IL-22 dans la rectocolite hémorragique [24] |
| Augmentation de l’intégrité de la barrière intestinale |
N-acétylcystéine |
Anti-oxydant |
Diminution de l’activation et de l’apoptose des lymphocytes T CD4 in vitro en association avec la vitamine C [57] |
|
Glutamine |
Inhibition de l’apoptose des entérocytes |
Amélioration de l’intégrité de la muqueuse et de l’absorption intestinale [58] |
|
Peptide « glucagon-like » |
Modification de la perméabilité intestinale |
Augmentation des protéines de jonction serrée entre entérocytes chez la souris [59] |
|
|
Probiotiques (ex : Lactobacillus rhamnosus, L. reuteri, L. paracasei, Bifidobacterium lactis) |
Compléments alimentaires microbiens qui stimulent la sécrétion d’IgA polymériques dans la lumière digestive et préviennent la pullulation de bactéries pathogènes |
Amélioration de la composition du microbiote digestif avec augmentation du taux de bactéries bénéfiques (bifidobactéries) [65] ; inhibition de la colonisation de la muqueuse digestive par des bactéries pathogènes [60] |
| Restauration d’une flore digestive normale |
Prébiotiques (ex : inuline, pectine, bêta-glucane) |
Oligosaccharides non digérables qui stimulent sélectivement la croissance de bactéries « protectrices » |
Amélioration de la composition du microbiote digestif (augmentation des bifidobactéries, baisse des bactéries pathogènes), diminution de l’activation immunitaire systémique [52] |
|
Symbiotiques |
Prébiotiques + probiotiques |
Diminution de la translocation microbienne et de la charge bactérienne totale dans la lumière digestive, amélioration de la reconstitution en lymphocytes T CD4 sanguins [52] ; amélioration de l’immunité muqueuse chez le macaque [24] |
|
|
Rifaximine |
Diminution de la charge bactérienne digestive |
Diminution de l’activation immunitaire et de l’inflammation systémique chez le macaque [24] |
| Diminution de la charge digestive microbienne et en endotoxines |
Immunoglobulines de sérum bovin |
Neutralisation du LPS et autres antigènes bactériens dans la lumière digestive |
Amélioration des signes cliniques d’entéropathie à VIH et amélioration de l’absorption duodénale [54] |
|
Carbonate de sevelamer |
Fixation au complexe LPS-chylomicron empêchant sa réabsorption intestinale |
Diminution du facteur tissulaire et du LDL-cholestérol, efficacité sur la translocation microbienne minime [53] |
Stratégies de lutte contre la translocation microbienne et l’hyperactivation immunitaire muqueuse.
|
|
Le GALT joue un rôle central dans l’infection par le VIH. Il est à la fois un réservoir majeur du virus et un moteur de progression de la maladie. Il est la cible de nombreuses stratégies thérapeutiques ayant pour objectif l’obtention d’une guérison complète. Les techniques d’éradication du virus, grâce à la réactivation des formes virales latentes par les inhibiteurs des histone-déacétylases ou les activateurs de la protéine kinase C, sont en cours d’évaluation chez l’homme [50]. Dans l’intervalle, il est certain qu’une guérison fonctionnelle nécessitera de réduire au maximum le réservoir viral digestif. C’est en combinant les interventions visant la restauration de l’immunité muqueuse et la mise en place précoce d’un TARV performant que cet objectif pourra être atteint. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Clayton F, Snow G, Reka S, Kotler DP. Selective depletion of rectal lamina propria rather than lymphoid aggregate CD4 lymphocytes in HIV infection . Clin Exp Immunol. 1997;; 107 : :288.–292. 2.
Sáez-Cirión A, Bacchus C, Hocqueloux L, et al. Post-treatment HIV-1 controllers with a long-term virological remission after the interruption of early initiated antiretroviral therapy Anrs Visconti study . PLoS Pathog. 2013; ; 9 : :e1003211.. 3.
Brenchley JM, Price DA, Douek DC. HIV disease: fallout from a mucosal catastrophe? Nat Immunol. 2006; ; 7 : :235.–239. 4.
Cerf-Bensussan N, Guy-Grand D. Intestinal intraepithelial lymphocytes . Gastroenterol Clin North Am. 1991; ; 20 : :549.–576. 5.
Brenchley JM, Schacker TW, Ruff LE, et al. CD4+ T cell depletion during all stages of HIV disease occurs predominantly in the gastrointestinal tract . J Exp Med. 2004; ; 200 : :749.–759. 6.
Yukl SA, Shergill A, Ho T, et al. The distribution of HIV DNA and RNA in cell subsets differs in gut and blood of HIV+ patients on ART: implications for viral persistence . J Infect Dis. 2013; ; 208 : :1212.–1220. 7.
Guadalupe M, Reay E, Sankaran S, et al. Severe CD4+ T-cell depletion in gut lymphoid tissue during primary human immunodeficiency virus type 1 infection and substantial delay in restoration following highly active antiretroviral therapy . J Virol. 2003; ; 77 : :11708.–11717. 8.
Chun TW, Nickle DC, Justement JS, et al. Persistence of HIV in gut-associated lymphoid tissue despite long-term antiretroviral therapy . J Infect Dis. 2008; ; 197 : :714.–720. 9.
Yukl S, Gianella S, Sinclair E, et al. Differences in HIV burden and immune activation within the gut of HIV+ patients on suppressive antiretroviral therapy . J Infect Dis. 2010; ; 202 : :1553.–1561. 10.
Lewin SR, Rouzioux C. HIV cure and eradication: how will we get from the laboratory to effective clinical trials? AIDS. 2011; ; 25 : :885.–897. 11.
Chomont N, El-Far M, Ancuta P, et al. HIV reservoir size and persistence are driven by T cell survival and homeostatic proliferation . Nat Med. 2009; ; 15 : :893.–900. 12.
Katlama C, Deeks SG, Autran B, et al. Barriers to a cure for HIV: new ways to target and eradicate HIV-1 reservoirs . Lancet. 2013; ; 381 : :2109.–2117. 13.
Rouzioux C, Richman D. How to best measure HIV reservoirs? Curr Opin HIV AIDS. 2013; ; 8 : :170.–175. 14.
Fletcher CV, Staskus K, Wietgrefe SW, et al. Persistent HIV-1 replication is associated with lower antiretroviral drug concentrations in lymphatic tissues . Proc Natl Acad Sci USA. 2014; ; 111 : :2307.–2312. 15.
Poles MA, Boscardin WJ, Elliott J, et al. Lack of decay of HIV-1 in gut-associated lymphoid tissue reservoirs in maximally suppressed individuals . J Acquir Immune Defic Syndr. 2006; ; 43 : :65.–68. 16.
Yukl SA, Shergill AK, McQuaid K, et al. Effect of raltegravir-containing intensification on HIV burden and T-cell activation in multiple gut sites of HIV-positive adults on suppressive antiretroviral therapy . AIDS. 2010; ; 24 : :2451.–2460. 17.
Josefsson L, von Stockenstrom S, Faria NR, et al. The HIV-1 reservoir in eight patients on long-term suppressive antiretroviral therapy is stable with few genetic changes over time . Proc Natl Acad Sci USA. 2013; ; 110 : :E4987.–E4996. 18.
Arthos J, Cicala C, Martinelli E, et al. HIV-1 envelope protein binds to and signals through integrin α4β7, the gut mucosal homing receptor for peripheral T cells . Nat Immunol. 2008; ; 9 : :301.–309. 19.
Gorfu G, Rivera-Nieves J, Ley K. Role of beta7 integrins in intestinal lymphocyte homing and retention . Curr Mol Med. 2009; ; 9 : :836.–850. 20.
Anjuère F, Czerkinsky C. Immunité muqueuse et vaccination . Med Sci (Paris). 2007; ; 23 : :371.–378. 21.
Hunt PW. Th17, gut, and HIV: therapeutic implications . Curr Opin HIV AIDS. 2010; ; 5 : :189.–193. 22.
Dandekar S, George MD, Bäumler AJ. Th17 cells, HIV and the gut mucosal barrier . Curr Opin HIV AIDS. 2010; ; 5 : :173.–178. 23.
Gosselin A, Monteiro P, Chomont N, et al. Peripheral blood CCR4+CCR6+ and CXCR3+CCR6+CD4+ T cells are highly permissive to HIV-1 infection . J Immunol. 2010; ; 184 : :1604.–1616. 24.
Marchetti G, Tincati C, Silvestri G. Microbial translocation in the pathogenesis of HIV infection and AIDS . Clin Microbiol Rev. 2013; ; 26 : :2.–18. 25.
Rueda CM, Velilla PA, Chougnet CA, et al. HIV-induced T-cell activation/exhaustion in rectal mucosa is controlled only partially by antiretroviral treatment . PloS One. 2012; ; 7 : :e30307.. 26.
Shaw JM, Hunt PW, Critchfield JW, et al. Increased frequency of regulatory T cells accompanies increased immune activation in rectal mucosae of HIV-positive noncontrollers . J Virol. 2011; ; 85 : :11422.–11434. 27.
Costiniuk CT, Angel JB. Human immunodeficiency virus and the gastrointestinal immune system: does highly active antiretroviral therapy restore gut immunity? Mucosal Immunol. 2012; ; 5 : :596.–604. 28.
Sandler NG, Douek DC. Microbial translocation in HIV infection: causes, consequences and treatment opportunities . Nat Rev Microbiol. 2012; ; 10 : :655.–666. 29.
Deeks SG, Tracy R, Douek DC. Systemic effects of inflammation on health during chronic HIV Infection . Immunity. 2013; ; 39 : :633.–645. 30.
Morlat P (dir). Prise en charge médicale des personnes vivant avec le VIH-Recommandations du groupe d’experts . Rapport 2013 sous la direction du Pr Philippe Morlat et sous l’égide du CNS et de l’ANRS.. Paris: : La Documentation Française; , 2013. 31.
Hocqueloux L, Avettand-Fènoël V, Jacquot S, et al. Long-term antiretroviral therapy initiated during primary HIV-1 infection is key to achieving both low HIV reservoirs and normal T cell counts . J Antimicrob Chemother. 2013; ; 68 : :1169.–1178. 32.
Cellerai C, Harari A, Stauss H, et al. Early and prolonged antiretroviral therapy is associated with an HIV-1-specific T-cell profile comparable to that of long-term non-progressors . PloS One. 2011; ; 6 : :e18164.. 33.
Hocqueloux L, Prazuck T, Avettand-Fenoel V, et al. Long-term immunovirologic control following antiretroviral therapy interruption in patients treated at the time of primary HIV-1 infection . AIDS Lond Engl. 2010; ; 24 : :1598.–1601. 34.
Thompson CG, Cohen MS, Kashuba A. Antiretroviral pharmacology in mucosal tissues . J Acquir Immune Defic Syndr. 2013; ; 63 : :S240.–S247. 35.
Nicol MR, Kashuba ADM. Pharmacologic opportunities for HIV prevention . Clin Pharmacol Ther. 2010; ; 88 : :598.–609. 36.
Cory TJ, Schacker TW, Stevenson M, Fletcher CV. Overcoming pharmacologic sanctuaries . Curr Opin HIV AIDS. 2013; ; 8 : :190.–195. 37.
Ananworanich J, Schuetz A, Vandergeeten C, et al. Impact of multi-targeted antiretroviral treatment on gut T cell depletion and HIV reservoir seeding during acute HIV infection . PLoS One. 2012; ; 7 : :e33948.. 38.
Guadalupe M, Sankaran S, George MD, et al. Viral suppression and immune restoration in the gastrointestinal mucosa of human immunodeficiency virus type 1-infected patients initiating therapy during primary or chronic infection . J Virol. 2006; ; 80 : :8236.–8247. 39.
Tincati C, Biasin M, Bandera A, et al. Early initiation of highly active antiretroviral therapy fails to reverse immunovirological abnormalities in gut-associated lymphoid tissue induced by acute HIV infection . Antivir Ther. 2009; ; 14 : :321.–330. 40.
Koelsch KK, Boesecke C, McBride K, et al. Impact of treatment with raltegravir during primary or chronic HIV infection on RNA decay characteristics and the HIV viral reservoir . AIDS Lond Engl. 2011; ; 25 : :2069.–2078. 41.
Evering TH, Mehandru S, Racz P, et al. Absence of HIV-1 evolution in the gut-associated lymphoid tissue from patients on combination antiviral therapy initiated during primary infection . PLoS Pathog. 2012; ; 8 : :e1002506.. 42.
Buzon MJ, Martin-Gayo E, Pereyra F, et al. Long-term antiretroviral treatment initiated in primary HIV-1 infection affects the size, composition and decay kinetics of the reservoir of HIV-1 infected CD4 T cells . J Virol. 2014; ; 88 : :10056.–10065. 43.
Martinez V, Autran B. Les HIV controllers : une nouvelle entité évolutive de l’infection par le VIH ? Med Sci (Paris). 2008; ; 24 : :7.–9. 44.
Hatano H, Somsouk M, Sinclair E, et al. Comparison of HIV DNA and RNA in gut-associated lymphoid tissue of HIV-infected controllers and noncontrollers . AIDS Lond Engl. 2013; ; 27 : :2255.–2260. 45.
Shacklett BL, Ferre AL. Mucosal immunity in HIV controllers: the right place at the right time . Curr Opin HIV AIDS. 2011; ; 6 : :202.–207. 46.
Zeng M, Haase AT, Schacker TW. Lymphoid tissue structure and HIV-1 infection: life or death for T cells . Trends Immunol. 2012; ; 33 : :306.–314. 47.
Kök A, Hocqueloux L, Hocini H, et al. Early initiation of combined antiretroviral therapy preserves immune function in the gut of HIV-infected patients . Mucosal Immunol. 2014; ; 8 : :127.–140. 48.
Sereti I, Estes JD, Thompson WL, et al. Decreases in colonic and systemic inflammation in chronic HIV infection after IL-7 administration . PLoS Pathog. 2014; ; 10 : :e1003890.. 49.
Estes JD, Reilly C, Trubey CM, et al. Antifibrotic therapy in SIV infection preserves CD4 T cell populations and improves immune reconstitution with antiretroviral therapy . J Infect Dis. 2015; ; 211 : :744.–754. 50.
Fuller DH, Rajakumar P, Che JW, et al. Therapeutic DNA vaccine induces broad T cell responses in the gut and sustained protection from viral rebound and AIDS in SIV-infected rhesus macaques . PLoS One. 2012; ; 7 : :e33715.. 51.
Dyavar Shetty R, Velu V, Titanji K, et al. PD-1 blockade during chronic SIV infection reduces hyperimmune activation and microbial translocation in rhesus macaques . J Clin Invest. 2012;; 122 : :1712.–1716. 52.
Gori A, Rizzardini G, Van’t Land B, et al. Specific prebiotics modulate gut microbiota and immune activation in HAART-naive HIV-infected adults: results of the COPA pilot randomized trial . Mucosal Immunol. 2011; ; 4 : :554.–563. 53.
Sandler NG, Zhang X, Bosch RJ, et al. Sevelamer does not decrease lipopolysaccharide or soluble CD14 levels but decreases soluble tissue factor, low-density lipoprotein (LDL) cholesterol, and oxidized LDL cholesterol levels in individuals with untreated HIV infection . J Infect Dis. 2014; ; 210 : :1549.–1554. 54.
Asmuth DM, Ma ZM, Albanese A, et al. Oral serum-derived bovine immunoglobulin improves duodenal immune reconstitution and absorption function in patients with HIV enteropathy . AIDS. 2013; ; 27 : :2207.–2217. 55.
Hatano H, Hayes TL, Dahl V, et al. A randomized, controlled trial of raltegravir intensification in antiretroviral-treated, HIV-infected patients with a suboptimal CD4+ T cell response . J Infect Dis. 2011; ; 203 : :960.–968. 56.
Chege D, Kovacs C, la Porte C, et al. Effect of raltegravir intensification on HIV proviral DNA in the blood and gut mucosa of men on long-term therapy: a randomized controlled trial . AIDS. 2012; ; 26 : :167.–174. 57.
Assimakopoulos SF, Dimitropoulou D, Marangos M, Gogos CA. Intestinal barrier dysfunction in HIV infection: pathophysiology, clinical implications and potential therapies . Infection. 2014; ; 42 : :951.–959. 58.
Leite RD, Lima NL, Leite CAC, et al. Improvement of intestinal permeability with alanyl-glutamine in HIV patients: a randomized, double blinded, placebo-controlled clinical trial . Arq Gastroenterol. 2013; ; 50 : :56.–63. 59.
Sinha B, Rubens M. Systemic immune activation in HIV and potential therapeutic options . Immunopharmacol Immunotoxicol. 2014; ; 36 : :89.–95. 60.
González-Hernández LA, Jave-Suarez LF, Fafutis-Morris M, et al. Synbiotic therapy decreases microbial translocation and inflammation and improves immunological status in HIV-infected patients: a double-blind randomized controlled pilot trial . Nutr J. 2012; ; 11 : :90.. 61.
Vivier E, Spits H, Cupedo T. Interleukin-22-producing innate immune cells: new players in mucosal immunity and tissue repair? Nat Rev Immunol. 2009; ; 9 : :229.–234. 62.
Girard A, Roblin X, Genin C, Paul S. Rôle et ciblage de l’intégrine a4b7 dans la physiopathologie des MICI et de l’infection par le VIH . Med Sci (Paris). 2015; ; 31 : :895.–903. |