| |
| Med Sci (Paris). 2015 December; 31(12): 1080–1082. Published online 2015 December 16. doi: 10.1051/medsci/20153112004.Les macrophages Nouveaux modulateurs de la répartition de la masse grasse au cours de l’obésité Élise Dalmas1 and Nicolas Venteclef2* 1Département d’endocrinologie, diabète et métabolisme, centre hospitalier de l’université de Bâle, département de biomédecine, université de Bâle, CH-4031Bâle, Suisse 2Inserm, UMR S 113, Sorbonne Universités, UPMC Paris 6, université Paris Descartes, Sorbonne Paris Cité, centre de recherche des Cordeliers, 15, rue de l’École de Médecine, F-75006Paris, France MeSH keywords: Tissu adipeux, Animaux, Humains, Inflammation, Facteurs de régulation d'interféron, Macrophages, Obésité, cytologie, anatomopathologie, étiologie, physiologie |
L’obésité et ses complications, telles que le diabète de type 2 ou l’athérosclérose, sont aujourd’hui reconnues comme des états inflammatoires chroniques de bas bruit, c’est-à-dire évoluant de manière relativement silencieuse (sans symptômes). Le tissu adipeux, principal lieu de stockage de l’excès d’apports caloriques, est au cœur de cette activité inflammatoire due à une production accrue de facteurs délétères de type cytokines et chimiokines [1]. En 2003, deux équipes américaines ont décrit pour la première fois l’infiltration de cellules immunitaires, les macrophages, dans le tissu adipeux de souris obèses et chez l’homme. Cette infiltration de macrophages semble être proportionnelle à l’indice de masse corporelle chez les sujets en surpoids et obèses [2, 3]. Ces macrophages, s’accumulant typiquement autour d’adipocytes hypertrophiques, sont considérés comme la source majeure de production de facteurs pro-inflammatoires tels que le TNF-α (tumor necrosis factor-alpha) ou l’interleukine(IL)-1β. La production d’IL-1β favoriserait le maintien d’un dialogue pro-inflammatoire et prodiabétogène avec des lymphocytes T helper de type 17 (Th17) au sein du tissu adipeux viscéral de patients obèses [4]. Ainsi, en plus de leur accumulation, les macrophages orchestreraient un dialogue entre les différentes cellules immunitaires du tissu adipeux, déterminant dans le développement de l’obésité et du diabète de type 2. |
Les macrophages du tissu adipeux sont au cœur d’une inflammation prodiabétogène Dans les modèles murins, l’abondance des macrophages dans le tissu adipeux peut être contrôlée par des manipulations génétiques ou des interventions pharmacologiques. Ces approches permettent de démontrer l’importance de ces cellules dans le développement des complications liées à l’obésité [1]. Chez l’homme, la présence de macrophages et la sécrétion de cytokines pro-inflammatoires semblent également associées à l’obésité et au diabète de type 2 [1, 4]. Ces études restent cependant corrélatives. Sur le plan clinique, l’inflammation et la présence de macrophages sont particulièrement observées dans le tissu adipeux viscéral (intra-abdominal) et, de manière moins importante, dans la graisse sous-cutanée dite superficielle. L’élargissement du tissu adipeux viscéral (phénomène qualifié d’obésité androïde) est fortement associé à un risque élevé de développer un syndrome métabolique et des complications cardiovasculaires [5]. Au contraire, l’obésité gynoïde (accumulation préférentielle de la graisse dans les régions superficielles) est associée à un meilleur profil métabolique. Au cours de nos travaux, nous avons examiné le rôle possible des macrophages dans le développement soit de l’obésité gynoïde (protectrice), soit de l’obésité androïde (délétère). Il existe de nombreux niveaux d’activation des macrophages dans les pathologies. Une nomenclature restrictive permet cependant de distinguer deux grandes classes de macrophages inflammatoires dites polarisations1, M1 et M2 : (1) les macrophages dits M1, activés en particulier par le lipopolysaccharide2 (LPS) via les récepteurs TLR (toll like receptors), suivent une voie classique aboutissant à la production de cytokines pro-inflammatoires dans le but primaire d’éliminer les pathogènes de l’organisme ; (2) les macrophages M2 se polarisent suivant une voie alternative d’activation via l’IL(interleukine)-4 et l’IL-13, et produisent des facteurs anti-inflammatoires tels que l’IL-10 et le TGF-β (transforming growth factor) pour promouvoir l’angiogenèse et la réparation tissulaire [6]. Il a longtemps été admis que le tissu adipeux de souris, ou de sujets obèses, est infiltré par des macrophages pro-inflammatoires de type M1. Au contraire, des macrophages résidents anti-inflammatoires, de type M2, sont retrouvés dans le tissu adipeux de sujets sains et minces [1]. Une étude récente propose cependant que les macrophages du tissu adipeux ont un phénotype hétérogène, sécrétant des cytokines pro-inflammatoires de type M1, mais comprenant des marqueurs membranaires plutôt de type M2 [7]. Ces macrophages présentent un phénotype qualifié de « métabolique » résultant d’une exposition à l’association de trois facteurs, l’insuline, un niveau élevé de glucose et un niveau élevé d’acide gras palmitate, qui sont directement impliqués dans le développement de la résistance à l’insuline. Ce phénotype métabolique des macrophages est notamment orchestré par l’activation des facteurs de transcription essentiels à la polarisation M2, tels que PPAR-g (peroxisome proliferator-activated receptor-g) et KLF4 (kruppel-like factor 4), limitant ainsi une activité inflammatoire incontrôlée des macrophages. L’absence de macrophages M2 est associée à un risque accru de développer une obésité, une résistance à l’insuline et une intolérance au glucose sous un régime gras [8, 9]. Au contraire, la surabondance de macrophages M2, qui peut être obtenue à la suite d’une infestation par des vers parasites d’helminthes3, est associée à une nette amélioration de la résistance à l’insuline chez des souris obèses [10, 11]. Le maintien d’une polarisation des macrophages M2 pourrait ainsi limiter le développement de la résistance à l’insuline et du diabète de type 2. |
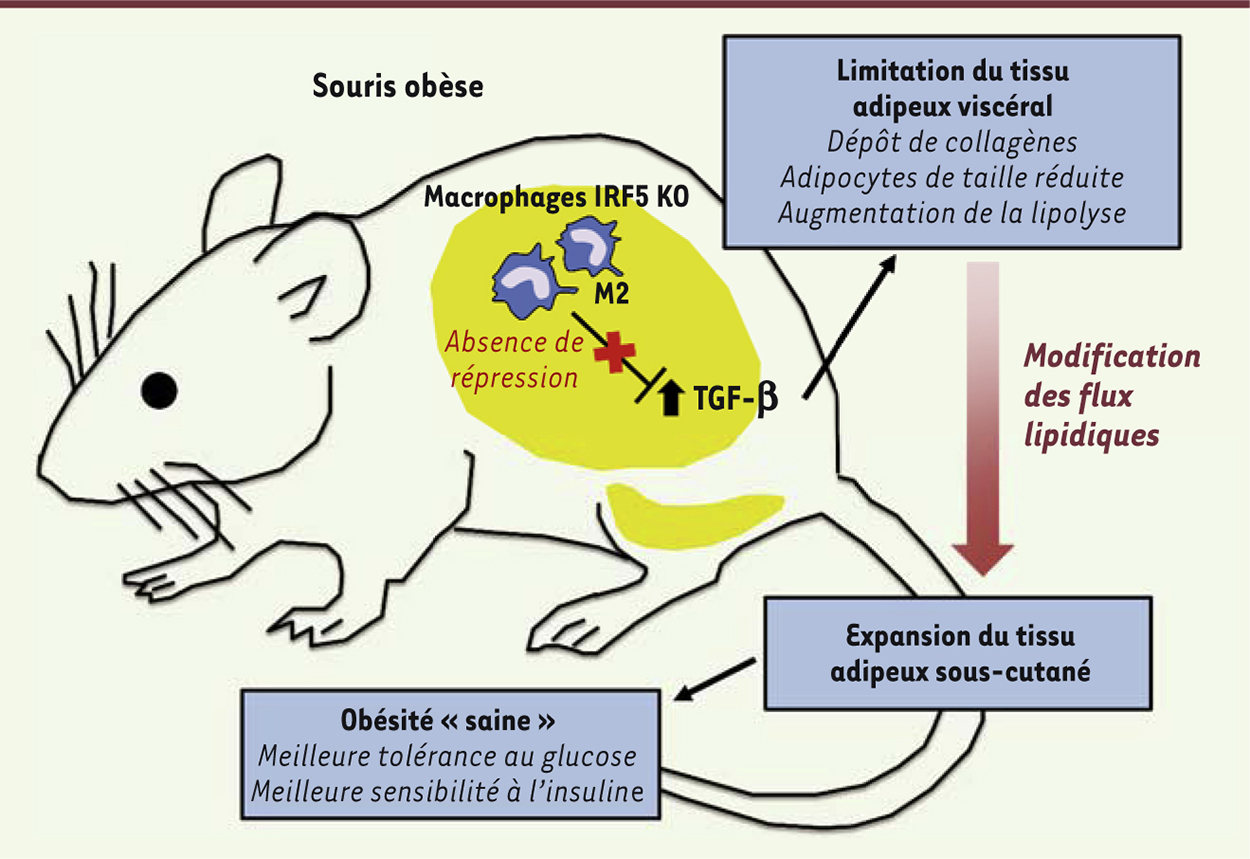
Le facteur de transcription IRF5 orchestre l’inflammation du tissu adipeux et influence le développement de l’obésité viscérale Le challenge de ces dernières années a été, et reste, l’identification des acteurs moléculaires influençant la polarisation des macrophages du tissu adipeux. La répression de la différenciation des macrophages pro-inflammatoires M1 pourrait favoriser le maintien des macrophages M2 dans le tissu adipeux. Dans cet objectif, nous avons récemment identifié le facteur de transcription IRF5 (interferon regulatory factor 5) comme le nouveau chef d’orchestre du phénotype pro-inflammatoire M1 des macrophages du tissu adipeux au cours de l’obésité [12]. IRF5 avait auparavant été décrit pour son rôle délétère dans l’activation des macrophages dans diverses pathologies auto-immunes. Lorsque des souris n’exprimant plus IRF5 dans leurs macrophages, sont placées sous un régime alimentaire favorisant l’obésité, elles développent une réponse immunitaire anti-inflammatoire systémique s’accompagnant d’une accumulation, dans les tissus adipeux, de nombreux macrophages M2 et d’autres cellules immunitaires tels que les lymphocytes Th2 (T helper 2) et les éosinophiles. Ces changements de distributions cellulaires sont associés à une amélioration significative de la résistance à l’insuline, et ce, malgré une augmentation de la masse grasse. De manière surprenante, la répartition de la masse grasse dans les divers dépôts adipeux est altérée chez les souris obèses déficientes pour IRF5 (Figure 1). On observe en effet une limitation du développement des tissus adipeux viscéraux et une expansion du tissu sous-cutané bénéfique. Au sein du tissu adipeux viscéral intra-abdominal, la matrice extracellulaire se développe de façon anormale, présentant une accumulation de collagènes. Cette accumulation semble restreindre la croissance des adipocytes et favoriser leur activité lipolytique, permettant une modification des flux lipidiques vers les dépôts adipeux sains des régions superficielles (Figure 1). Ces observations ont pu être confirmées dans différentes populations humaines en établissant chez des sujets obèses et obèses morbides, des corrélations significatives entre le niveau d’expression d’IRF5 dans le tissu adipeux d’une part, et le tour de taille (reflétant la masse grasse viscérale), la résistance à l’insuline et l’accumulation de collagènes dans le tissu adipeux viscéral, d’autre part. Cette étude pionnière, alliant une approche murine et une validation chez l’homme, démontre l’importance de la polarisation des macrophages dans l’orchestration de la réponse immunitaire et dans l’orientation du métabolisme, en contrôlant l’accumulation des graisses dans des régions plus ou moins délétères [12]. L’action d’IRF5 est généralement associée à une activation de la transcription. Dans notre étude, nous révélons cependant qu’IRF5 est aussi capable de réprimer la transcription, notamment des gènes anti-inflammatoires tels que ceux codant l’IL-10 et le TGF-β. Des études complémentaires seront donc requises afin de décrypter les mécanismes d’action d’IRF5 et d’identifier les voies de signalisation impliquées dans sa régulation au cours de l’obésité.
 | Figure 1.
Rôle protecteur de l’invalidation de IRF5 dans l’obésité. Le facteur de transcription IRF5 participe à l’activité pro-inflammatoire des macrophages du tissu adipeux dans l’obésité. L’invalidation de IRF5 dans les macrophages de souris (IRF5 KO) provoque un changement de leur phénotype vers un phénotype présentant des caractéristiques M2, spécifiquement au sein du tissu adipeux viscéral. L’activité répressive de IRF5 sur la transcription de TGF-β (transforming growth factor) est alors levée, induisant l’expression du TGF-β qui favorise le remodelage tissulaire (dépôt de collagènes) et limitant ainsi l’expansion du tissu adipeux intra-viscéral. Ces modifications sont à l’origine d’un changement dans le flux lipidique favorisant l’accumulation des lipides dans le tissu adipeux sous-cutané (plus sain pour l’organisme). Ces souris présentent alors une meilleure tolérance au glucose et une meilleure sensibilité à l’insuline, un état qui peut être qualifié d’obésité « saine ». |
|
Conclusions et perspectives Nous avons, pour la première fois, mis en évidence une influence directe des macrophages anti-inflammatoires sur les capacités d’adaptation fonctionnelle du tissu adipeux pendant l’obésité. Nos observations ouvrent des perspectives thérapeutiques intéressantes, permettant d’envisager l’utilisation de traitements anti-inflammatoires afin de contrôler le phénotype des macrophages et ainsi diminuer les complications métaboliques liées à l’obésité. Plusieurs essais cliniques utilisant des molécules anti-inflammatoires, telles que les antagonistes de l’IL-1β ou les dérivés de l’acide salicylique, ont déjà démontré une amélioration métabolique chez des sujets obèses ou diabétiques de type 2 [13]. Cependant, l’amélioration de la sensibilité à l’insuline obtenue grâce aux traitements anti-inflammatoires soulève la question de leurs bénéfices à très long terme. En effet, comme nous l’avons observé chez les souris déficientes pour IRF5, une meilleure sensibilité à l’insuline est généralement associée à une prise de poids, ce qui est problématique, comme c’est le cas pour les anti-diabétiques thiazolidinediones (molécules agonistes de PPAR-γ, peroxisome proliferator-activated receptors), aujourd’hui interdits en France. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Dalmas E, Clement K, Guerre-Millo M. Defining macrophage phenotype and function in adipose tissue . Trends Immunol. 2011; ; 32 : :307.–314. 2.
Xu H, Barnes GT, Yang Q, et al. Chronic inflammation in fat plays a crucial role in the development of obesity-related insulin resistance . J Clin Invest. 2003; ; 112 : :1821.–1830. 3.
Weisberg SP, McCann D, Desai M, et al. Obesity is associated with macrophage accumulation in adipose tissue . J Clin Invest. 2003; ; 112 : :1796.–1808. 4.
Dalmas E, Venteclef N, Caer C, et al. T cell-derived IL-22 amplifies IL-1beta-driven inflammation in human adipose tissue: relevance to obesity and type 2 diabetes . Diabetes. 2014; ; 63 : :1966.–1977. 5.
Tchernof A, Despres JP. Pathophysiology of human visceral obesity: an update . Physiol Rev. 2013; ; 93 : :359.–404. 6.
Lawrence T, Natoli G. Transcriptional regulation of macrophage polarization: enabling diversity with identity . Nat Rev Immunol. 2011; ; 11 : :750.–761. 7.
Kratz M, Coats BR, Hisert KB, et al. Metabolic dysfunction drives a mechanistically distinct proinflammatory phenotype in adipose tissue macrophages . Cell Metab. 2014; ; 20 : :614.–625. 8.
Liao X, Sharma N, Kapadia F, et al. Kruppel-like factor 4 regulates macrophage polarization . J Clin Invest. 2011; ; 121 : :2736.–2749. 9.
Odegaard JI, Ricardo-Gonzalez RR, Goforth MH, et al. Macrophage-specific PPARgamma controls alternative activation and improves insulin resistance . Nature. 2007; ; 447 : :1116.–1120. 10.
Wu D, Molofsky AB, Liang HE, et al. Eosinophils sustain adipose alternatively activated macrophages associated with glucose homeostasis . Science. 2011; ; 332 : :243.–247. 11.
Hussaarts L, Garcia-Tardon N, van Beek L, et al. Chronic helminth infection and helminth-derived egg antigens promote adipose tissue M2 macrophages and improve insulin sensitivity in obese mice . FASEB J. 2015; ; 29 : :3027.–3039. 12.
Dalmas E, Toubal A, Alzaid F, et al. Irf5 deficiency in macrophages promotes beneficial adipose tissue expansion and insulin sensitivity during obesity . Nat Med. 2015; ; 21 : :610.–618. 13.
Donath MY. Targeting inflammation in the treatment of type 2 diabetes: time to start . Nat Rev Drug Discov. 2014; ; 13 : :465.–476. |