Le syndrome de Wiskott-Aldrich (WAS) est un déficit immunitaire primaire rare faisant l’objet de plusieurs essais de thérapie génique dans différents pays. L’essai de thérapie génique publié récemment et réalisé à Paris et à Londres, présente la particularité d’avoir montré une efficacité thérapeutique sur une population de patients pédiatriques relativement âgés et sévèrement atteints [1]. L’approche par transfert de gène à l’aide d’un vecteur lentiviral dans les cellules souches hématopoïétiques autologues s’est révélée robuste et dénuée d’effets secondaires liés au vecteur « self-inactivé » (ou self inactivating [SIN] ; les promoteurs viraux sont modifiés pour éviter le risque lié à la dérégulation de gènes adjacents) qui a été utilisé. Alors que les études se poursuivent sur un plus grand nombre de patients et dans d’autres centres, la thérapie génique pourrait désormais être considérée comme un futur traitement alternatif à la greffe allogénique de cellules souches chez les patients WAS ne pouvant pas bénéficier d’un donneur HLA-compatible.
La maladie WAS est bien caractérisée. Ce déficit immunitaire primaire lié à l’X est causé par l’absence de la protéine WASp (Wiskott Aldrich syndrome protein) dans les cellules sanguines. Dans sa forme classique, les patients souffrent d’infections bactériennes et virales récurrentes, d’eczéma sévère, de saignements allant jusqu’aux hémorragies et certains développent des manifestations auto-immunes ou lympho-prolifératives [2]. La protéine WASp est un régulateur du cytosquelette d’actine et de la signalisation cellulaire dans les leucocytes. Son absence perturbe de multiples fonctions immunitaires et provoque une thrombopénie microcytaire caractéristique [3]. La maladie est très rare (1 cas sur 250 000 naissances) et le traitement de référence est la greffe de cellules souches hématopoïétiques (CSH) allogéniques dont le risque de complications reste élevé lorsqu’un donneur HLA-compatible (10/10 ou 9/10)1 n’est pas disponible [4].
La thérapie génique autologue a donc été évaluée comme une alternative potentielle chez certains patients WAS. L’approche repose sur le transfert de gène ex vivo dans les CSH du patient ; cette approche thérapeutique a déjà montré son efficacité dans un certain nombre de maladies du système lympho-hématopoïétique [5]. Toutefois, la qualité et la sécurité des vecteurs de transfert de gène font toujours l’objet de stratégies d’optimisation, notamment en raison des complications possibles liées à la mutagenèse insertionnelle, comme cela a été observé dans certains essais [6]. Un essai multicentrique de phase I/II a été mené à Londres (Great Ormond Street Hospital) et à Paris (Hôpital Necker-Enfants Malades), dont Généthon est promoteur. Cet essai est basé sur l’utilisation d’un vecteur lentiviral sécurisé pour traiter des patients WAS sévèrement atteints ne disposant pas de donneur HLA-compatible. La faisabilité et la sécurité de ce vecteur ont été évaluées chez 7 patients inclus de façon séquentielle sur une période de 4 ans. Le vecteur testé est dérivé du VIH-1 (virus de l’immunodéficience humaine-1) et contient l’ADN complémentaire du gène WAS humain, exprimé grâce à un fragment du promoteur proximal de ce gène, permettant une expression physiologique du transgène dans les cellules hématopoïétiques [7]. La cassette d’expression est dépourvue de séquences virales codantes. En particulier, les régions LTR (long-terminal repeats) ont été modifiées pour supprimer les sites de liaison aux facteurs de transcription produisant ainsi un vecteur self-inactivé (vecteur SIN) devenu incapable de se répliquer et d’induire, à travers ses LTR, la transactivation de gènes adjacents à son insertion génomique [8]. Le vecteur est utilisé pour transduire les cellules CD34+ 2, du patient ex vivo. L’infusion au patient des CSH ainsi transduites est précédée par un conditionnement myéloablatif3 et lymphodéplétant à l’aide de busulfan et de fludaradine. Les patients sont alors suivis dans l’essai pendant une première période de 2 ans. Une étude de suivi est ensuite réalisée pendant 3 ans.
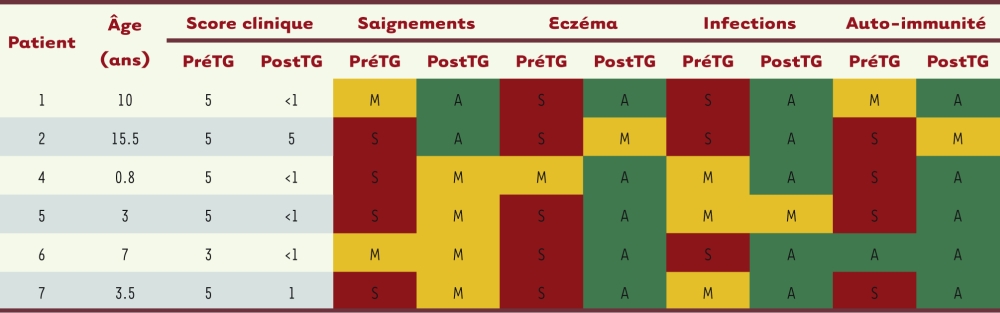
Les premiers résultats de cet essai ont été publiés récemment et décrivent l’évolution de six patients sur sept, qui ont été suivis sur une durée allant de 9 à 42 mois [1]. Un des sept patients est décédé 7 mois après la thérapie génique à la suite de complications liées à des infections virales pré-existantes. Les six patients évaluables avaient un score élevé de sévérité de la maladie au moment de l’inclusion dans l’essai (score supérieur ou égal à 3, voir les définitions dans la légende du Tableau I). Après traitement, leur score s’est trouvé réduit au plus faible niveau, à l’exception du patient 2 qui a conservé un score 5 en raison de la persistance de légères manifestations autoimmunes. Dans l’ensemble, ces six patients ont vu disparaître leur eczéma et les épisodes hémorragiques. Le nombre d’infections opportunistes a été réduit et les symptômes autoimmuns se sont améliorés. Ainsi, la qualité de vie des 6 patients évaluables à long terme, s’est significativement améliorée puisque le nombre d’hospitalisations a été réduit et tous sont maintenant indépendants de transfusions de plaquettes.4
| Tableau I.
Démographie des patients WAS et évolution des signes cliniques. Six des 7 patients WAS traités par thérapie génique à Paris et Londres et décrits dans [1] sont reportés. Leurs signes cliniques sont classés en S : Sévère, M : Modéré, A : Aucun, dans la période précédant la thérapie génique (PréTG) ou après infusion des cellules transduites (PostTG) et jusqu’au dernier point de temps analysé. Le patient 3 n’a pas pu être évalué sur une durée suffisante et n’est pas inclus dans ce tableau. Le score clinique utilisé pour évaluer la sévérité de la maladie WAS est défini de la façon suivante : un score 1 correspond à la microthrombocytopénie retrouvée chez tous les patients ; un score 2 inclut un eczéma modéré, des critères d’immunodéficience et des infections modérées occasionnelles ; un score de 3 représente une immunodéficience plus sévère, associée à des infections prolongées ; un score de 4 est attribué en cas d’eczéma ou d’infections persistantes et résistantes aux traitements conventionnels ; le score 5 concerne les formes cliniques très sévères ou incluant des complications autoimmunes ou malignes. |
Le bénéfice thérapeutique obtenu chez ces patients est attribué à l’efficacité de la reconstitution lympho-hématopoïétique à partir des progéniteurs génétiquement modifiés. En effet, la détection du transgène dans les leucocytes des patients a permis la restauration de leurs fonctions immunitaires. L’analyse, par PCR quantitative (qPCR), du nombre de copies de vecteur intégré dans les différentes sous-populations cellulaires isolées à partir des prélèvements sanguins, a toutefois révélé des différences entre les patients. Le nombre de copies moyen varie de 0,1 à 1,0 copie par cellule dans la fraction mononucléée aux derniers points de temps analysés. Le vecteur est cependant retrouvé dans toutes les lignées d’origine hématopoïétique analysées avec des taux d’intégration plus élevés dans les populations lymphocytaires que dans les populations monocytaires et granulocytaires. L’expression de la protéine WASp, issue du vecteur intégré, est démontrée dans différentes populations lymphocytaires telles que les T CD4+ et CD8+, T régulateurs CD4+ CD25+ FoxP3+, les lymphocytes B et NK (natural killer). Aux derniers points de temps analysés, les pourcentages de cellules WASp+ varient de 34 à 84 % dans les lymphocytes T, de 14 à 85 % dans les lymphocytes NK et de 13 à 55 % dans les lymphocytes B. D’une façon remarquable, les taux de lymphocytes T et NK WASp+ augmentent au cours du temps chez les patients, confirmant l’avantage sélectif conféré par la restauration de l’expression de la protéine WASp dans ces cellules. Une thymopoïèse efficace a été mise en évidence chez les patients, comme en atteste la production de cellules T naïves, associée à la détection des cercles d’excision (T-cell receptor excision circles ou TREC) issus du processus de réarrangement du récepteur T (TCR). Après thérapie génique, le répertoire du récepteur des lymphocytes T est polyclonal, la stimulation antigénique des lymphocytes T devient robuste. La restauration de l’activité cytolytique des cellules NK est montrée chez un patient. Les cellules dendritiques des patients traités sont à nouveau capables de former des podosomes, structures d’adhésion fortement dépendantes de la présence de WASp dans les cellules. Malgré la correction évidente de leurs fonctions immunitaires, les patients traités restent thrombopéniques, même si la majorité d’entre eux voient leur nombre de plaquettes augmenter. De plus, chez ces patients, les plaquettes produites expriment la protéine WASp et le volume moyen plaquettaire est normalisé. Cette correction partielle a permis aux patients d’être indépendants vis-à-vis des transfusions de plaquettes dès le 7e mois après le traitement.
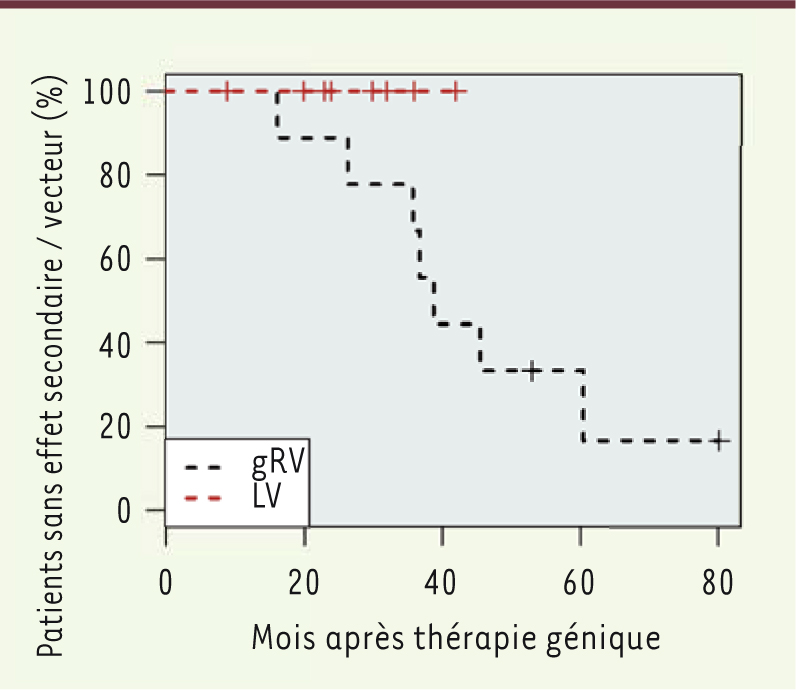
À côté de l’efficacité clinique obtenue, cet essai de thérapie génique, basé sur l’utilisation du vecteur lentiviral SIN, s’est également révélé dénué de génotoxicité. Aucun effet secondaire, lié à une prolifération cellulaire anormale, n’a été observé à ce jour. Le séquençage à haut débit de l’ADN cellulaire des sous-populations lymphocytaires et myéloïdes du sang périphérique des patients a été réalisé à différents points de temps et montre une grande diversité des sites d’insertion génomique du transgène sans dominance clonale. Ces résultats sont cohérents avec ceux récemment publiés sur 3 patients, traités à Milan, dans une étude indépendante mais utilisant le même vecteur lentiviral SIN [9]. Collectivement, les résultats obtenus à Milan, Londres et Paris montrent l’innocuité du vecteur lentiviral SIN utilisé comparé au vecteur rétroviral qui avait été utilisé initialement, dans le premier essai de thérapie génique du WAS menée par l’équipe du Pr C. Klein (Hanovre, Allemagne). Ce premier essai était basé sur l’utilisation d’un vecteur gamma-rétroviral portant des LTR actifs (vecteur gamma rétroviral, gRV) à l’origine de mutagenèse insertionnelle observée chez 7 des 9 patients traités ayant développé une leucémie ou un syndrome myélodysplasique (Figure 1), et ce malgré un bénéfice clinique initial avéré [10].
| Figure 1.
Apparition d’effets secondaires liés au vecteur, estimés par la méthode de Kaplan-Meier4. Ces courbes montrent l’évolution de la proportion de patients sans effets secondaires liés au vecteur dans les essais de thérapie génique de WAS qui ont été publiés et qui utilisent un vecteur lentiviral (LV) à Paris, Londres [1] et à Milan [9] (courbe rouge) et un vecteur gamma rétroviral (gRV) à Hanovre [10] (courbe noire). Les effets secondaires liés au vecteur dans l’essai gRV sont l’apparition de T-ALL (T-lineage acute lymphoblastic leukemia) ou AML (acute myeloid leukemia) induites par mutagenèse insertionnelle. Le suivi est arrêté à la date de publication de chaque essai. |
L’essai réalisé à Paris et Londres démontre, après que les premières preuves d’efficacité aient été obtenues sur des patients plus jeunes et moins sévèrement atteints [9], la faisabilité, l’efficacité et la sécurité de cette approche de thérapie génique pour traiter les patients pédiatriques relativement âgés souffrant de formes sévères du syndrome de Wiskott-Aldrich. Plusieurs études utilisant ce vecteur sont toujours en cours (dont une à Boston, États-Unis) afin d’inclure un nombre plus élevé de patients et de réaliser des observations sur de plus longues durées. Si l’ensemble de ces études confirme l’efficacité, la bonne tolérance au traitement et sa sécurité, la thérapie génique pourrait être considérée dans un futur proche comme un traitement alternatif à la greffe allogénique de cellules souches chez les patients WAS ne pouvant pas bénéficier d’un donneur HLA-compatible.