| |
| Med Sci (Paris). 2015 November; 31: 14–17. Published online 2015 November 6. doi: 10.1051/medsci/201531s304.Les explorations des muscles respiratoires sont-elles utiles pour poser l’indication d’une étude du sommeil chez l’enfant neuromusculaire ? Sonia Khirani,1 Adriana Ramirez,2 Jorge Olmo-Arroyo,3 Alessandro Amaddeo,4 Susana Quijano-Roy,5 Isabelle Desguerre,6 and Brigitte Fauroux7* 1Chercheur, ASV Santé, Gennevilliers et Unité de ventilation non invasive et du sommeil de l’enfant, Hôpital Necker-Enfants malades, Paris 2Ingénieur de recherche, ADEP Assistance, Suresnes, et Unité de ventilation non invasive et du sommeil de l’enfant, Hôpital Necker-Enfants malades, Paris 3Technicien de recherche subventionné AFM, Unité de ventilation non invasive et du sommeil de l’enfant, Hôpital Necker-Enfants malades, Paris 4Chef de clinique, Unité de ventilation non invasive et du sommeil de l’enfant, Hôpital Necker-Enfants malades, Paris 5Neuropédiatre, Centre de Référence Maladies Neuromusculaires (GNMH), Hôpital Raymond Poincaré, Garches, Université Versailles UVSQ, Inserm, UMRS1176, Montigny-le-Bretonneau 6Neuropédiatre, Centre de Référence Maladies Neuromusculaires (GNMH), Hôpital Necker-Enfants malades, Paris, Université Paris Descartes 7Pneumo-pédiatre, Unité de ventilation non invasive et du sommeil de l’enfant, Hôpital Necker-Enfants malades, Paris, Université Paris Descartes, Inserm U955, Équipe 13, Créteil MeSH keywords: Tonsilles pharyngiennes, Adolescent, Résistance des voies aériennes, Enfant, Humains, Hypertrophie, Nourrisson, Faiblesse musculaire, Maladies neuromusculaires, Obésité, Tonsille palatine, Polysomnographie, Guides de bonnes pratiques cliniques comme sujet, Tests de la fonction respiratoire, Muscles respiratoires, Syndromes d'apnées du sommeil, Travail respiratoire, Jeune adulte, anatomopathologie, étiologie, physiopathologie, complications, méthodes, diagnostic |
L’atteinte des muscles respiratoires est très fréquente au cours de nombreuses maladies neuromusculaires (MNM). De plus, la faiblesse des muscles respiratoires engendre un déficit pulmonaire restrictif et une augmentation des résistances des voies aériennes supérieures, qui peuvent aggraver les troubles respiratoires du sommeil (TRS) tels que l’hypoventilation alvéolaire nocturne et/ou les apnées obstructives du sommeil [1, 2]. Lorsque l’on sait que les MNM constituent un groupe de maladies relativement commun (prévalence 1/3 000) et que l’insuffisance respiratoire chronique est la cause la plus fréquente de mortalité dans les MNM [3], on comprend bien l’importance d’un suivi clinique et d’une évaluation de la fonction respiratoire réguliers. Les TRS représentent une cause majeure de morbidité et de mortalité chez l’enfant neuromusculaire, avec une prévalence environ 10 fois supérieure à celle de la population générale [4]. Cependant, le diagnostic des TRS est parfois difficile. Il n’y a en effet aucun symptôme et/ou index clinique diurne capable de prédire les TRS chez l’enfant neuromusculaire. La polysomnographie reste l’examen de référence pour diagnostiquer les TRS, mais cet examen n’est pas toujours faisable facilement et rapidement dans tous les centres, et requiert du temps et une certaine expertise. D’autre part, il semble important de déterminer à quel moment réaliser la polysomnographie et selon quels critères, vu qu’aucune indication n’est clairement validée pour l’enfant neuromusculaire. De nombreuses études se sont intéressées à évaluer les liens possibles entre paramètres diurnes (symptômes, fonction pulmonaire, gaz du sang, etc.) et nocturnes des TRS chez l’enfant présentant diverses MNM, avec pour objectif d’identifier un paramètre diurne simple, fiable et hautement spécifique des TRS. Nous présentons ici une synthèse de ces études, assez contradictoires, après un bref aperçu de la physiopathologie des TRS chez les enfants neuromusculaires. |
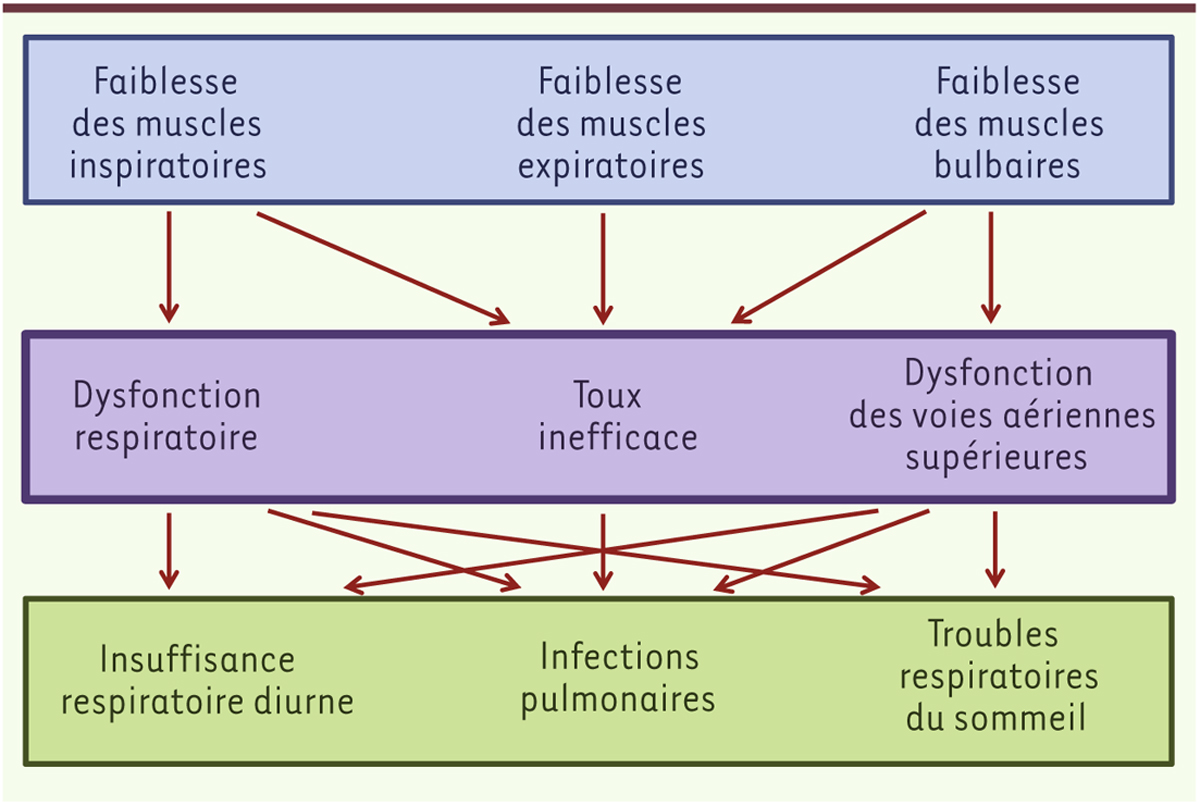
Le sommeil chez les patients neuromusculaires Chez le sujet normal, le sommeil a de nombreux effets sur la respiration, avec une modification de la réponse des chémorécepteurs et mécanorécepteurs, une réduction de la réponse (éveil) aux stimulus (hypercapnie, hypoxémie), une modification de la mécanique respiratoire, ayant pour conséquence une réduction physiologique de la ventilation. De plus, le tonus des muscles pharyngés dilatateurs et des muscles intercostaux diminue avec la profondeur du sommeil, avec une atonie complète pendant le sommeil REM (rapid eye movement), tandis que le diaphragme maintient son activité pendant le sommeil non REM mais voit son activité tonique se réduire en phase REM. Cette « hypoventilation nocturne physiologique », beaucoup plus marquée au cours du sommeil REM, est responsable d’une réduction modérée de la pression artérielle en oxygène et d’une augmentation modérée de la pression artérielle en dioxyde de carbone (PaCO2). Toutes ces variations ventilatoires nocturnes n’ont cependant aucun effet chez le sujet sain ; en revanche, dans le cas d’une faiblesse des muscles respiratoires, elles peuvent précipiter la survenue de TRS, d’une hypoxémie ou d’une hypoventilation nocturne, allant jusqu’à conduire à une insuffisance respiratoire nocturne. Chez l’enfant neuromusculaire, les TRS sont généralement le résultat d’une combinaison de deux événements principaux : une hypoventilation alvéolaire et des apnées obstructives du sommeil. D’autres événements respiratoires peuvent aussi être observés, comme des apnées centrales, principalement dans les MNM avec atteinte de la structure et de la fonction cérébrales, des limitations de débit, une respiration périodique, et des éveils liés à des efforts respiratoires (RERA). Les TRS surviennent principalement au cours du sommeil REM lorsque la faiblesse musculaire est encore modérée et les manifestations respiratoires diurnes pas encore patentes. Au fur et à mesure de la progression de la MNM, les TRS se généralisent sur l’ensemble de la nuit (phases REM et non REM), et une insuffisance respiratoire nocturne, puis diurne, peut survenir en l’absence de traitement (
Figure 1
).
 | Figure 1.
Pathogenèse des troubles respiratoires chez les patients atteints de maladie neurologique.
|
Les apnées obstructives chez les patients neuromusculaires peuvent être dues non seulement à une hypertrophie adéno-amygdalienne, une obésité, une macroglossie, une glossoptose, ou à des anomalies des voies aériennes supérieures comme c’est le cas chez d’autres patients ou pathologies, mais aussi à une faiblesse des muscles pharyngés dilatateurs – nécessaires au maintien de l’ouverture des voies aériennes – qui va entraîner une augmentation des résistances des voies aériennes supérieures au cours du sommeil. Ce mécanisme est surtout observé pendant le sommeil REM du fait de l’atonie des muscles pharyngés. L’hypoventilation alvéolaire – dont la définition exacte n’est pas consensuelle chez l’enfant – peut résulter de la survenue d’un ou de plusieurs mécanismes plus ou moins associés [5, 6] : (1) une faiblesse des muscles respiratoires, des muscles oropharyngés et des muscles de la cage thoracique ; (2) une altération de la mécanique respiratoire augmentant le travail respiratoire et aggravant la fatigue des muscles respiratoires ; (3) une hypotonie et/ou atonie des muscles respiratoires au cours du sommeil REM ; (4) une diminution de la réponse des chémorécepteurs ; (5) un syndrome restrictif secondaire à une scoliose. Avec la progression de la MNM, l’hypoventilation alvéolaire devient de plus en plus sévère et s’accompagne d’une hypercapnie et d’une hypoxémie nocturnes. La présence d’une scoliose, d’anomalies anatomiques (morphologie cranio-faciale), d’une obésité, et/ou une paralysie diaphragmatique sont autant de facteurs susceptibles d’aggraver les TRS et doivent être corrigés dans la mesure du possible. |
Relation entre TRS et symptômes cliniques-questionnaires Les patients neuromusculaires présentant une faiblesse des muscles respiratoires se plaignent souvent de céphalées matinales, d’un sommeil non réparateur, d’une hypersomnolence diurne, d’une concentration altérée et/ou de troubles de l’attention, d’une fatigue voire même d’une léthargie. Cependant, les TRS et l’insuffisance respiratoire nocturne peuvent se manifester de manière insidieuse, c’est-à-dire en l’absence de tout symptôme clinique [7–9]. Plusieurs études ont recherché un lien entre la présence et/ou la sévérité des symptômes cliniques diurnes et les TRS, une hypoxémie et/ou une hypercapnie nocturnes. Les résultats de ces études sont très contradictoires. En effet, de nombreuses études n’ont observé aucun lien ou seulement de très faibles corrélations entre symptômes et TRS et/ou gaz du sang nocturnes chez des enfants/adolescents avec une dystrophie musculaire de Duchenne (DMD), une amyotrophie spinale (SMA) ou diverses MNM [4, 10–12]. Par ailleurs, parmi le petit nombre d’études réalisées chez l’enfant/adolescent neuromusculaire qui ont établi un lien entre symptômes et TRS [13–15], aucune n’a clairement démontré une association significative entre les différents paramètres. Seule l’étude de Steier et al. [16] a observé, chez l’adulte présentant une paralysie diaphragmatique, le fort pouvoir prédictif d’un questionnaire pour détecter les TRS. Le questionnaire recherche (a) la présence ou non d’une dyspnée (a1) en position couchée, (a2) lorsque le patient se penche, ou (a3) lorsque le patient nage ou est allongé dans son bain, (b) si la position du patient pour dormir a changé, (c) si le patient a noté une modification de la qualité de son sommeil (éveils, sommeil agité, sommeil non réparateur). Ce simple questionnaire mériterait certainement d’être testé chez une population d’enfants/adolescents dans les mêmes conditions. Une recherche systématique et explicite de symptômes cliniques diurnes (maux de tête, somnolence…) est quand même recommandée pour orienter ou confirmer des TRS sur des enregistrements poly(somno)graphiques. En effet, ces symptômes peuvent aussi bien passer inaperçus, être sous-rapportés et/ou être confondus avec la symptomatologie de la pathologie neuromusculaire sous-jacente. |
Relation entre TRS et fonction respiratoire-muscles respiratoires De nombreuses études ont comparé divers paramètres diurnes, tels que des paramètres de fonctionnalité respiratoire (capacité vitale, capacité pulmonaire totale, capacité résiduelle fonctionnelle, volume résiduel, fréquence respiratoire, commande ventilatoire, etc.), et/ou des paramètres de mesure de la force des muscles (pression inspiratoire maximale ou lors du reniflement, pression expiratoire maximale), et/ou les gaz du sang artériels diurnes, à des paramètres nocturnes tels que l’index d’apnées-hypopnées (IAH), les gaz du sang nocturnes, l’index de désaturations nocturnes. Parmi plus d’une vingtaine d’études concernant des populations d’enfants/adolescents avec une DMD, une SMA ou diverses MNM, on retiendra l’étude de Toussaint et al. [17] qui a montré chez 114 adolescents et jeunes adultes avec DMD que la capacité vitale s’avère utile pour détecter une hypercapnie nocturne, bien qu’avec une faible spécificité. La capacité vitale (en position assise ou couchée) est d’ailleurs l’un des paramètres les mieux corrélés aux gaz du sang nocturnes [7, 11, 17, 18] ou aux TRS [18]. Seule l’étude de Ragette et al. [18] s’est intéressée à la variation de la capacité vitale de la position assise à la position couchée (∆CV) – qui indique une faiblesse diaphragmatique lorsque le ∆CV est supérieur à 25 % – et a montré que la faiblesse diaphragmatique représentait un facteur de risque important pour les TRS et l’insuffisance respiratoire nocturne et diurne. Contrairement à ces études, plusieurs études [4, 9, 12, 14, 20] n’ont pas réussi à identifier des paramètres diurnes clairement prédictifs des anomalies des échanges gazeux nocturnes et/ou des TRS. L’étude de Bersanini et al. [21], qui est la seule étude à avoir comparé un nombre aussi important de paramètres diurnes (volumes pulmonaires, mécanique respiratoire, force des muscles, endurance des muscles, gaz du sang artériels diurnes) aux paramètres polysomnographiques et gazométriques nocturnes, n’a en effet retrouvé que de faibles corrélations, chez 52 enfants avec diverses MNM : entre la capacité vitale, la capacité résiduelle fonctionnelle, la pression maximale lors du reniflement, la pression gastrique à la toux et l’hypoxémie nocturne ; entre la PaCO2 diurne, le pH diurne et l’hypercapnie nocturne ; ou entre la PaCO2 diurne et l’IAH. Ces résultats discordants peuvent être expliqués par la diversité des populations étudiées (populations constituées de différentes MNM, âge et sévérité des patients, etc.), au manque de consensus pour les différentes définitions utilisées et/ou critères de normalité choisis. De larges études sont nécessaires tout d’abord pour établir des définitions et des critères de normalité propres à la pédiatrie (hypoventilation, hypoxémie nocturnes, etc.) et comprendre les mécanismes conduisant aux TRS dans les différentes MNM, avant de pouvoir identifier et quantifier plus précisément les TRS chez ces patients. En effet, la définition d’une hypoventilation alvéolaire nocturne « cliniquement pathologique » dans une MNM n’est pas validée chez l’enfant alors que cette situation constitue un des principaux événements conduisant à une insuffisance respiratoire nocturne. |
Devant le manque de cohérence et la discordance entre les différentes études, il apparaît indispensable d’élargir les indications d’une étude du sommeil chez les enfants neuromusculaires, tant que la pathogenèse des TRS ne sera pas clarifiée dans les différentes MNM et que la prise en charge ne sera pas standardisée selon l’atteinte neuromusculaire. Les recommandations nationales (Haute Autorité de Santé, mai 2012) [22] et/ou internationales [3, 23, 24] n’apportent pas plus de consensus quant aux définitions à adopter ou à la place de la polysomnographie. Cependant, les enfants neuromusculaires devraient avoir au moins une fois par an une mesure de la capacité vitale en position assise et couchée, des gaz du sang à l’éveil et une oxymétrie nocturne. Une capnographie nocturne devrait être couplée à l’oxymétrie dans la mesure du possible. En fonction des résultats de ces examens, la polysomnographie se discutera au cas par cas. La mise en place d’un traitement ne devrait cependant pas être retardée, si un examen polysomnographique n’est pas accessible rapidement, dans le cas d’anomalies nocturnes patentes. Une attention particulière devrait être portée aux patients neuromusculaires susceptibles de développer une faiblesse diaphragmatique, ce qui est le cas dans des MNM telles que les myopathies par mutation de SEPN1, la maltase acide, les collagénopathies 6 (dystrophie musculaire congénitale de type Ullrich, myopathie de Bethlem). |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Arens R, Muzumdar H. Sleep, sleep disordered breathing, and nocturnal hypoventilation in children with neuromuscular diseases . Paediatr Respir Rev. 2010; ; 11 : :24.–30. 2.
Benditt JO, Boitano LJ. Pulmonary issues in patients with chronic neuromuscular disease . Am J Respir Crit Care Med. 2013; ; 187 : :1046.–1055. 3.
Hull J, Aniapravan R, Chan E, et al. british thoracic Society guideline for respiratory management of children with neuromuscular weakness . Thorax. 2012; ; 67 : ((suppl 1)) : :i1.–40. 4.
Labanowski M, Schmidt-Nowara W, Guilleminault C. Sleep and neuromuscular disease: frequency of sleep-disordered breathing in a neuromuscular disease clinic population . Neurology. 1996; ; 47 : :1173.–1180. 5.
Chokroverty S. Sleep-disordered breathing in neuromuscular disorders: a condition in search of recognition . Muscle Nerve. 2001; ; 24 : :451.–455. 6.
Katz SL. Assessment of sleep-disordered breathing in pediatric neuromuscular diseases . Pediatrics. 2009; ; 123 : ((suppl 4)) : :S222.–S225. 7.
Katz SL, Gaboury I, Keilty K, et al. Nocturnal hypoventilation: predictors and outcomes in childhood progressive neuromuscular disease . Arch Dis Child. 2010; ; 95 : :998.–1003. 8.
Khan Y, Heckmatt JZ. Obstructive apnoeas in Duchenne muscular dystrophy . Thorax. 1994; ; 49 : :157.–161. 9.
Manni R, Cerveri I, Ottolini A, et al. Sleep related breathing patterns in patients with spinal muscular atrophy . Ital J Neurol Sci. 1993; ; 14 : :565.–569. 10.
Kirk VG, Flemeons WW, Adams C, et al. Sleep-disordered breathing in Duchenne muscular dystrophy: a preliminary study of the role of portable monitoring . Pediatr Pulmonol. 2000; ; 29 : :135.–140. 11.
Mellies U, Ragette R, Schwake C, et al. Daytime predictors of sleep disordered breathing in children and adolescents with neuromuscular disorders . Neuromuscul Disord. 2003; ; 13 : :123.–128. 12.
Suresh S, Wales P, Dakin C, et al. Sleep-related breathing disorder in Duchenne muscular dystrophy: disease spectrum in the paediatric population . J Paediatr Child Health. 2005; ; 41 : :500.–503. 13.
Barbé F, Quera-Salva MA, McCann C, et al. Sleep-related respiratory disturbances in patients with Duchenne muscular dystrophy . Eur Respir J. 1994; ; 7 : :1403.–1408. 14.
Kotterba S, Patzold T, Malin JP, et al. Respiratory monitoring in neuromuscular disease: capnography as an additional tool? . Clin Neurol Neurosurg. 2001; ; 103 : :87.–91. 15.
Mellies U, Dohna-Schwake C, Stehling F, et al. Sleep disordered breathing in spinal muscular atrophy . Neuromuscul Disord. 2004; ; 14 : :797.–803. 16.
Steier J, Jolley CJ, Seymour J, et al. Screening for sleep-disordered breathing in neuromuscular disease using a questionnaire for symptoms associated with diaphragm paralysis . Eur Respir J. 2011; ; 37 : :400.–405. 17.
Toussaint M, Steens M, Soudon P. Lung function accurately predicts hypercapnia in patients with Duchenne muscular dystrophy . Chest. 2007; ; 131 : :368.–375. 18.
Ragette R, Weinreich G, Schwake C, et al. Diaphragmatic weakness and its impact on respiratory function in primary myopathies . Pneumologie. 2005; ; 59 : :311.–315. 19.
Ragette R, Mellies U, Schwake C, et al. H. Patterns and predictors of sleep disordered breathing in primary myopathies . Thorax. 2002; ; 57 : :724.–728. 20.
Anderson VB, McKenzie JA, Seton C, et al. Sniff nasal inspiratory pressure and sleep disordered breathing in childhood neuromuscular disorders . Neuromuscul Disord. 2012; ; 22 : :528.–533. 21.
Bersanini C, Khirani S, Ramirez A, et al. Nocturnal hypoxaemia and hypercapnia in children with neuromuscular disorders . Eur Respir J. 2012; ; 39 : :1206.–1212. 22.
Haute Autorité de Santé . Place et conditions de réalisation de la polysomnographie et de la polygraphie respiratoire dans les troubles du sommeil . Saint-Denis; : mai. 2012. 23.
Kushida CA, Littner MR, Morgenthaler T, et al. Practice parameters for the indications for polysomnography and related procedures: an update for 2005 . Sleep. 2005; ; 28 : :499.–521. 24.
Royal College of Paediatrics and Child Health . Working party on sleep physiology and respiratory control disorders in childhood. Standards for services for children with disorders of sleep physiology . London: : September. 2009. |