| |
| Med Sci (Paris). 2015 November; 31(11): 996–1005. Published online 2015 November 17. doi: 10.1051/medsci/20153111014.Les phosphoinositides Ces lipides qui coordonnent la dynamique cellulaire Julien Viaud1* and Bernard Payrastre1,2** 1Inserm UMR 1048, institut des maladies métaboliques et cardiovasculaires (I2MC), université Toulouse III Paul-Sabatier, 1, avenue Jean Poulhès, BP 84225, 31432Toulouse cedex 04, France 2Centre hospitalier universitaire de Toulouse, laboratoire d’hématologie, 31059Toulouse Cedex 03, France |
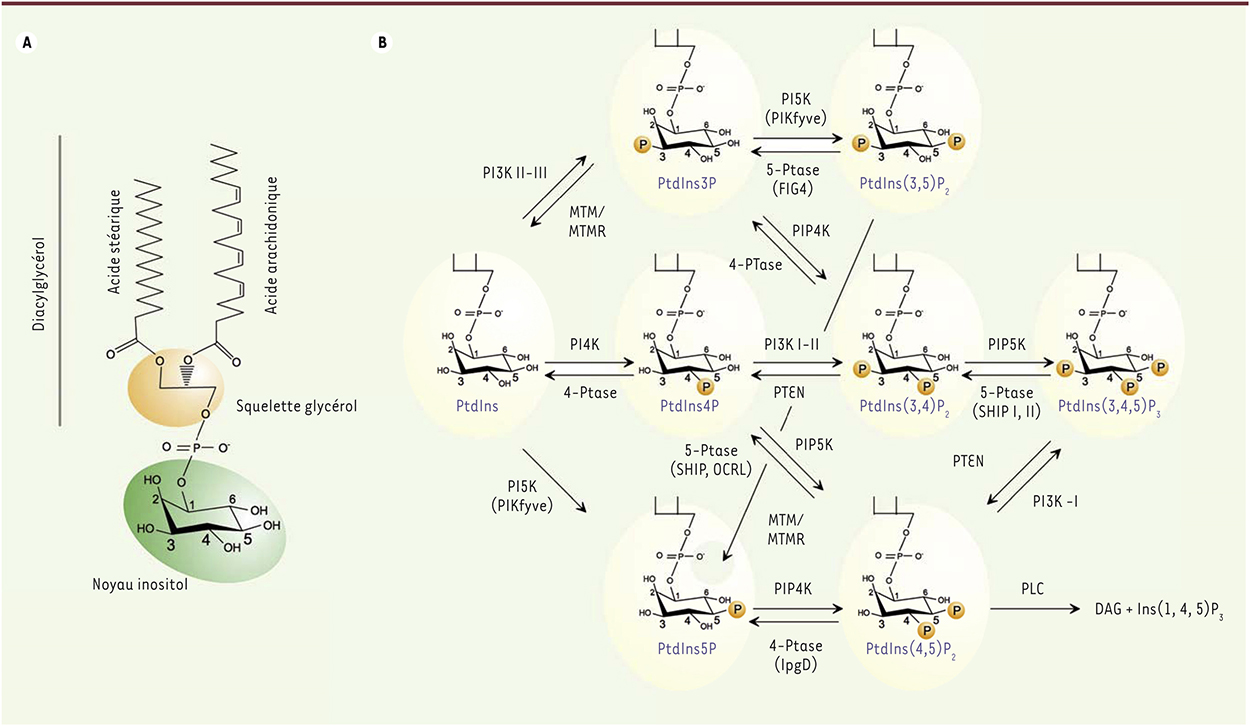
Les phosphoinositides (PI), appelés parfois lipides à inositol, sont des glycérophospholipides qui représentent environ 10 à 15 % des phospholipides membranaires. Les deux acides gras qui les constituent majoritairement sont l’acide stéarique (C18:0)1 en position 1 et l’acide arachidonique (C20:4) en position 2, mais d’autres espèces moléculaires minoritaires coexistent dans la plupart des cellules. Ces acides gras sont fixés sur le squelette glycérol, lui-même relié au noyau inositol par une liaison phosphodiester (Figure 1A). Malgré la présence de 5 groupements hydroxyle libres sur le noyau inositol, seules les positions 3, 4 et 5 ont été retrouvées phosphorylées par des kinases spécifiques. Des problèmes d’encombrement stérique empêchent vraisemblablement l’accès des positions 1 et 6 aux kinases. Ainsi, en plus du phosphatidylinositol (PtdIns) qui représente 80 % du total des PI, 7 autres PI ont été identifiés, correspondant aux diverses combinaisons de phosphorylation du noyau inositol (Figure 1B et Tableau I). Le PtdIns4P et le PtdIns(4,5)P2 représentent 10 % des PI totaux, alors que les autres n’en représentent pas plus de 1 % à 2 % chacun (Tableau I). Les PI sont caractérisés par un métabolisme extrêmement actif, grâce à l’action d’un ensemble de PI-kinases et -phosphatases spécifiques (Figure 1B et Tableau I). Ces lipides, considérés comme des messagers secondaires, sont capables d’interagir directement avec des domaines protéiques fonctionnels (PH [pleckstrin homology], FYVE [Fab-1, YGL023, Vps27, et EEA1], PX [phox], ENTH [epsin N-terminal homology], etc.). Sous l’effet de divers stimulus (hormones, facteurs de croissance, molécules adhésives, chimio-attractants, stress, etc.), la relocalisation et la régulation des PI-kinases et -phosphatases permettent de générer de façon rapide et plus ou moins transitoire des territoires membranaires enrichis ou appauvris en certains PI. Ces PI peuvent ainsi orienter et coordonner le recrutement de certaines protéines au niveau des membranes cellulaires où ils sont produits, pour réguler la dynamique cellulaire. Ces dernières années, l’utilisation des domaines protéiques d’interaction avec les PI pour localiser ces lipides par des approches de biologie cellulaire a suscité beaucoup d’intérêt. Il a ainsi été montré que si le PtdIns(4,5)P2 et le PtdIns(3,4,5)P3 sont majoritairement localisés dans la membrane plasmique [1, 2], le PtdIns3P se concentre plutôt dans les endosomes précoces [3] et le PtdIns4P est à la fois présent dans la membrane plasmique et dans l’appareil de Golgi [4]. Dans certaines cellules, la répartition des PI est essentielle pour maintenir la polarité cellulaire [5].  | Figure 1. Structure et métabolisme des phosphoinositides (PI). Le phosphatidylinositol (PtdIns) et les sept PI qui en découlent par le jeu des kinases (PIK) et des phosphatases (Ptase) spécifiques sont représentés. L’action de la phospholipase C sur le PtdIns(4,5)P2 et la production des seconds messagers classiques, l’inositol trisphosphate (Ins(1,4,5)P3) et le diacylglycérol (DAG) sont indiqués. Est illustrée également l’action des 3 classes de PI3K (I à III) et des 3-phosphatases de la famille des myotubularines (MTM et MTMR, dont plusieurs membres sont mutés dans des pathologies génétiques), ainsi que de la 4-phosphatase bactérienne IpgD. |
Tableau I.
| Phospho-inositides (PI) |
PI totaux (%) |
Localisation majeure |
Autre localisation |
Rôle |
Réf. |
| PtdIns |
80 % |
Synthétisé au niveau du réticulum endoplasmique |
|
Précurseur des polyphospho-inositides |
|
|
| PtdIns3P |
0,5 à 1,5 % |
Endosomes |
Phagosomes, membrane plasmique et noyau |
Fusion, tri et motilité endosomale, autophagie, formation du corps intermédiaire (cytokinèse), exo-cytose et signalisation cellulaire |
[3] |
|
| PtdIns4P |
10 % |
Appareil de Golgi |
Endosomes, trans-Golgi, membrane plasmique |
Recrutement de protéines impliquées dans le transport vésiculaire |
[4] |
|
| PtdIns5P |
0,1 à 0,5 % |
Membrane plasmique, appareil de Golgi, réticulum endoplasmique, noyau |
Endosomes |
Réarrangement du cytosquelette d’actine, transport vésiculaire, autophagie, expression génique |
[9] |
|
| PtdIns(3,4)P2
|
0,1 à 1 % |
Membrane plasmique, endosomes, réticulum endoplasmique |
|
Endocytose, réarrangement du cytosquelette d’actine, formation de podosomes |
[18] |
|
| PtdIns(3,5)P2
|
0,1 % à 1 % |
Endosomes, lysosomes |
|
Fission et fusion endosomales, transport rétrograde des endosomes vers le trans-Golgi |
[22] |
|
| PtdIns(4,5)P2
|
10 % |
Membrane plasmique |
Appareil de Golgi, endosomes, réticulum endoplasmique, noyau |
Endocytose, exocytose, trafic endosomal, phagocytose, assemblage cytosquelette d’actine, polarisation, adhésion, migration cellulaire, précurseur d’IP3, diacylglycérol et PtdIns(3,4,5)P3
|
[1] |
|
| PtdIns(3,4,5)P3
|
0,1 à 1 % |
Membrane plasmique |
Endo-membrane ? Noyau ? |
Survie, prolifération cellulaire, réarrangement du cytosquelette d’actine, expression génique
|
[2] |
Localisation et rôles des différents phosphoinositides (PI). |
Dans cette revue, nous aborderons le rôle des différents PI et les pathologies dans lesquelles les enzymes de leur métabolisme sont impliquées, notamment les cancers. Nous insisterons sur le rôle des PI3-kinases (phosphoinositide 3-kinases, PI3K) de classe I et sur leur ciblage thérapeutique qui commence à modifier la prise en charge de certaines pathologies cancéreuses, et pourrait compléter les stratégies thérapeutiques pour le traitement des thromboses artérielles. |
Les divers phosphoinositides : à chacun son rôle PtdIns3P On considère que le PtdIns3P [ 3], présent en faible quantité dans les cellules eucaryotes, est principalement généré à partir du PtdIns par les PI3K de classe II et de classe III. Il peut également être produit par déphosphorylation du PtdIns(3,4)P 2 par une 4-phosphatase de type Iα, et du PtdIns(3,5)P 2 par une 5-phosphatase appelée FIG4 (ou SAC3). Les PI3K de classe II et la 4-phosphatase de type Iα pourraient générer un pool de PtdIns3P à la membrane plasmique, alors que la PI3K de classe III (également nommée Vps34) et FIG4 seraient à l’origine du pool endosomal (Tableau I). Il est à noter que la PI3K de classe III joue également un rôle majeur dans l’autophagie, en produisant du PtdIns3P dans les autophagosomes. En dehors des cellules infectées par le parasite Plasmodium falciparum, pour lesquelles le taux de PtdIns3P augmente fortement, la littérature ne décrit pas de variation brusque et importante de la quantité de ce PI. Cependant, un certain nombre de stimulus cellulaires induisent une augmentation significative de PtdIns3P. Le maintien de son taux de base semble essentiel à l’homéostasie cellulaire, en particulier au trafic intracellulaire. Le PtdIns3P recrute des effecteurs protéiques via des domaines d’interaction de type FYVE (largement utilisés pour localiser ce lipide par imagerie) ou PX (domaine phox). En fonction de sa localisation, il régule ainsi : (1) le trafic intracellulaire (fusion des endosomes, recyclage des vésicules vers la membrane plasmique et le trans-Golgi, tri-vésiculaire vers le compartiment lysosomal) ; (2) la maturation de l’autophagosome, en recrutant des protéines de la famille Atg-18 (autophagy-related protein) (WIPI 1 et 2 [WD repeat domain phosphoinositide-interacting]) [6] ; (3) l’exocytose de granules d’insuline, par un mécanisme encore inconnu ; (4) l’activation de p40phox, un des composants de la NADPH (nicotinamide adénine dinucléotide phosphate) oxydase ; (5) la cytokinèse, lorsqu’il est produit au niveau du pont intercellulaire au cours de l’étape finale de la division cellulaire où il recrute la protéine centrosomale FYVE-CENT (FYVE domain-containing centrosomal protein) [7]. Il faut noter également que le PtdIns3P est un intermédiaire important dans la biosynthèse du PtdIns(3,5)P2, réalisée par la 5-kinase PIKfyve (phosphoinositide kinase, fyve finger containing). Le PtdIns3P a donc plusieurs rôles, mais c’est dans la régulation du trafic intracellulaire (voie endosomale et autophagie) que son implication est la mieux caractérisée. PtdIns4P Le PtdIns4P est l’un des PI les plus abondants [ 4]. Il est surtout présent dans l’appareil de Golgi et la membrane plasmique, mais on le retrouve aussi dans les compartiments endosomaux et le trans-Golgi. Chez les mammifères, sa production est assurée par deux PI4K de classe II (PI4KII α et β) et deux PI4K de classe III (PI4KIII α et β). La PI4KIIα est palmitoylée sur de multiples cystéines et se retrouve principalement dans le système endosomal, le trans-Golgi et la membrane plasmique. Au contraire, la PI4KIIβ est faiblement palmitoylée et principalement présente dans la membrane plasmique. Les mécanismes de régulation de ces kinases sont encore assez mal connus. La PI4KIIIα est présente dans la membrane plasmique, le réticulum endoplasmique et l’appareil de Golgi. La PI4KIIIβ est décrite comme l’enzyme responsable du pool de PtdIns4P produit dans l’appareil de Golgi, à la suite de son interaction avec la petite protéine G Arf1 ( ADP-ribosylation factor 1) et la protéine NCS-1 (neuronal calcium sensor-1). Elle est activée par phosphorylation et maintenue active par son interaction avec les protéines de la famille 14-3-3, qui empêchent sa déphosphorylation. Une autre enzyme impliquée dans le métabolisme du PtdIns4P est la 4-phosphatase SAC1. Elle est localisée au niveau du réticulum endoplasmique et de la membrane plasmique. Suite à une privation en nutriment, elle se relocalise dans l’appareil de Golgi pour diminuer le pool de PtdIns4P. Plus récemment, il a été montré que les protéines de la famille OSBP ( oxysterol-binding protein) étaient capables de transférer le PtdIns4P du trans-Golgi et de la membrane plasmique vers le réticulum endoplasmique de façon dépendante du cholestérol. Le PtdIns4P régule le transport vésiculaire de l’appareil de Golgi vers la membrane plasmique et les compartiments endosomaux. Il permet ainsi d’assurer : (1) la localisation de certaines enzymes résidentes de l’appareil de Golgi ; (2) la formation de vésicules, en créant des déformations membranaires [8] ; (3) le tri des protéines destinées aux endosomes, en interagissant avec la protéine adaptatrice de la clathrine, GGA2 (Golgi-associated, gamma adaptin ear containing, AFR binding protein 2), qui, elle-même, interagit avec Arf1 (ADP-ribosylation factor 1) pour un recrutement efficace ; (4) le transport des protéines du trans-Golgi vers la membrane plasmique, ce qui implique le recrutement et l’activation de Sec2 (un facteur d’échange des protéines Rab). En outre, le PtdIns4P est un intermédiaire clé dans la biosynthèse du PtdIns(4,5)P2 au niveau de la membrane plasmique. PtdIns5P Le PtdIns5P est l’un des derniers PI à avoir été identifié [ 9]. Il est présent en faible quantité dans les cellules quiescentes. Ce lipide peut être synthétisé à partir du PtdIns par la 5-kinase PIKfyve, mais également par déphosphorylation du PtdIns(3,5)P 2 par les 3-phosphatases de la famille des myotubularines. Bien que cela n’ait jamais été clairement démontré dans les cellules de mammifères, il peut également être généré par des 4-phosphatases de type II, en agissant sur le PtdIns(4,5)P 2. En revanche, il a été clairement montré que le PtdIns5P est phosphorylé spécifiquement par les PIPK de type II pour produire du PtdIns(4,5)P 2. Le taux de PtdIns5P peut augmenter suite à certains stimulus (thrombine, insuline, FGF-1 [ fibroblast growth factor 1], certains oncogènes, stress osmotique, H 2O 2, ultra-violets, infection bactérienne). Il est localisé dans la membrane plasmique et dans les compartiments intracellulaires (incluant les endosomes, le réticulum endoplasmique et l’appareil de Golgi), mais son rôle a d’abord été étudié dans le noyau où son taux augmente lors d’un stress cellulaire. Dans le noyau, le PtdIns5P (dont la localisation et la présentation physicochimique restent à préciser) peut moduler l’expression des gènes, en interagissant avec des protéines impliquées dans le remodelage de la chromatine. Il interagit en particulier avec le domaine PHD ( plant homeodomain) d’ING2 ( inhibitor of growth family member 2), qui peut être utilisé comme sonde pour localiser ce lipide par imagerie. Outre son rôle intranucléaire, nous avons montré en 2002, pour la première fois, que le facteur de virulence de la bactérie pathogène Shigella flexneri, IpgD ( invasion plasmid gene D) était une puissante PtdIns(4,5)P 2 4-phosphatase, produisant une quantité importante de PtdIns5P dans la cellule hôte lors de l’infection. Le PtdIns5P généré au foyer d’entrée de la bactérie, au niveau de la membrane plasmique, modifie ainsi la dynamique membranaire et les signaux intracellulaires de la cellule hôte [ 10]. Il induit des regroupements de récepteurs, en particulier du récepteur à l’EGF ( epidermal growth factor) qui s’active indépendamment de son ligand et qui n’est plus dégradé par les lysosomes. Cela contribue à des signaux de survie soutenus favorisant l’infection bactérienne [ 11, 12]. De plus, cette augmentation du taux de PtdIns5P dans la membrane plasmique entraîne la fermeture d’hémi-canaux-connexines qui, normalement, libèrent de l’ATP dans le milieu extracellulaire pour déclencher une réaction inflammatoire dirigée contre le pathogène [ 13]. La bactérie pathogène utilise ainsi le PtdIns5P pour détourner les réponses de la cellule hôte à son profit. En dehors de cette situation pathologique, le rôle du PtdIns5P dans la physiologie cellulaire reste encore peu connu. Il a été montré que l’engagement du récepteur des lymphocytes T (TCR) induit une augmentation du taux de PtdIns5P, qui recrute des protéines de la famille DOK (downstream of tyrosine kinases) favorisant leur phosphorylation et activant ainsi une boucle de rétrocontrôle négatif de la signalisation [14]. La stimulation d’adipocytes par l’insuline induit un pic de production de PtdIns5P, qui entraîne la perte des fibres de stress et l’accélération de la translocation du transporteur de glucose Glut4 dans la membrane plasmique. Récemment, nous avons montré que le PtdIns5P était en fait capable de coordonner la dynamique membranaire et celle du cytosquelette d’actine. En effet, une augmentation de PtdIns5P consécutive à l’expression ectopique de la phosphatase bactérienne IpgD, à une stimulation par le FGF-1 ou à l’expression de l’oncogène NPM-ALK (nucleophosmin–anaplastic lymphoma kinase) conduit au recrutement et à l’activation du facteur d’échange (GEF, guanine nucleotide exchange factor) Tiam1 par une interaction directe du lipide avec le domaine PH situé dans la région carboxy-terminale du facteur d’échange. Cette interaction conduit à l’activation de la GTPase Rac1 et à une forte dynamique membranaire associée à la perte des fibres de stress, pour induire la mobilité et l’invasion cellulaire [15]. Le PtdIns5P module également le trafic intracellulaire en empêchant la dégradation lysosomale, notamment par le recrutement de TOM1 (target of myb1) sur les endosomes [16], et en favorisant le recyclage vésiculaire. Il régule aussi l’autophagie indépendante de la voie canonique impliquant Vps34 et le PtdIns3P [17]. Actuellement, le PtdIns5P, par ses capacités à coordonner plusieurs mécanismes cellulaires, suscite beaucoup d’intérêt. PtdIns(3,4)P2 Le PtdIns(3,4)P 2 serait produit lors d’une stimulation cellulaire au niveau de la membrane plasmique par la déphosphorylation du PtdIns(3,4,5)P 3, réalisée par les 5-phosphatases SHIP ( Src homology 2 (SH2) domain–containing inositol-5-phosphatase) 1 et 2 et SKIP ( skeletal muscle and kidney enriched inositol phosphatase), dont l’expression varie en fonction des tissus [ 18]. Une autre voie de biosynthèse pourrait impliquer les PI3K de classe II et leur substrat, le PtdIns4P, pour contrôler l’endocytose dépendant de la clathrine [ 19]. Les rôles du PtdIns(3,4)P 2 sont encore assez mal connus et seuls quelques effecteurs ont été identifiés [ 20]. Certaines publications lui attribuent cependant des fonctions importantes dans différents processus cellulaires, en plus de son rôle dans l’endocytose. Ainsi, en interagissant avec le domaine PH des protéines TAPP ( tandem PH [pleckstrin homology]-domain-containing protein) 1 et 2, il pourrait réguler négativement les voies de signalisation de l’insuline. Le PtdIns(3,4)P 2 produit par SHIP1 et SHIP2 serait également impliqué dans l’endocytose de récepteurs couplés aux protéines G de façon dépendante de leurs ligands. Il recrute la lamellipodine en interagissant avec son domaine PH, qui, à son tour, recrute l’endophiline pour médier l’endocytose [ 21]. Cette interaction avec la lamellipodine serait aussi impliquée dans la formation des lamellipodes. Enfin, ce lipide pourrait également contribuer à la formation des podosomes. PtdIns(3,5)P2 Le PtdIns(3,5)P 2 est peu abondant [ 22]. Il est synthétisé à partir du PtdIns3P, majoritairement par la 5-kinase PIKfyve. PIKfyve fonctionne au sein d’un complexe protéique appelé PAS (pour PIKfyve/ArPIKfyve/SAC3), qui possède la capacité de produire du PtdIns(3,5)P 2 de façon réversible, puisque l’activité 5-phosphatase de SAC3 (ou FIG4 chez les mammifères) hydrolyse le PtdIns(3,5)P 2 en PtdIns3P. Ce complexe de kinases/phosphatase est localisé au niveau des endosomes, notamment par l’interaction du domaine FYVE de PIKfyve avec le PtdIns3P. Une autre voie importante du métabolisme du PtdIns(3,5)P 2 met en jeu les 3-phosphatases de la famille des myotubularines qui le transforment en PtdIns5P. En invalidant et/ou inhibant les enzymes du complexe PAS, il a été montré que ces enzymes et le PtdIns(3,5)P2 contrôlent l’homéostasie du trafic endosomal. Le PtdIns(3,5)P2 pourrait, en effet, réguler la fission et la fusion endosomale, le transport rétrograde des endosomes vers le trans-Golgi, ainsi que le tri vésiculaire vers l’endosome tardif. Ces effets sont transmis par l’intermédiaire d’effecteurs possédant, pour la majorité, un domaine β-propeller2 capable de lier ce lipide [23, 24]. Cependant, le manque d’outils pour localiser le PtdIns(3,5)P2 et pour bloquer spécifiquement ses fonctions, limite l’étude de son rôle. Les données actuelles suggèrent que PtdIns3P, PtdIns5P et PtdIns(3,5)P2 sont dans des voies métaboliques fortement reliées. L’interconversion entre ces lipides pourrait représenter la base des mécanismes de régulation et de coordination du trafic vésiculaire et de la dynamique du cytosquelette. PtdIns(4,5)P2 Aussi abondant que le PtdIns4P, ce PI est majoritairement présent dans le feuillet interne de la membrane plasmique [ 1], mais il est aussi présent dans l’appareil de Golgi, les endosomes, le réticulum endoplasmique et le noyau. Six kinases différentes contrôlent sa synthèse de façon spatiotemporelle. Les PIP5K de type I (α, β, γ), qui utilisent le PtdIns4P comme substrat, en produisent la majorité. Les PIP4K de type II (α, β, γ) phosphorylent le PtdIns5P en position 4 pour produire un pool quantitativement mineur, mais probablement très localisé de PtdIns(4,5)P 2. Historiquement, les premières publications concernant ce lipide l’ont présenté comme le substrat préférentiel des phospholipases C (PLC) qui, lors d’une activation cellulaire, produisent les seconds messagers classiques que sont l’inositol trisphosphate (Ins[1,4,5]P3) et le diacylglycérol (DAG). Il a ensuite été montré que les PI3K de classe I utilisent également le PtdIns(4,5)P2 comme substrat pour produire le second messager PtdIns(3,4,5)P3. Enfin, il est à présent bien établi que le PtdIns(4,5)P2 interagit directement avec certaines protéines par l’intermédiaire de domaines spécifiques (PH, ENTH, FERM [four-point-one, ezrin, radixin, moesin], etc.). Par le biais de ces interactions, il module plusieurs régulateurs de l’organisation du cytosquelette d’actine, mais également certains canaux ioniques. Le PtdIns(4,5)P2 est donc impliqué dans de nombreuses fonctions biologiques. PtdIns(3,4,5)P3 Second messager lipidique par excellence, le PtdIns(3,4,5)P 3 [ 2], qui est présent à l’état de trace dans les cellules normales quiescentes, est produit de façon rapide et transitoire suite à l’activation des PI3K de classe I, lors de l’engagement de récepteurs membranaires. Le PtdIns(3,4,5)P 3 est majoritairement produit dans le feuillet interne de la membrane plasmique où il recrute et permet l’activation de protéines à domaine PH dont la mieux caractérisée est la protéine kinase Akt [ 25]. Parmi les autres protéines à domaine PH recrutées par ce lipide, on note des facteurs d’échange (GEF), des GTPases Arf (ARNO et GRP1) ou Rac (PREX1 et Vav) [ 26], des tyrosine-kinases comme Btk ( Bruton tyrosine kinase) et des protéines adaptatrices telles que GAB1 ( GRB2-associated-binding protein 1). Certains de ces domaines PH sont d’ailleurs utilisés pour localiser le PtdIns(3,4,5)P 3 par imagerie. En résumé, ce lipide est fortement impliqué dans la formation et l’organisation de complexes de signalisation intracellulaire. Il contribue à réguler la prolifération et la survie cellulaire, mais également l’homéostasie du glucose, la polarisation [ 27] et les processus de mobilité cellulaires [ 28]. |
Les enzymes du métabolisme des phosphoinositides (PI) comme cibles thérapeutiques : focus sur les PI3-kinases De nombreuses enzymes du métabolisme des PI présentent des mutations perte ou gain de fonction directement impliquées dans des pathologies humaines (Tableau II). Certaines maladies génétiques, comme les myopathies myotubulaires ou la neuropathie de Charcot-Marie-Tooth3, impliquent les PtdIns3P/PtdIns(3,5)P2 3-phosphatases de la famille des myotubularines [29]. Le syndrome de Lowe, ou syndrome oculo-cérébro-rénal, et la dystrophie cornéenne mouchetée de François et Neetens, sont liés à des mutations des gènes codant respectivement la PtdIns(4,5)P2 5-phosphatase OCRL (oculocerebrorenal syndrome of Lowe) et la 5-kinase PIKFYVE. D’autre part, l’implication des PI3K de classe I et de la PtdIns(3,4,5)P3 3-phosphatase PTEN (phosphatase and tensin homologue) dans les pathologies cancéreuses est aujourd’hui bien documentée [30, 31]. L’activité PI3K a été mise à jour par L. Cantley et ses collaborateurs à la fin des années 1980 comme étant associée à une oncoprotéine virale [32, 33]. Une trentaine d’années plus tard, les inhibiteurs de PI3K font leur entrée en clinique. L’idelalisib, inhibiteur sélectif de la PI3Kδ de classe I, vient en effet d’être approuvé par la FDA (Food and drug administration) aux États-Unis pour le traitement de la leucémie lymphoïde chronique (LLC) et du lymphome non hodgkinien (LNH) folliculaire.
Tableau II.
| Maladies |
Gènes impliqués (protéines) |
Modifications |
| Syndrome de Lowe |
OCRL
|
Mutation |
|
| Maladie de Dent |
OCRL
|
Mutation |
|
| Syndrome des contractures congénitales létales type 1 (LCCS3) |
PIP5K1C (PtdIns[4]P-5-kinase 1 gamma)
|
Mutation |
|
| Myopathie congénitale myotubulaire |
MTM1 MTMR14
|
Mutation |
|
| Maladie de Charcot-Marie-Tooth |
MTMR2 MTMR5 MTMR13 FIG4
|
Mutations |
|
| Dystrophie cornéenne mouchetée de François et Neetens |
PIP5K3 (PIKFYVE)
|
Mutation |
|
| Syndrome de Cowden/cancer |
PTEN
|
Mutation |
|
| Cancer |
PIK3CA (PI3K alpha de classe I)
|
Mutations de p110α, amplification |
|
| Ataxie apraxie oculo-motrice type 3 |
PIK3R5 (PI3K sous-unité p101)
|
Mutation |
|
| Agammaglobulinémie |
PIK3R1 (PI3K sous-unité p85α)
|
Mutation causant la délétion du gène |
|
| Syndrome de la PI3Kδ activée |
(PIK3CD) PI3K sous-unité p110δ |
Mutation activatrice |
|
| Syndrome de mégalencéphalie |
PIK3R2 (PI3K sous-unité p85β) / PIK3CA (PI3K sous-unité p110α)
|
Mutation |
|
| Cancer (leucémies : LAM, LAL) |
INPP5D (SHIP1)
|
Mutation |
|
| Diabète type 2 |
INPPL1 (SHIP2)
|
Délétion 16 pb |
|
| Opsismodysplasia |
INPPL1 (SHIP2)
|
Mutation |
|
| Syndrome de Morm et de Joubert |
INPP5E
|
Mutation |
|
| Syndrome de Down/maladie de parkinson |
SYNJ1 (synaptojanin 1)
|
Amplification |
|
| Syndrome segmental overgrowth
|
PIK3CA (PI3K alpha de classe I)
|
Mutation |
Enzymes du métabolisme des phosphoinositides et pathologies [ 54, 55]. |
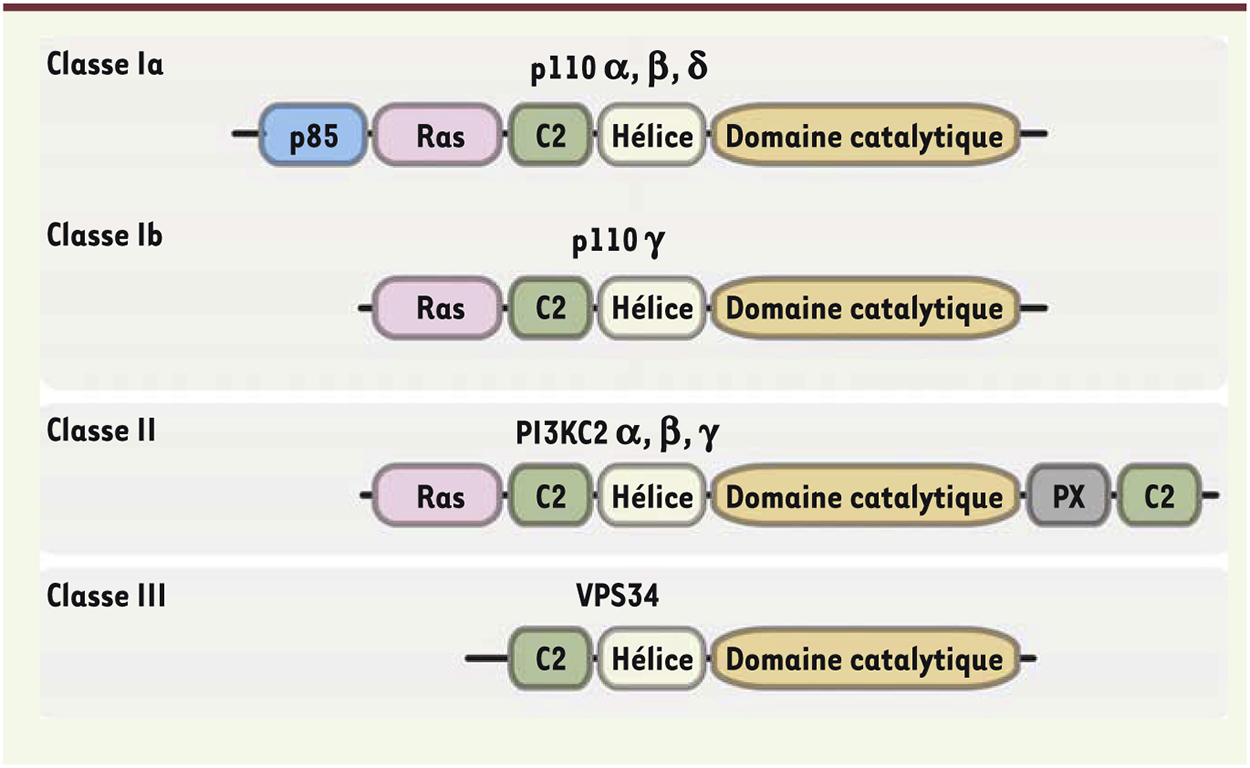
Nous nous focaliserons ici sur le rôle et le ciblage pharmacologique des PI3K de classe I dans les pathologies cancéreuses et dans les processus de thrombose artérielle. Les huit PI3K du génome humain sont regroupées en trois classes, en fonction de leurs caractéristiques structurales, de leur mécanisme de régulation et de leur substrat (Figure 2). Les quatre PI3K de classe I produisent du PtdIns(3,4,5)P3 lors d’une activation cellulaire. Ce sont des enzymes hétérodimériques composées d’une sous-unité catalytique de 110 kDa (p110) et d’une sous-unité régulatrice. Elles sont sous-divisées en classe IA et IB. Il existe trois sous-unités catalytiques dans la classe IA (p110α, p110β, p110δ), qui interagissent avec les sous-unités régulatrices p85α, p85β, p55γ, p55α et p50α. Dans la classe IB, une sous-unité catalytique (p110γ) s’associe avec les sous-unités régulatrices p101, p87 ou p84. Les PI3-kinases de classe IA sont activées par des récepteurs à activité tyrosine-kinase via le recrutement de leur sous-unité régulatrice qui contient des domaines SH2 (Src homology 2). La PI3K de classe IB est activée par les sous-unités β/γ des protéines G hétérotrimériques [34, 35]. La GTPase Ras est capable d’amplifier l’activation des PI3K de classe I, en se liant directement à la sous-unité catalytique. À noter que la PI3Kβ de classe IA présente la particularité d’être activée à la fois par les sous-unités β/γ des protéines G hétérotrimériques (qui interagissent directement avec p110β) et par les récepteurs à activité tyrosine kinase.  | Figure 2. Les trois classes de PI3K chez les mammifères. Seules les sous-unités catalytiques des PI3K sont montrées. Les domaines d’interaction protéiques ou lipidiques et le domaine catalytique sont indiqués. p85 : sous-unité régulatrice p85 ; Ras : domaine de liaison à la protéine Ras ; C2 : domaine de liaison aux phospholipides ; PX : domaine phox (liaison aux phosphoinositides [PI]). |
La PI3Kα de classe I dans les pathologies cancéreuses La PI3Kα est ubiquitaire et joue un rôle majeur dans les processus de prolifération et de survie cellulaire, ainsi que dans la signalisation du récepteur de l’insuline. Elle est devenue une cible en oncologie, car des mutations gain de fonction dans le gène PIK3CA qui code cette enzyme sont fréquemment retrouvées dans les cancers solides chez l’homme [ 36]. Des travaux expérimentaux utilisant des lignées cellulaires ou des souris génétiquement modifiées ont démontré que deux des mutations activatrices les plus fréquemment retrouvées (E545K et H1047R) sont suffisantes pour entraîner une augmentation du niveau de PtdIns(3,4,5)P 3 intracellulaire et transformer les cellules [ 37]. De plus, la présence de ces mutations sensibilise les cellules aux inhibiteurs de la PI3Kα ou de la voie mTORC1 ( mammalian target of rapamycin complex 1). En outre, indépendamment des mutations, la PI3Kα est activée par de nombreux oncogènes et les mutations perte de fonction de la phosphatase PTEN entraînent une suractivation de la voie mTORC1. Des inhibiteurs sélectifs de la PI3Kα sont en essai clinique pour le traitement de cancers solides chez des patients présentant une mutation activatrice de cette kinase. L’effet de ces inhibiteurs en monothérapie pourrait être relativement limité, mais leur association à d’autres molécules utilisées en chimiothérapie ou ciblant spécifiquement des acteurs comme la poly(ADP-ribose) polymérase (PARP) pourrait donner des résultats très intéressants (L. Cantley, communication personnelle). Les inhibiteurs de la PI3Kα pourraient également être utiles dans le traitement de pathologies héréditaires rares liées à des mutations somatiques de PIK3CA (overgrowth syndromes [38]). Enfin, dans certaines conditions, des inhibiteurs pan-PI3K de classe I pourraient permettre d’éviter les phénomènes de redondance au sein de cette classe de lipide kinases [39]. La PI3Kδ de classe I dans les hémopathies B malignes La PI3Kδ est principalement exprimée dans les leucocytes où elle joue un rôle clé en aval du récepteur pour l’antigène ( B cell receptor, BCR) dans les lymphocytes B [ 40]. La signalisation du BCR fait appel à des mécanismes de phosphorylation sur tyrosine des motifs ITAM ( immunoreceptor tyrosine-based activation motifs) de la portion intracytoplasmique de CD79, conduisant à la formation de complexes multiprotéiques 4,. Les tyrosine-kinases Syk et Btk, ainsi que la PI3Kδ, sont des éléments clés de la signalisation du BCR. La PI3Kδ joue également un rôle important en aval des récepteurs des cytokines/chimiokines et des récepteurs d’adhésion, qui contribuent fortement à la régulation de la prolifération, de la différenciation, de la migration et de la survie des cellules B. La leucémie lymphoïde chronique (LLC), leucémie la plus fréquente en Europe occidentale, est caractérisée par une accumulation de cellules B (positives pour le CD5) dans le sang, la moelle et les organes lymphoïdes secondaires. L’activation chronique de la voie de signalisation du BCR a un rôle majeur dans la physiopathologie et la progression de cette hémopathie maligne, mais également dans les lymphomes non hodgkiniens (LNH) indolents à cellules B. Il est rare d’observer des mutations dans les gènes codant pour les PI3K de classe I dans la LLC et les LNH indolents. De même, l’incidence de mutations perte de fonction du gène codant pour la phosphatase PTEN est faible dans ces pathologies (excepté pour le LNH du manteau 5). De nombreuses études ont montré que, ex vivo, l’inhibition de la PI3Kδ affecte la prolifération et la survie des cellules de patients atteints de LLC [ 41]. Les premiers essais cliniques avec l’inhibiteur sélectif de PI3Kδ (le CAL-101 ou idelalisib) chez des patients en rechute, ont montré une réponse très encourageante et durable, avec une sortie rapide des cellules B malignes des organes lymphoïdes, accompagnée d’une hyperlymphocytose transitoire [ 42, 43]. Il est important de souligner que l’arrêt du traitement entraîne une reprise de la pathologie. L’inhibition de la PI3Kδ diminuerait la signalisation du BCR, mais également la production des chimiokines et la réponse des cellules B malignes aux chimiokines, affectant ainsi leur migration et leur ancrage dans la niche protectrice fournie par les tissus lymphoïdes. La sortie de ces cellules B de la niche diminue les signaux de prolifération et de survie, entraînant leur mort progressive par apoptose. Lorsque l’idelalisib est associé au rituximab (un anticorps monoclonal anti-CD20 6 utilisé dans le traitement de ces pathologies), la destruction de ces cellules est accélérée. Les effets secondaires de l’idelalisib sont apparus assez tolérables pour envisager un traitement au long cours. En France, l’idelalisib fait l’objet d’une autorisation temporaire d’utilisation de cohorte pour le traitement de la LLC en rechute et du LNH folliculaire réfractaire, le produit étant utilisé en monothérapie ou en association. Dans l’avenir, il est concevable que les inhibiteurs de la PI3Kδ soient également utilisés dans le traitement de certaines maladies immunes, comme le syndrome de la PI3Kδ activée [ 44]. La PI3Kβ de classe I dans les plaquettes et les pathologies thrombotiques Les plaquettes sanguines jouent un rôle clé dans les processus d’hémostase et de thrombose. Elles expriment toutes les isoformes de PI3K de classe I mais c’est la PI3Kβ de classe I qui joue le rôle le plus important [ 45]. Un inhibiteur sélectif de la PI3Kβ (le TGX-221) a montré un potentiel anti-thrombotique dans des tests ex vivo en condition de flux artériel et dans des modèles de thromboses expérimentales in vivo chez le rat [ 46]. L’utilisation de souris, exprimant une p110β inactive ou ne l’exprimant plus sélectivement dans les mégacaryocytes et les plaquettes, a permis de montrer le rôle de cette PI3K en aval de différents récepteurs à 7 domaines transmembranaires couplés aux protéines G (récepteurs de la thrombine, du thromboxane A2 ou de l’ADP), de récepteurs impliquant des motifs ITAM et des tyrosine-kinases (récepteur GPVI du collagène) et des intégrines αIIbβ3 et α2β1 [ 47- 49]. L’une des boucles d’amplification de l’activation plaquettaire fait intervenir l’ADP (sécrété par les plaquettes dès le début de leur activation), dont le récepteur purinergique P2Y12 est couplé à Gi (protéine G inhibitrice). Les sous-unités β/γ de Gi interagissent avec p110β, ce qui potentialise l’activation de la PI3Kβ. Cette boucle d’amplification, caractéristique des plaquettes, pourrait expliquer le rôle prédominant de la PI3Kβ dans ce modèle cellulaire. Le PtdIns(3,4,5)P 3 produit contribue au recrutement et à l’activation de plusieurs protéines à domaine PH telles qu’Akt, Btk et PLCγ2. Grâce à ces modèles de souris il a été clairement montré que l’inhibition de la PI3Kβ plaquettaire a une action antithrombotique sans effet sur l’hémostase primaire et sans augmentation du risque de saignement [ 50]. De même, un essai clinique de phase I réalisé avec un nouvel inhibiteur sélectif de PI3Kβ (AZD6482) ne montre pas d’augmentation du risque hémorragique et indique une bonne tolérance du composé chez l’homme [ 51]. Les tests réalisés ex vivo confirment les résultats précédemment obtenus et soulignent l’intérêt de ce type d’inhibiteur dans la prévention des thromboses artérielles. Cependant, nous avons récemment montré que, dans des conditions de flux artériel pathologique rencontrées lors d’une sténose artérielle ou lors de la croissance d’un thrombus devenant partiellement occlusif, l’inhibition de PI3Kβ provoque une fragmentation du thrombus formé, avec un risque potentiel d’embolisation distale susceptible d’occlure des micro-vaisseaux en aval [ 52, 53]. En résumé, le ciblage de la PI3Kβ dans une stratégie de prévention des thromboses artérielles présente un certain nombre d’avantages (risque de saignement limité, effets secondaires tolérables, effets rapides et réversibles sur les thromboses artérielles). Il sera toutefois essentiel de déterminer si les fragments de thrombus libérés dans certaines conditions sont potentiellement dangereux ou s’ils sont susceptibles de se disloquer sans entraîner de phénomènes ischémiques en aval. |
Les phosphoinositides constituent une famille de lipides qui contribue fortement à l’assemblage et à l’organisation spatio-temporelle des complexes multiprotéiques, permettant de coordonner le maintien de l’intégrité de territoires cellulaires, l’organisation des voies de signalisation, la régulation du trafic intracellulaire, la dynamique du cytosquelette et la polarité cellulaire. Un ensemble de kinases et de phosphatases spécifiques permet de contrôler précisément la production et l’interconversion des PI. La perte de ce contrôle strict (à la suite de mutation, de surexpression ou de perte d’expression de certaines des enzymes de leur métabolisme) est à l’origine de différentes pathologies. Il est donc important de caractériser les mécanismes de régulation de ces kinases et phosphatases et de poursuivre l’analyse du rôle des différents PI. L’arrivée récente en clinique des inhibiteurs de PI3K de classe I et le développement actuel de modulateurs des phosphatases illustrent à quel point les avancées réalisées dans la compréhension des mécanismes de signalisation lipidique peuvent améliorer la prise en charge de certaines pathologies. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ce travail a bénéficié du soutien de l’Agence nationale de la recherche (ANR-13-BSV2-0004-01), de la fondation ARC pour la recherche sur le cancer, de l’Inserm et de la Fondation pour la recherche médicale. Nos remerciements s’adressent à l’ensemble de l’équipe « Production et fonctions plaquettaires, signalisation et phosphoinositides » de l’unité Inserm 1048 (I2MC). Bernard Payrastre est membre sénior de l’Institut universitaire de France. Nous nous excusons auprès des auteurs dont le travail n’est pas cité faute d’espace.
|
Footnotes |
1.
Sun Y, Thapa N, Hedman AC, Anderson RA. Phosphatidylinositol 4,5-bisphosphate: targeted production and signaling . Bioessays. 2013; ; 35 : :513.–522. 2.
Salamon RS, Backer JM. Phosphatidylinositol-3,4,5-trisphosphate: tool of choice for class I PI 3-kinases . Bioessays. 2013; ; 35 : :602.–611. 3.
Schink KO, Raiborg C, Stenmark H. Phosphatidylinositol 3-phosphate, a lipid that regulates membrane dynamics, protein sorting and cell signalling . Bioessays. 2013; ; 35 : :900.–912. 4.
De Matteis MA, Wilson C, D’Angelo G. Phosphatidylinositol-4-phosphate: the Golgi and beyond . Bioessays. 2013; ; 35 : :612.–622. 5.
Gassama-Diagne A, Payrastre B. Phosphoinositide signaling pathways: promising role as builders of epithelial cell polarity . Int Rev Cell Mol Biol. 2009; ; 273 : :313.–343. 6.
Proikas-Cezanne T, Takacs Z, Donnes P, Kohlbacher O. WIPI proteins: essential PtdIns3P effectors at the nascent autophagosome . J Cell Sci. 2015; ; 128 : :207.–217. 7.
Sagona AP, Nezis IP, Pedersen NM, et al.
PtdIns(3)P controls cytokinesis through KIF13A-mediated recruitment of FYVE-CENT to the midbody . Nat Cell Biol. 2010; ; 12 : :362.–371. 8.
D’Angelo G, Vicinanza M, Di Campli A, De Matteis MA. The multiple roles of PtdIns(4)P - not just the precursor of PtdIns(4,5)P2 . J Cell Sci. 2008; ; 121 : :1955.–1963. 9.
Viaud J, Boal F, Tronchere H, et al. Phosphatidylinositol 5-phosphate: a nuclear stress lipid and a tuner of membranes and cytoskeleton dynamics . Bioessays. 2014; ; 36 : :260.–272. 10.
Niebuhr K, Giuriato S, Pedron T, et al. Conversion of PtdIns(4,5)P(2) into PtdIns(5)P by the S.flexneri effector IpgD reorganizes host cell morphology . EMBO J. 2002; ; 21 : :5069.–5078. 11.
Pendaries C, Tronchere H, Arbibe L, et al. PtdIns5P activates the host cell PI3-kinase/Akt pathway during Shigella flexneri infection . EMBO J. 2006; ; 25 : :1024.–1034. 12.
Ramel D, Lagarrigue F, Pons V, et al. Shigella flexneri infection generates the lipid PI5P to alter endocytosis and prevent termination of EGFR signaling . Sci Signal. 2011;; 4 : :ra61.. 13.
Puhar A, Tronchere H, Payrastre B, et al. A Shigella effector dampens inflammation by regulating epithelial release of danger signal ATP through production of the lipid mediator PtdIns5P . Immunity. 2013; ; 39 : :1121.–1131. 14.
Guittard G, Gerard A, Dupuis-Coronas S, et al. Cutting edge: Dok-1 and Dok-2 adaptor molecules are regulated by phosphatidylinositol 5-phosphate production in T cells . J Immunol. 2009; ; 182 : :3974.–3978. 15.
Viaud J, Lagarrigue F, Ramel D, et al. Phosphatidylinositol 5-phosphate regulates invasion through binding and activation of Tiam1 . Nat Commun. 2014; ; 5 : :4080.. 16.
Boal F, Mansour R, Gayral M, et al. TOM1 is a PI5P effector involved in the regulation of endosomal maturation . J Cell Sci. 2015; ; 128 : :815.–827. 17.
Vicinanza M, Korolchuk VI, Ashkenazi A, et al. PI(5)P regulates autophagosome biogenesis . Mol Cell. 2015; ; 57 : :219.–234. 18.
Xie J, Erneux C, Pirson I. How does SHIP1/2 balance PtdIns(3,4)P2 and does it signal independently of its phosphatase activity? Bioessays. 2013; ; 35 : :733.–743. 19.
Posor Y, Eichhorn-Gruenig M, Puchkov D, et al. Spatiotemporal control of endocytosis by phosphatidylinositol-3,4-bisphosphate . Nature. 2013; ; 499 : :233.–237. 20.
Li H, Marshall AJ. Phosphatidylinositol (3,4) bisphosphate-specific phosphatases and effector proteins: a distinct branch of PI3K signaling . Cell Signal. 2015; ; 27 : :1789.–1798. 21.
Boucrot E, Ferreira AP, Almeida-Souza L, et al. Endophilin marks and controls a clathrin-independent endocytic pathway . Nature. 2015; ; 517 : :460.–465. 22.
McCartney AJ, Zhang Y, Weisman LS. Phosphatidylinositol 3,5-bisphosphate: low abundance, high significance . Bioessays. 2014; ; 36 : :52.–64. 23.
Thumm M, Busse RA, Scacioc A, et al. It takes two to tango: PROPPINs use two phosphoinositide-binding sites . Autophagy. 2013; ; 9 : :106.–107. 24.
Krick R, Busse RA, Scacioc A, et al. Structural and functional characterization of the two phosphoinositide binding sites of PROPPINs, a beta-propeller protein family . Proc Natl Acad Sci USA. 2012; ; 109 : :E2042.–E2049. 25.
Vasudevan KM, Garraway LA. AKT signaling in physiology and disease . Curr Top Microbiol Immunol. 2010; ; 347 : :105.–133. 26.
Viaud J, Gaits-Iacovoni F, Payrastre B. Regulation of the DH-PH tandem of guanine nucleotide exchange factor for Rho GTPases by phosphoinositides . Adv Biol Regul. 2012; ; 52 : :303.–314. 27.
Gassama-Diagne A, Yu W, ter Beest M, et al. Phosphatidylinositol-3,4,5-trisphosphate regulates the formation of the basolateral plasma membrane in epithelial cells . Nat Cell Biol. 2006; ; 8 : :963.–970. 28.
Lemmon MA, Ferguson KM, Abrams CS. Pleckstrin homology domains and the cytoskeleton . FEBS Lett. 2002; ; 513 : :71.–76. 29.
Tronchère H, Laporte J, Payrastre B. Myotubularins and associated neuromuscular diseases . Clin Lipidol. 2012; ; 7 : :151.–162. 30.
Fruman DA, Rommel C. PI3K and cancer: lessons, challenges and opportunities . Nat Rev Drug Discov. 2014; ; 13 : :140.–156. 31.
Leevers SJ, Vanhaesebroeck B, Waterfield MD. Signalling through phosphoinositide 3-kinases: the lipids take centre stage . Curr Opin Cell Biol. 1999; ; 11 : :219.–225. 32.
Whitman M, Downes CP, Keeler M, et al. Type I phosphatidylinositol kinase makes a novel inositol phospholipid, phosphatidylinositol-3-phosphate . Nature. 1988; ; 332 : :644.–646. 33.
Cantley LC. The phosphoinositide 3-kinase pathway . Science. 2002; ; 296 : :1655.–1657. 34.
Hawkins PT, Anderson KE, Davidson K, Stephens LR. Signalling through class I PI3Ks in mammalian cells . Biochem Soc Trans. 2006; ; 34 : :647.–662. 35.
Vanhaesebroeck B, Guillermet-Guibert J, Graupera M, Bilanges B. The emerging mechanisms of isoform-specific PI3K signalling . Nat Rev Mol Cell Biol. 2010; ; 11 : :329.–341. 36.
Samuels Y, Wang Z, Bardelli A, et al. High frequency of mutations of the PIK3CA gene in human cancers . Science. 2004; ; 304 : :554.. 37.
Zhao L, Vogt PK. Helical domain and kinase domain mutations in p110alpha of phosphatidylinositol 3-kinase induce gain of function by different mechanisms . Proc Natl Acad Sci USA. 2008; ; 105 : :2652.–2657. 38.
Mirzaa G, Conway R, Graham JMJr, Dobyns WB. PIK3CA-related segmental overgrowth. In: Pagon RA, Adam MP, Ardinger HH, et al., eds. GeneReviews(R) . Seattle (WA): : University of Washington; , 1993.
39.
Cescon DW, Gorrini C, Mak TW. Breaking up is hard to do: PI3K isoforms on the rebound . Cancer Cell. 2015; ; 27 : :5.–7. 40.
Jou ST, Carpino N, Takahashi Y, et al. Essential, nonredundant role for the phosphoinositide 3-kinase p110delta in signaling by the B-cell receptor complex . Mol Cell Biol. 2002; ; 22 : :8580.–8591. 41.
Fruman DA, Rommel C. PI3Kdelta inhibitors in cancer: rationale and serendipity merge in the clinic . Cancer Discov. 2011; ; 1 : :562.–572. 42.
Gopal AK, Kahl BS, de Vos S, et al. PI3Kdelta inhibition by idelalisib in patients with relapsed indolent lymphoma . N Engl J Med. 2014; ; 370 : :1008.–1018. 43.
Furman RR, Sharman JP, Coutre SE, et al. Idelalisib and rituximab in relapsed chronic lymphocytic leukemia . N Engl J Med. 2014; ; 370 : :997.–1007. 44.
Walsh CM, Fruman DA. Too much of a good thing: immunodeficiency due to hyperactive PI3K signaling . J Clin Invest. 2014; ; 124 : :3688.–3690. 45.
Gratacap MP, Guillermet-Guibert J, Martin V, et al. Regulation and roles of PI3Kbeta, a major actor in platelet signaling and functions . Adv Enzyme Regul. 2011; ; 51 : :106.–116. 46.
Jackson SP, Schoenwaelder SM, Goncalves I, et al. PI 3-kinase p110beta: a new target for antithrombotic therapy . Nat Med. 2005; ; 11 : :507.–514. 47.
Canobbio I, Stefanini L, Cipolla L, et al. Genetic evidence for a predominant role of PI3Kbeta catalytic activity in ITAM- and integrin-mediated signaling in platelets . Blood. 2009; ; 114 : :2193.–2196. 48.
Martin V, Guillermet-Guibert J, Chicanne G, et al. Deletion of the p110beta isoform of phosphoinositide 3-kinase in platelets reveals its central role in Akt activation and thrombus formation in vitro and in vivo . Blood. 2010; ; 115 : :2008.–2013. 49.
Consonni A, Cipolla L, Guidetti G, et al. Role and regulation of phosphatidylinositol 3-kinase beta in platelet integrin alpha2beta1 signaling . Blood. 2012; ; 119 : :847.–856. 50.
Jackson SP, Schoenwaelder SM. Antithrombotic phosphoinositide 3-kinase beta inhibitors in humans: a shear delight! J Thromb Haemost. 2012; ; 10 : :2123.–2126. 51.
Nylander S, Kull B, Bjorkman JA, et al. Human target validation of phosphoinositide 3-kinase (PI3K)beta: effects on platelets and insulin sensitivity, using AZD6482 a novel PI3Kbeta inhibitor . J Thromb Haemost. 2012; ; 10 : :2127.–2136. 52.
Laurent PA, Severin S, Hechler B, et al. Platelet PI3Kbeta and GSK3 regulate thrombus stability at a high shear rate . Blood. 2015; ; 125 : :881.–888. 53.
Torti M. PI3Kbeta inhibition: all that glitters is not gold . Blood. 2015; ; 125 : :750.–751. 54.
McCrea HJ, De Camilli P. Mutations in phosphoinositide metabolizing enzymes and human disease . Physiology. 2009; ; 24 : :8.–16. 55.
Staiano L, De Leo MG, Persico M, De Matteis MA. Mendelian disorders of PI metabolizing enzymes . Biochim Biophys Acta. 2015; ; 1851 : :867.–881. |