| |
| Med Sci (Paris). 2015 November; 31(11): 979–988. Published online 2015 November 17. doi: 10.1051/medsci/20153111012.La neuro-inflammation Dr Jekyll ou Mr Hyde ? Justine Renaud,1 Hélène-Marie Thérien,2 Marilyn Plouffe,1 and Maria-Grazia Martinoli1,3* 1Groupe de recherche en neurosciences, Département de biologie médicale, Université du Québec à Trois-Rivières, 3351 boulevard des Forges, G9A 5H7 Trois-Rivières, Québec, Canada 2Département de biologie médicale, Université du Québec à Trois-Rivières, Québec, Canada 3Département de psychiatrie et neurosciences, Université Laval et Centre de recherche du CHUL, Québec, Canada |
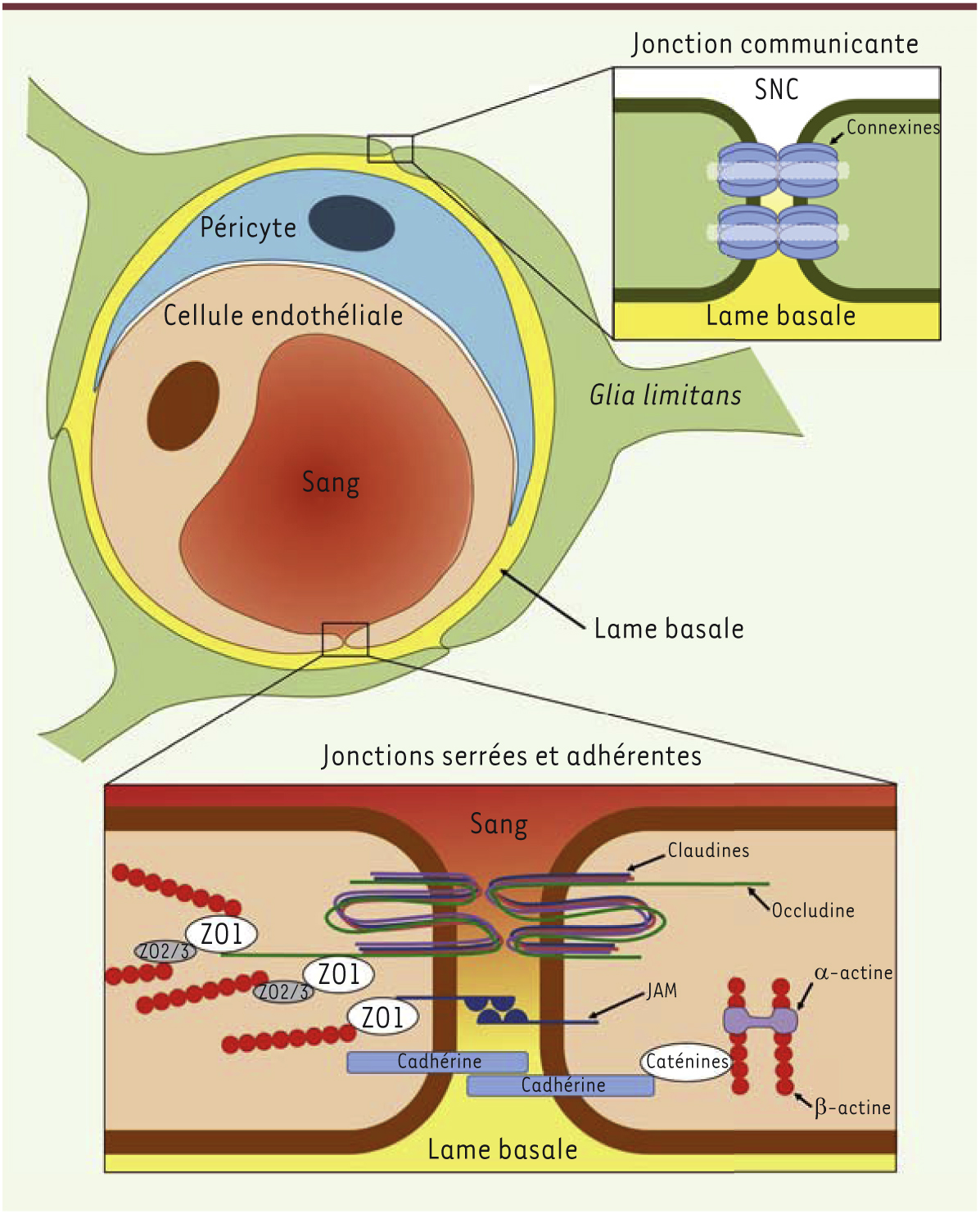
On a longtemps cru le système nerveux central (SNC) à l’abri de la majorité des effets dévastateurs de la réaction inflammatoire. On le disait immunoprivilégié, protégé qu’il était des agressions étrangères par la barrière hémato-encéphalique (BHE) (Figure 1) et dissimulé du système immunitaire par le peu d’expression des produits du complexe majeur d’histocompatibilité (CMH) et l’absence de drainage lymphatique. Mais, au cours de la dernière décennie, l’accumulation des évidences a fait s’écrouler le paradigme. S’il n’y a maintenant plus de doute quant à l’existence d’une réaction inflammatoire dans le SNC, et à l’utilisation du langage commun des cytokines et chimiokines pour contrôler ses actions [1], force est aussi de constater que la réaction inflammatoire du SNC se comporte de façon suffisamment différente de son homologue périphérique pour mériter l’appellation particulière de « neuro-inflammation ». Cette façon unique de gérer l’inflammation et les premières étapes de la réaction immunitaire, à travers un drainage soluble plutôt que cellulaire, tient aux propriétés particulières des différentes composantes du parenchyme nerveux (pour revue, voir [2]). La notion de privilège immunitaire, toujours de mise, ne concerne donc plus que le parenchyme, excluant ainsi les zones limitrophes que sont les espaces périvasculaires, les méninges et les ventricules. Privilège bien relatif car, aussi différente soit-elle de l’inflammation, la neuro-inflammation demeure un pari risqué pour un tissu aussi fragile que celui du SNC, si on se réfère aux pertes fonctionnelles auxquelles on l’associe dans les maladies neurodégénératives telles que la maladie d’Alzheimer, la maladie de Parkinson ou la sclérose en plaques [3, 41] (→). (→) Voir également la Nouvelle d’A. Louveau, page 953 de ce numéro  | Figure 1.
Schématisation de la barrière hémato-encéphalique (BHE). La BHE empêche la pénétration de la grande majorité des agents et des cellules circulant dans le sang vers le système nerveux central (SNC). Elle est composée de cellules endothéliales, de péricytes, de la lame basale et de la glia limitans. Les cellules endothéliales recouvrent complètement la lumière des capillaires du SNC et sont non-fenestrées (elle ne comporte pas de pores) contrairement à la majorité des cellules endothéliales périphériques. Elles sont reliées entre elles par des jonctions serrées constituées de protéines transmembranaires – occludines, claudines et JAM (junctional adhesion molecules) – ainsi que par des jonctions adhérentes assurées par l’interaction entre des ca-dhérines. Ces protéines transmembranaires sont liées au cytosquelette à l’aide de protéines adaptatrices, tantôt ZO1 et ZO2 (zonula occludens protéines 1 et 2), tantôt des caténines. Quant aux péricytes, ils sont distribués sur 20 à 30 % de la surface des cellules endothéliales et régulent leur différenciation et leur prolifération. Grâce aux propriétés contractiles de leurs projections cellulaires qui entourent les cellules endothéliales, ils peuvent modifier le diamètre des vaisseaux sanguins en réponse à l’activité neuronale. La lame basale, qui tapisse intégralement l’extérieur des péricytes et des cellules endothéliales, assure un support physique pour l’arrimage et la migration de certaines cellules par l’expression d’intégrines. Elle agit également, de par sa constitution matricielle, comme une barrière contre le passage de cellules ou de macromolécules indésirables. Finalement, la glia limitans recouvre plus de 99 % de la surface des capillaires du SNC. Les pieds astrocytaires qui la forment sont reliés entre eux par des jonctions communicantes et adhérentes. La glia limitans régule la morphologie et la perméabilité de la BHE en contrôlant l’expression de certaines protéines des cellules endothéliales. |
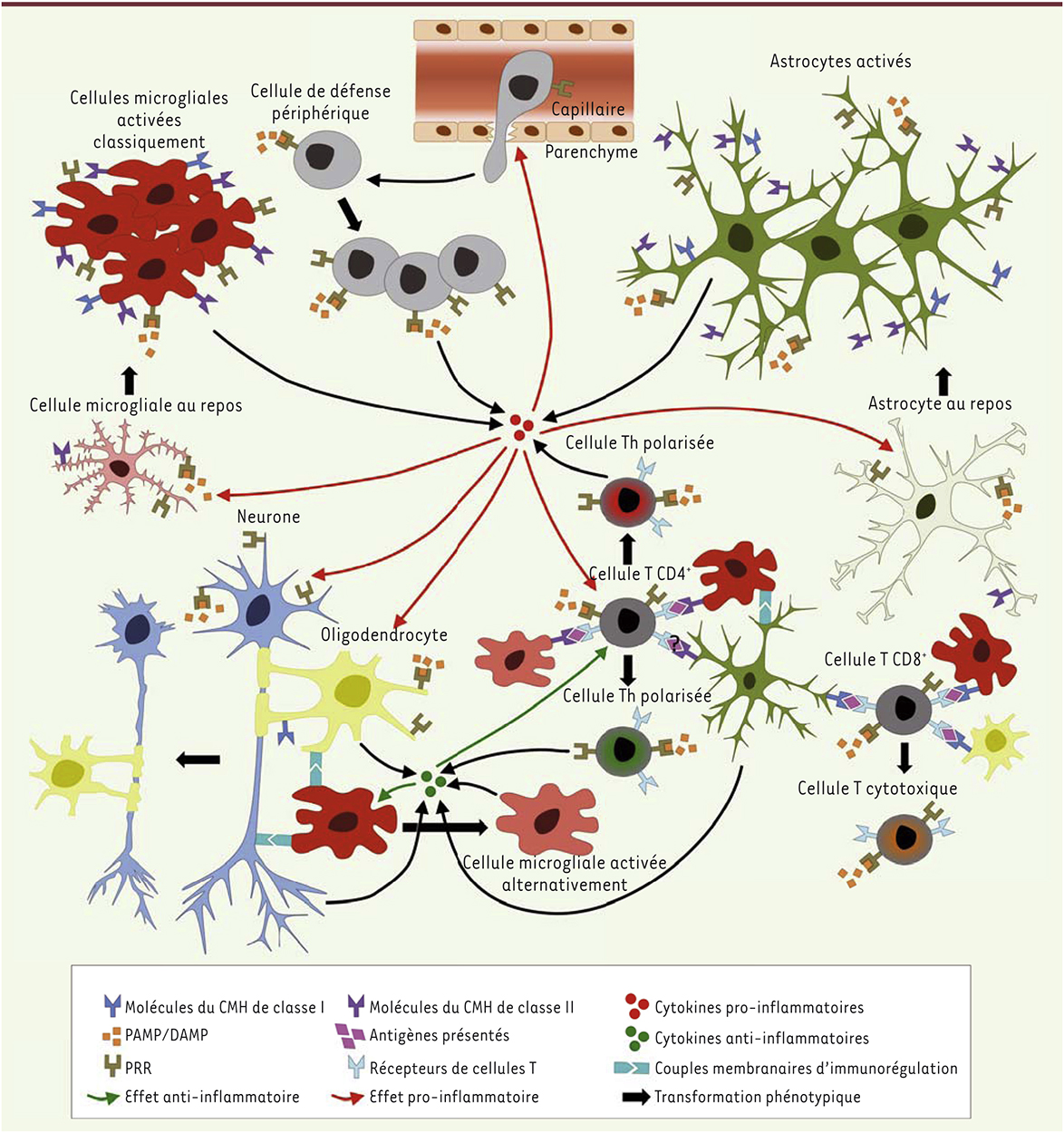
La reconnaissance d’une perturbation interne est un prérequis essentiel à l’induction de la réaction inflammatoire. Cette reconnaissance est assurée par un ensemble de récepteurs, baptisés PRR (pattern-recognition receptors), dont on connaît pour le moment une vingtaine de membres [4]. Ces récepteurs peuvent être solubles, membranaires ou cytosoliques, et reconnaissent tout autant les signatures moléculaires de classes de pathogènes (PAMP pour pathogen associated molecular patterns) que des molécules générées au cours de stress cellulaires autres qu’infectieux (DAMP pour damage-associated molecular pattern). On compte, parmi les DAMP, des protéines agrégées, modifiées ou simplement mal repliées telles l’α-synucléine, la protéine Tau ou le peptide β-amyloïde qui, toutes, ont été associées à des maladies neurodégénératives. On compte aussi parmi les DAMP de simples molécules comme l’ATP ou le glutamate, qui sont abondamment libérées dans le milieu lors de nécroses cellulaires au sein du SNC [5]. L’interaction des PAMP/DAMP avec leurs récepteurs induit une cascade de signalisation qui, en recrutant protéines adaptatrices et kinases, aboutit à l’activation de facteurs de transcription qui modifient de façon drastique le phénotype cellulaire. Cette modification se manifeste tant par l’acquisition de nouveaux récepteurs que par l’expression d’un éventail de cytokines et de chimiokines qui, par des actions à la fois autocrines et paracrines, guident les cellules de défense au site de l’agression, permettent le déploiement focalisé des mécanismes de défense (phagocytose, production de dérivés toxiques de l’oxygène, apoptose) et préparent les étapes de la reconstruction. Dans le SNC, lorsqu’il est question d’inflammation, c’est la microglie, la cellule résidente à vocation immune du tissu, qu’on accuse d’emblée de débordements. L’accusation est d’autant plus facile qu’on la retrouve toujours dans les zones enflammées et, qui plus est, avec sa morphologie de cellule « activée » [6]. Cependant, au contraire de ce qu’on observe en périphérie où l’expression constitutive des récepteurs PRR (pattern recognition receptors) est un attribut plutôt spécifique des cellules de la défense innée, on constate que, dans le SNC, les astrocytes, les oligodendrocytes et les neurones expriment leur propre répertoire de PRR par lequel ils contribuent eux aussi à toutes les étapes de la neuro-inflammation (Tableau I et Figure 2) [4]. 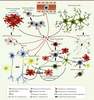 | Figure 2.
Dialogues entre les cellules neuronales dans le parenchyme nerveux en contexte de neuro-inflammation. Dans un contexte de neuro-inflammation, des molécules de danger nommées PAMP (pathogen associated molecular patterns) ou DAMP (damage-associated molecular pattern) activent les cellules munies de récepteurs PRR (pattern-recognition receptors), principalement les cellules microgliales. L’activation de la microglie conduit à sa multiplication et à sa transformation vers le phénotype pro-inflammatoire, caractérisé par une forme amiboïde et l’expression accrue de cytokines et de molécules du complexe majeur d’histocompatibilité (CMH) de classe I et II. À la suite de leur activation par les PAMP ou les DAMP, les astrocytes subissent également des changements phénotypiques tendant vers l’expression accrue de cytokines et leur prolifération. Les cellules du système nerveux central, en particulier les cellules microgliales activées classiquement, produisent des cytokines capables de perméabiliser la barrière hémato-encéphalique et sécrètent des chimiokines permettant la transvasation de cellules de défense périphériques - lymphocytes naïfs, lymphocytes T activés en périphérie, cellules NK (natural killer), granulocytes et macrophages - des capillaires vers le parenchyme. Ces cellules peuvent également reconnaître dans le parenchyme des PAMP et des DAMP qui les activent et induisent leur prolifération de concert avec l’expression de cytokines pro-inflammatoires. Les lymphocytes T CD4+ naïfs peuvent être activés principalement par la microglie grâce à la présentation d’antigènes via les molécules du CMH de classe II. La présentation d’antigènes aux lymphocytes T CD4+ par les autres cellules résidentes du parenchyme est plus controversée, bien qu’elle ait été démontrée in vitro pour les astrocytes. Quant à la présentation d’antigènes par les molécules du CMH de classe I aux lymphocytes T CD8+ naïfs, elle peut être réalisée par les cellules de la microglie, les astrocytes, les oligodendrocytes, mais ceci est incertain pour les neurones. Enfin, plusieurs acteurs expriment constitutivement des cytokines anti-inflammatoires ou des molécules membranaires permettant de contenir la réaction inflammatoire par la polarisation des lymphocytes T en lymphocytes de types immunorégulateurs et, entre autres, par la transformation de la microglie vers un état réparateur. L’exposition à long terme aux cytokines pro-inflammatoires endommage les neurones et les oligodendrocytes qui sont, à cause de leur faible potentiel régénérateur, les cellules les plus sensibles à une neuro-inflammation chronique. |
Tableau I.
| Acteur cellulaire |
Promotion de la neuro-inflammation |
Inhibition de la neuro-inflammation |
| Actions |
Facteurs impliqués |
Actions |
Facteurs impliqués |
|
Cellules microgliales
|
Expression de cytokines pro-inflammatoires |
TNF-α, IFN-γ, IL-6, IL-1β |
Sécrétion de cytokines anti-inflammatoires |
IL-4, IL-10, IFN-β, TGF-β |
| Expression de protéines membranaires/récepteurs/PRR |
TLR, RAGE, LFA-1, MAC-1, CRs, FcRβ |
Expression de protéines membranaires/récepteurs* |
CD45, CD47, CD56 (NCAM), CD91, CD200R, CD172, CX3CR1, TREM2, TSB, FasL, Fas |
| Expression de chimiokines |
CXCL1, 2, 12; CCL2, 5, 10, 19 |
Polarisation des cellules Th vers Treg |
TGF-β |
| Polarisation des Th vers Th1 |
IL-12, IL-23 |
Diminution de la production de NO par détournement de l’Arg |
Arginase-1 |
| Présentation d’antigènes soutenant l’activation des cellules Th activées |
CMH classe II, facteurs de costimulation |
Production de prostaglandines constitutives |
COX-1 au détriment de COX-2 |
| Production de monoxyde d’azote |
iNOS |
Expression de facteurs neurotrophiques |
BDNF, GDNF |
| Production de prostaglandines pro-inflammatoires |
COX-2 |
Inhibition de la prolifération des cellules T par détournement du Trp |
IDO |
| Induction de stress oxydant et nitrosatif |
ROS, RNS |
Inhibition des MMP |
TIMP |
| Facilitation de la migration des cellules défense périphériques |
MMP |
Induction de l’apoptose des cellules défense périphériques et autorégulation |
FasL, Fas |
| Génération de molécules neurotoxiques |
Glu, acide quinolinique (IDO) |
|
|
| Soutien de l’immunité innée |
molécules du complément |
|
|
| Production de DAMP |
ATP, HMGB1, HSP |
|
|
|
|
Neurones
|
Sécrétion de chimiokines |
CXCL10, CCL21 |
Sécrétion de cytokines |
IL-10, TGF-β |
| Expression de PRR |
TLR |
Sécrétion de chimiokines anti-inflammatoires |
Fractalkine soluble |
| Génération de molécules neurotoxiques |
Glu |
Expression de protéines membranaires inhibant cellules immunitaires* |
CD22, CD47, CD56 (NCAM), CD200, fractalkine, FasL |
|
Sécrétion de neurotransmetteurs pro-inflammatoires |
DA, substance P |
Polarisation des Th vers Treg |
TGF-β |
|
Production de monoxyde d’azote |
iNOS |
Sécrétion de neurotransmetteurs et neuropeptides anti-inflammatoires |
GABA, VIP, NE, α-MSH, somatostatine, CGRP |
|
Facilitation de la migration des cellules de défense périphériques |
MMP |
Remodelage de la matrice extracellulaire |
Protéoglycanes |
|
Neurones
|
Production de DAMP |
ATP, HMGB1, HSP, protéines mal repliées (protéinopathies neurodégénératives) |
Expression de facteurs neurotrophiques |
NGF, BDNF, NT3, GDNF, CNTF |
|
|
Induction de l’apoptose des microglies et cellules défense périphériques |
FasL |
|
|
Absence d’activation des cellules cytotoxiques CD8+
|
Absence de HLA A, B ou C (CMH classe Ia) |
|
|
Inhibition des cellules NK par activation du KIR |
HLA G (CMH classe Ib) |
|
|
Astrocytes
|
Expression de cytokines pro-inflammatoires |
TNF-α, IFN-γ, IL-1β |
Sécrétion de cytokines anti-inflammatoires |
IL-4, IL-10, IFN-β, TGF-β |
| Expression de chimiokines |
CXCL1, 2, 12; CCL2, 5, 10, 19 |
Expression de protéines membranaires inhibant cellules immunitaires |
Inhibiteurs du complément, CTLA-4 |
| Expression de protéines membranaires/récepteurs/PRR |
TLR, RAGE, ICAM1, CR |
Polarisation des Th vers Treg |
TGF-β, CXCL12 |
| Génération de molécules neurotoxiques |
Glu (diminution de son internalisation) |
Remodelage de la matrice extracellulaire |
Protéoglycanes |
| Présentation d’antigènes soutenant l’activation des cellules Th activées ? |
CMH classe II, facteurs de costimulation |
Expression de facteurs neurotrophiques |
BDNF, GDNF, NGF, CTNF, FGF |
| Facilitation de la migration des cellules de défense périphériques |
MMP |
Inhibition des MMP |
TIMP |
| Production de monoxyde d’azote |
iNOS |
Induction de l’apoptose des microglies et cellules défense périphériques |
FasL, PD-L1 (chez cellules T activées exprimant PD-1) |
|
Soutien de l’immunité innée |
Molécules du complément |
Dédifférenciation en radial-glia-like cells |
FGF2, IGF1, SDF1, VEGF |
|
Production de DAMP |
ATP, HMGB1, HSP |
|
|
|
Dédifférenciation en radial-glia-like cells |
CCL2 |
|
|
|
| Oligodendrocytes |
Expression de PRR |
TLR |
Sécrétion de cytokines |
TGF-β |
|
|
Expression de protéines membranaires inhibant cellules immunitaires |
CD200, fractalkine |
Rôles pro- et antiinflammatoires des divers acteurs cellulaires du SNC dans la neuroinflammation. Arg, arginine; BDNF, brainderived neurotrophic factor; CCL, chemokine (CC motif) ligand; CD, cluster of differentiation; CGRP, calcitonin generelated peptide; CMH, complexe majeur d’histocompatibilité; CNTF, ciliary neurotropic factor; COX, cyclooxygénase; CR, complement receptor; CTLA- 4, cytotoxic Tlymphocyte-associated protein 4 ou CD152; CXCL1, chemokine (CXC motif) ligand; CX3CL1, chemokine (CX3- C motif) ligand 1 ou fractalkine; CX3CR1, CX3C chemokine receptor 1; DA, dopamine; DAMP, dangerassociated molecular pattern molecule; FasL, ligand Fas ou CD95L; FcRβ, Fc receptor β subunit; FGF, fibroblast growth factor; GABA, acide γ-aminobutyrique; GDNF, glial cell linederived neurotrophic factor; Glu, glutamate; HLA, human leucocyte antigen; HMGB1, high mobility group box 1; HSP, heat shock protein; ICAM, intercellular adhesion molecule; IDO, indoléamine 2,3-dioxygénase; IFN, interféron; IGF1, insulinlike growth factor 1; IL, interleukine; iNOS, inducible nitric oxide synthase; KIR, killercell immunoglobulinlike receptor; LF A- 1, lymphocyte functionassociated antigen- 1; MAC- 1, macrophage- 1 antigen; MMP, matrix metalloproteinases; α-MSH, α-melanocytestimulating hormone; NCAM, neural cell adhesion molecule ou CD56; NE, norépinéphrine; NGF, nerve growth factor; NT3, neurotrophine-3; PD-L1, programmed deathligand 1; PDL, programmed cell death protein 1; PRR, pattern recognition receptor; RAGE, receptor for advanced gly cation endproducts; RNS, espèce réactive de l’azote; ROS, espèce réactive de l’oxygène; SDF1, stromal cellderived factor 1; SIRPα, signalregulatory protein α ou CD172; TGF-β; transforming growth factor-α; Th1, T helper cell subtype 1; Th2, T helper cell subtype 2; TIMP, tissue inhibitor of metaloproteinase; TLR, tolllike receptor; TNF-α, tumor necrosis factor-α; Treg, regulatory T cell; TREM2, trig gering receptor expressed on my eloid cells 2; Trp, tryptophane; TSB, thrombosphondine; VEGF, vascular endothelial growth factor; VIP, peptide vasoactif intestinal. * Couples membranaires immunorégulateurs neurones-microglies : CD200/CD200R, CD22/ CD45, CD47/ CD172, CD47/ TSB, fractalkine/ CX3CR1 et CD56/ CD56. |
|
La microglie constitue en moyenne 10 % de l’ensemble des cellules gliales [40]. Les cellules microgliales ont pour origine le sac vitellin, à partir d’un précurseur érythro-myéloïde CSF1R+ (colony stimulating factor 1 receptor) commun aux macrophages résidents [7]. Elles colonisent très tôt le neuroépithélium où elles poursuivent leur différenciation selon une voie originale dans l’environnement particulier du SNC. Elles conservent tout au long de la vie un certain pouvoir de régénération qui leur permet à la fois de maintenir leur pool et de répondre à des demandes ponctuelles [8]. Après la naissance, une sous-population de cellules microgliales semblerait également provenir de source hématopoïétique par l’infiltration de monocytes dans le parenchyme [9]. Toujours à explorer leur environnement à travers les mouvements rapides de leurs extensions cytoplasmiques qui se chevauchent très peu, et dotées d’un très vaste potentiel d’activités, elles se métamorphosent en réponse aux influences qu’elles subissent. Les cellules microgliales sont essentielles à la structuration du SNC et à l’exercice des fonctions nerveuses supérieures, un rôle dont on commence à peine à percevoir l’importance [10]. C’est cependant pour leur implication dans les situations traumatiques qu’elles sont le mieux connues. Exprimant tous les PRR identifiés à ce jour, les cellules microgliales sont particulièrement bien équipées pour percevoir les perturbations de leur environnement, fussent-elle causées par la concentration anormale d’une molécule, son format inhabituel ou par l’apparition d’un composé inusité [11]. La reconnaissance de la perturbation induit le passage de l’état de veille à celui d’activation, l’objectif étant, dans un premier temps, d’éliminer la source du dérèglement et, dans un second temps, de favoriser le remodelage et la régénération. En présence d’un signal de danger, les cellules microgliales adoptent un profil amiboïde qui facilite à la fois leur division et leur déplacement. Elles sont recrutées soit directement par les molécules de danger elles-mêmes, soit par des chimiokines libérées par les autres cellules neuronales alertées du danger. Elles forment autour de la région lésée un bouclier protecteur qui vise à en limiter l’étendue. Les conséquences précises de l’activation dépendent du contexte particulier dans lequel se fait la rencontre avec le stimulus initiateur, les cellules microgliales oscillant entre deux états extrêmes : un état d’activation classique et un état d’activation alternatif à vocation réparatrice [12]. Dans son état d’activation classique, la microglie exhibe un profil pro-inflammatoire (Tableau I) caractérisé par : (1) la sécrétion d’un large éventail de cytokines pro-inflammatoires et de polarisation Th1 (T helper cell subtype 1) ; (2) l’expression de chimiokines ; (3) l’expression d’iNOS (inducible nitric oxide synthase) et de COX (cyclooxygénase)-2 ; (4) la production de dérivés toxiques de l’oxygène et de l’azote ; (5) l’augmentation de l’expression des molécules du CMH (complexe majeur d’histocompatibilité) de classes I et II et des facteurs de costimulation ; (6) la sécrétion de métalloprotéinases matricielles ; et (7) un pouvoir phagocytaire accru. Si, dans un état pro-inflammatoire, la microglie possède l’arsenal nécessaire pour altérer l’étanchéité de la BHE (barrière hémato-encéphalique), attirer les leucocytes – principalement les lymphocytes, monocytes et granulocytes –, faciliter leur déplacement dans la matrice extracellulaire, présenter des antigènes, soutenir l’activation de l’immunité spécifique et mettre hors d’état de nuire les agents perturbateurs, elle a aussi le pouvoir de causer des dommages collatéraux souvent irréversibles au SNC. Ce potentiel autodestructeur de la microglie activée classiquement est tempéré par les propriétés immunosuppressives du milieu, en grande partie attribuables aux neurones. Dans son état réparateur dicté par le contexte du milieu, la microglie adopte plutôt : (1) un métabolisme aérobie ; (2) une expression accrue des récepteurs éboueurs1 ; (3) la synthèse de COX-1 au détriment de COX-2 ; (4) la synthèse d’arginase-1 ; de même que (5) la sécrétion de divers facteurs neurotrophiques et d’éléments matriciels. Ainsi, la microglie détient également le potentiel de participer à la réparation des tissus lésés et au retour à l’homéostasie (Tableau I), favorisant l’angiogenèse et stimulant la génération de nouveaux oligodendrocytes, astrocytes, voire même neurones, à partir de cellules souches toujours présentes dans le parenchyme nerveux adulte. Les états d’activation classique et réparateur ne constituent que les deux pôles d’un continuum d’états entre lesquels les cellules microgliales oscillent en fonction des particularités activatrices du milieu dans lequel elles baignent [13]. Avec l’âge, pour des raisons qu’on s’explique encore mal, l’induction du profil réparateur se fait plus difficile, une situation à mettre en lien avec l’augmentation des maladies neurodégénératives associée au vieillissement [14]. |
Les neurones jouent un rôle primordial dans l’établissement des privilèges immunitaires du SNC en agissant tant en amont qu’en aval de la réponse [15]. Ils expriment quelques PRR, par lesquels ils perçoivent les signaux de danger présents dans leur environnement, et expriment plusieurs récepteurs pour les cytokines, qui leur permettent d’ajuster leur contribution à l’immunosuppression en situation d’agression. Les neurones expriment notamment le récepteur TLR3 (toll-like receptor 3) dont le PAMP déclencheur est l’ARN double brin. La dimérisation de TLR3 mène à la production d’interférons de type I dont le rôle est crucial dans la défense innée contre les virus, par exemple lors d’une infection par le virus neurotropique de la rage [16]. La microglie, avec son imposant arsenal pro-inflammatoire, est une des cibles préférentielles de l’attention neuronale qui se veut généralement atténuante. La régulation de la microglie par les neurones implique à la fois des contacts cellule-cellule et des facteurs solubles contribuant à freiner l’inflammation (Tableau I). La majorité de ces protéines sont exprimées de façon constitutive et créent donc, d’entrée de jeu, un milieu immunosuppresseur capable de contenir les débordements de la microglie. Elles agissent principalement en interférant avec les voies de signalisation, inhibant des kinases essentielles telle la famille des MAPK (mitogen-activated protein kinase) et les Pi3K (phophoinositide 3-kinases), réduisant l’expression de facteurs de transcription comme c-jun ou c-myc, ou inhibant leur translocation nucléaire comme c’est le cas pour Nrf2 (nuclear factor erythroid 2-related factor 2) ou NF-κB (nuclear factor kappa-light-chain-enhancer of activated B cells). Elles permettent, en conséquence, de diminuer la production de cytokines inflammatoires et de dérivés toxiques de l’oxygène ou de l’azote dès l’engagement des PRR de la microglie. Les neurones expriment en plus, et de façon constitutive, le FasL (ligand Fas ou CD95L) par lequel ils contrôlent l’apoptose des cellules microgliales activées. Les neurones libèrent également nombre de facteurs solubles qui contribuent aussi à restreindre l’activation de la microglie. Le TGF-β (transforming growth factor-β) et la fractalkine soluble sont exprimés par les neurones de façon constitutive, et leur production peut être amplifiée en situation traumatique, tandis que l’interleukine-10 (IL-10) est plutôt sécrétée en situation de crise. À ces facteurs immunorégulateurs viennent s’ajouter l’activité neuronale dont l’action anti-inflammatoire est arbitrée par un bon nombre de neurotransmetteurs et plusieurs neurotrophines (Tableau I). Sous cette influence, les cellules microgliales produisent moins de cytokines inflammatoires, réduisent leur stress oxydant, diminuent leur expression des molécules du CMH et, ainsi, soutiennent moins efficacement l’activation des cellules de défense périphériques ayant accédé au parenchyme nerveux. Quant à leur pouvoir phagocytaire, il peut être, selon les particularités du contexte, soit amplifié, soit diminué. Le caractère immunosuppresseur des neurones ne contrôle pas seulement les ardeurs de la microglie au moment de son activation. Il tempère aussi les conséquences de cette activation en s’exerçant sur les cellules de défense périphériques qui, répondant à l’appel, ont gagné le parenchyme ou tentent de s’y introduire. Ici encore, l’effet s’exerce tantôt par des contacts cellule-cellule impliquant entre autres des cadhérines, des molécules du CMH, et le FasL, tantôt par l’intermédiaire de facteurs solubles dont le TGF-β et les sémaphorines 3 et 72. Les interactions aboutissent à l’immobilisation des macrophages, la neutralisation des cellules cytotoxiques, NK (natural killer) et lymphocytes T CD8+, la polarisation des lymphocytes Th vers des phénotypes plus immunorégulateurs que pro-inflammatoires tels Th2 (T helper cell subtype 2) ou Treg (regulatory T cell), et la mort par apoptose des cellules activées. |
D’origine neuroectodermique, les astrocytes sont les cellules les plus abondantes du SNC, représentant jusqu’à 70 % de la névroglie. Ce sont des cellules étoilées qui, avec leurs extensions cytoplasmiques, participent à la formation de la glia limitans de la BHE (Figure 1). Ils enrobent les synapses, communiquent entre eux par le biais de jonctions communicantes et contribuent au drainage glymphatique du liquide interstitiel parenchymateux vers le liquide céphalo-rachidien (LCR) [17]. Ils délimitent ainsi un territoire sur lequel ils peuvent exercer leur influence grâce aux récepteurs, canaux ioniques, transporteurs et enzymes de toutes sortes dont ils sont pourvus [18, 19]. Outre leur rôle clé dans l’homéostasie du SNC, dans le métabolisme neuronal et dans la modulation dynamique de la transmission synaptique, les astrocytes sont particulièrement bien outillés pour assister la microglie dans sa fonction de sentinelle et de défense [20, 21]. Ils expriment le TLR3 de façon constitutive et peuvent être stimulés pour exprimer plusieurs autres PRR. Tout comme les cellules microgliales, ils sont donc aptes à reconnaître et à réagir à un large éventail de situations dangereuses pour le SNC. En réponse à l’activation, les astrocytes deviennent hypertrophiques, prolifèrent et modifient leur expression génique. Ils sécrètent nombre de facteurs pro-inflammatoires (Tableau I) servant à attirer les cellules de défense périphériques et à faciliter leur migration dans le parenchyme. Ils expriment des récepteurs éboueurs, via lesquels ils contribuent à la phagocytose, et produisent les molécules du CMH de classe II, leur permettant d’activer les lymphocytes T auxiliaires. Leur capacité à présenter des antigènes, comme le fait la microglie, reste cependant controversée. L’activation les amène à diminuer leur internalisation de glutamate et à perturber le réseau astrocytaire en diminuant la production de connexine 43, ce qui contribue, de surcroît, au caractère neurotoxique de la réaction inflammatoire. S’ils participent foncièrement aux processus pro-inflammatoires lorsqu’ils sont activés, les astrocytes répondent néanmoins à l’IL-1β par la sécrétion de TGF-β et par la libération de différents facteurs neurotrophiques (Tableau I) qui soutiennent la réparation de la BHE, la remyélinisation, le remodelage de la matrice ainsi que la survie des neurones et des oligodendrocytes. Ils contrôlent l’activation des lymphocytes T par leur expression du récepteur immunorégulateur CTLA-4 (cytotoxic T-lymphocyte-associated protein 4 ou CD152) et peuvent déclencher l’apoptose des cellules de défense activées par l’expression constitutive du FasL. En situation d’inflammation chronique, leur capacité d’activer les lymphocytes Th est compensée par une interaction qui biaise la réponse en faveur des Th2, un profil plus immunorégulateur que le profil Th1 pour le SNC [22]. De plus, certains signaux d’agression permettent aux astrocytes de se dédifférencier en radial-glia-like cells (cellules gliales radiaires)3 qui sont capables d’exprimer d’autres facteurs neurotrophiques (Tableau I) qui, ensemble, promeuvent la multiplication des cellules souches neuronales et leur migration vers le site de lésion [23]. Enfin, les astrocytes sont particulièrement reconnus pour leur rôle dans la formation de la cicatrice gliale. En effet, lorsqu’ils sont activés, ils se multiplient abondamment, circonscrivent le site d’inflammation, occupent les espaces créés par la mort ou la phagocytose de cellules neuronales, et produisent des éléments de la matrice extracellulaire comme l’acide hyaluronique. Cependant, cette réaction de défense, qui a pour but d’inhiber la propagation de l’inflammation et d’offrir un effet restructurant, a aussi comme conséquence néfaste d’inhiber la migration et la différentiation des cellules souches neuronales [23]. |
Les oligodendrocytes partagent la même origine neuroectodermique que les astrocytes et les neurones. Derniers à entrer en scène, ils établissent avec les neurones une relation symbiotique. Les oligodendrocytes sont tout aussi essentiels au développement et à la survie des axones que les neurones le sont à la myélinisation [24-26]. Comme les neurones, les oligodendrocytes contribuent au caractère immunosuppresseur du parenchyme nerveux par leur production constitutive de TGF-β et par leur expression du CD200 (ou OX-2) et de fractalkine. À l’instar des autres cellules du SNC, ils expriment des PRR, notamment TLR2 et TLR3, qui leur permettent de réagir à certains signaux de danger. Bien que les conséquences de l’engagement de ces récepteurs demeurent pour le moment mal connues, elles devraient se répercuter sur l’ensemble du réseau d’influence des oligodendrocytes. Ce réseau, relativement vaste, implique tout autant les astrocytes, avec lesquels les oligodendrocytes sont en lien par le biais de jonctions communicantes, que les neurones auxquels ils sont associés par la gaine de myéline, un oligodendrocyte pouvant enrober jusqu’à une cinquantaine d’axones distincts. Si les oligodendrocytes peuvent participer activement à la mise en place d’une immunité innée par l’intermédiaire de leurs TLR, ils peuvent aussi être eux-mêmes générateurs de danger. Très sensibles au stress oxydant, tout comme ils le sont à la toxicité du glutamate ou à celle de l’ATP, les oligodendrocytes peuvent causer des dommages sérieux à leur environnement et entretenir l’inflammation sans être nécessairement les cellules initialement visées par l’agression. |
Les cellules de défense périphériques Au niveau du SNC sain, rares sont les leucocytes qui arrivent à s’échapper du système vasculaire. Leur présence, bien que limitée, permet tout de même d’assurer une immunosurveillance dont l’importance nous apparaît indéniable lorsqu’on mesure les dommages encourus par la suppression de la patrouille des cellules de défense périphériques (pour revue voir [27]). Ainsi, dans le cas du JC polyomavirus, un virus ubiquitaire chez l’humain, l’arrêt de l’immunosurveillance, secondaire à des thérapies immunosuppressives, entraîne la leucoencéphalopathie multifocale progressive, une maladie du SNC généralement mortelle. Les leucocytes qui parviennent à pénétrer le SNC (uniquement des mononucléaires) prennent avantage à la fois de leur expression de certaines protéines d’adhésion et de l’existence de zones plus permissives de la BHE, telles que la glande pituitaire, l’éminence médiane, l’aire postrema, l’aire préoptique, la paraphyse, la glande pinéale et l’endothélium des plexus choroïdes. Les monocytes utilisent la voie leptoméningée pour venir peupler les espaces de Virchow-Robin (ou espaces périvasculaires) en bordure des artérioles et en continuité avec l’espace sous-arachnoïdien. Quant aux lymphocytes (uniquement des lymphocytes T activés), ils s’affranchissent de la barrière sang-LCR (BSLCR) en empruntant la voie du plexus choroïdien qui exprime constitutivement des molécules nécessaires à leur admission, comme le CCL20 (chemokine [C-C motif] ligand 20) indispensable au recrutement des cellules CCR6+ (C-C chemokine receptor type 6) [28]. Une fois qu’ils ont traversé, ils sont entraînés par le LCR, patrouillent les espaces et repartent soit vers le sang, par le biais des villosités arachnoïdiennes, soit vers les ganglions cervicaux profonds, par le biais de la plaque cribriforme de l’os ethmoïde ou par le biais d’un système lymphatique propre au SNC récemment mis en évidence [29, 30]. On constate donc qu’en situation normale, des cellules de défense d’origine médullaire occupent des niches stratégiques du SNC sans jamais pénétrer le parenchyme, qu’elles exercent patrouille et immunosurveillance, comme elles le font en périphérie, et qu’elles possèdent tous les attributs qui leur permettent de réagir efficacement à l’agression [27, 31-33]. En réponse à l’agression, les cellules du parenchyme s’activent. Elles libèrent dans le milieu des cytokines pro-inflammatoires qui modifient l’étanchéité de la BHE ainsi que des chimiokines (Tableau I) qui guident les cellules de défense, y compris les granulocytes, et les autorisent à pénétrer au sein même du parenchyme [34]. Les macrophages périvasculaires participent au recrutement par la production de facteurs de croissance (Tableau I), la modification des cellules endothéliales, et par la sécrétion de métalloprotéinases qui facilitent les déplacements. Bien que nécessaire à la résolution des problèmes, l’afflux de cellules sur le pied de guerre dans le parenchyme nerveux comporte des risques importants pour un tissu aussi fragile. Pour contrer les risques encourus, les cellules du parenchyme limitent le temps de vie des cellules de défense en provenance de l’extérieur ou les réorientent vers des phénotypes plus immunorégulateurs, notamment par l’expression constitutive de FasL ou de TGF-β dans l’environnement nerveux. |
La neuro-inflammation est un phénomène hautement complexe par lequel le SNC s’allie au système immunitaire pour assurer sa protection et maintenir son homéostasie [35] (Figure 2). La complexité du phénomène, qui le rend difficilement abordable dans le contexte fragmentaire des études in vitro ou des systèmes modèles, tient tout autant à la multiplicité des intervenants cellulaires qu’à l’enchevêtrement des voies de signalisation et aux effets tantôt synergiques, tantôt antagonistes, tantôt neurotoxiques, tantôt neurotrophiques des signaux émis. Les conséquences en sont difficilement prévisibles car elles dépendent à la fois de la nature, de l’intensité, de la durée et de l’historique de l’agression [36]. Il semble cependant que si elle est source du mal, la neuro-inflammation soit aussi source de la solution [37, 38]. Il nous faut donc apprendre à décoder son langage et à identifier, pour chaque problématique, le maillon faible du réseau afin de mettre au point des stratégies d’intervention ciblées qui permettent de contrer la neurodégénération [39]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
J.R. est récipiendaire d’une bourse doctorale Vanier-Canada. MGM est récipiendaire d’une subvention à la Découverte-CRSNG (Canada).
|
Footnotes |
1.
Galic MA, Riazi K, Pittman QJ. Cytokines and brain excitability . Front Neuroendocrinol. 2012; ; 33 : :116.–125. 2.
Galea I, Bechmann I, Perry VH. What is immune privilege (not)? Trends Immunol. 2007; ; 28 : :12.–18. 3.
Amor S, Puentes F, Baker D, van der Valk P. Inflammation in neurodegenerative diseases . Immunology. 2010; ; 129 : :154.–169. 4.
Lee H, Lee S, Cho IH, Lee SJ. Toll-like receptors: sensor molecules for detecting damage to the nervous system . Curr Prot Pept Sci. 2013; ; 14 : :33.–42. 5.
Tang D, Kang R, Coyne CB, et al. PAMPs and DAMPs : signal 0s that spur autophagy and immunity . Immunol Rev. 2012; ; 249 : :158.–175. 6.
Cunningham C. Microglia and neurodegeneration: the role of systemic inflammation . Glia. 2013; ; 61 : :71.–90. 7.
Gomez Perdiguero E, Klapproth K, Schulz C, et al. Tissue-resident macrophages originate from yolk-sac-derived erythro-myeloid progenitors . Nature. 2015; ; 518 : :547.–551.
8.
Ajami B, Bennett JL, Krieger C, et al. Local self-renewal can sustain CNS microglia maintenance and function throughout adult life . Nat Neurosci. 2007; ; 10 : :1538.–1543. 9.
Chen SK, Tvrdik P, Peden E, et al. Hematopoietic origin of pathological grooming in Hoxb8 mutant mice . Cell. 2010; ; 141 : :775.–785. 10.
Tremblay ME, Stevens B, Sierra A, et al. The role of microglia in the healthy brain . J Neurosci. 2011; ; 31 : :16064.–16069. 11.
Hanke ML, Kielian T. Toll-like receptors in health and disease in the brain: mechanisms and therapeutic potential . Clin Sci (Lond). 2011; ; 12 : :367.–387. 12.
Boche D, Perry VH, Nicoll JAR. Review: activation patterns of microglia and their identification in the human brain . Neuropathol Appl Neurobiol. 2013; ; 39 : :3.–18. 13.
Eggen BJL, Raj D, Hanisch UK, Boddeke HWGM. Microglial phenotype and adaptation . J Neuroimmunol Pharmacol. 2013; ; 8 : :807.–823. 14.
Norden DM, Godbout JP. Review: microglia of the aged brain: primed to be activated and resistant to regulation . Neuropathol Appl Neurobiol. 2013; ; 39 : :19.–34. 15.
Suzumura A. Neuron-microglia interaction in neuroinflammation . Curr Prot Pept Sci. 2013; ; 14 : :16.–20. 16.
Ménager P, Roux P, Mégret F, et al. Toll-like receptor 3 (TLR3) plays a major role in the formation of rabies virus Negri bodies . PLoS Pathog. 2009; ; 5 : :e1000315.. 17.
Iliff JJ, Wang M, Liao Y, et al. A paravascular pathway facilitates CSF flow through the brain parenchyma and the clearance of interstitial solutes, including amyloid β . Sci Trans Med. 2012; ; 4 : :147ra111.. 18.
Bélanger M, Magistretti PJ. The role of astroglia in neuroprotection . Dialogues Clin Neurosci. 2009; ; 11 : :281.–295. 19.
Nedergaard M, Verkhratsky A. Artifact versus reality: how astrocytes contribute to synaptic events . Glia. 2012; ; 60 : :1013.–1023. 20.
Farina C, Aloisi F, Meinl E. Astrocytes are active players in cerebral innate immunity . Trends Immunol. 2007; ; 28 : :138.–145. 21.
Gimsa U, Mitchison NA, Brunner-Weinzierl MC. Immune privilege as an intrinsic CNS property: astrocytes protect the CNS against T-cell-mediated neuroinflammation . Mediators Inflamm. 2013; ; 2013 : :320519.. 22.
Jäger A, Dardalhon V, Sobel RA, et al. Th1, Th17, and Th9 effector cells induce experimental autoimmune encephalomyelitis with different pathological phenotypes . J Immunol. 2009; ; 183 : :7169.–7177. 23.
Müller FJ, Snyder EY, Loring JF. Gene therapy: can neural stem cells deliver? Nat Rev Neurosci. 2006; ; 1 : :75.–84. 24.
Baumann N, Pham-Dinh D. Biology of oligodendrocyte and myelin in the mammalian central nervous system . Physiol Rev. 2001; ; 81 : :871.–927. 25.
Wake H, Lee PR, Fields RD. Control of local protein synthesis and initial events in myelination by action potentials . Science. 2011; ; 333 : :1647.–1651. 26.
Frühbeis C, Fröhlich D, Kuo WP, et al. Neurotransmitter-triggered transfer of exosomes mediates oligodendrocyte-neuron communication . PLoS Biol. 2013; ; 11 : :e1001604.. 27.
Ousman SS, Kubes P. Immune surveillance in the central nervous system . Nat Neurosci. 2013; ; 15 : :1096.–1101. 28.
Reboldi A, Coisne C, Baumjohann D, et al. C-C chemokine receptor 6-regulated entry of TH-17 cells into the CNS through the choroid plexus is required for the initiation of EAE . Nat Immunol. 2009; ; 10 : :514.–523. 29.
Louveau A, Smirnov I, Keyes TJ, et al. Structural and functional features of central nervous system lymphatic vessels . Nature. 2015; ; 523 : :337.–341. 30.
Aspelund A, Antila S, Proulx ST, et al. A dural lymphatic vascular system that drains brain interstitial fluid and macromolecules . J Exp Med. 2015; ; 212 : :991.–999. 31.
Bechmann I, Galea I, Perry VH. What is the blood-brain barrier (not)? Trends Immunol. 2007; ; 28 : :5.–11. 32.
Ransohoff RM, Engelhardt B. The anatomical and cellular basis of immune surveillance in the central nervous system . Nat Rev Immunol. 2012; ; 12 : :623.–635. 33.
Carare RO, Hawkes CA, Weller RO. Afferent and efferent immunological pathways of the brain. Anatomy, function and failure . Brain Behav Immun. 2013; ; 59 : :11.–14. 34.
Takeshita Y, Ransohoff RM. Inflammatory cell-trafficking across the blood-brain barrier: chemokine regulation and in vitro models . Immunol Rev. 2012; ; 248 : :228.–239. 35.
Lampron A, Elali A, Rivest S. Innate immunity in the CNS: redefining the relationship between the CNS and its environment . Neuron. 2013; ; 78 : :214.–232. 36.
Nagajima K, Kohsaka S. Microglia: neuroprotective and neurotrophic cells in the central nervous system . Curr Drug Targets Cardiovasc Haematol Disord. 2004; ; 4 : :65.–84. 37.
Rawji KS, Yong VW. The benefits and detriments of microphages/microglia in models of multiple sclerosis . Clin Dev Immunol. 2013; ; 2013 : :948976.. 38.
Hanamsagar R, Hanke ML, Kielian T. Toll-like receptor (TLR) and inflammasome action in the central nervous system . Trends Immunol. 2012; ; 33 : :333.–342. 39.
McPherson RC, Anderton MC. Adaptive immune responses in CNS autoimmune disease: mechanisms and therapeutic opportunities . J Neuroimmune Pharmacol. 2013; ; 8 : :774.–790. 40.
Audinat E, Arnoux I. La microglie : des cellules immunitaires qui sculptent et contrôlent les synapses neuronales . Med Sci (Paris). 2014; ; 30 : :153.–159. 41.
Le Louveau A. drainage lymphatique cérébral : implication dans la tolérance immunitaire . Med Sci (Paris). 2015; ; 31 : :953.–956. |