La sphingosine 1-phosphate (S1P) est un lipide impliqué dans la régulation de la prolifération, la survie, la migration, et l’invasion cellulaires. Il intervient également dans l’angiogenèse [1]. La S1P est le produit de la phosphorylation de la sphingosine par les sphingosine kinases. Bien que deux isoformes de sphingosine kinases ont été décrites, SphK1 et SphK2, le rôle de la SphK1 est beaucoup mieux caractérisé dans le cancer que celui de la SphK2 [2]. La SphK1, activée par de très nombreux agonistes (facteurs de croissance, hormones, cytokines, etc.), génère la S1P qui peut alors être sécrétée et agir de façon extracellulaire. Elle se lie à l’un de ses cinq récepteurs (S1P1-5), qui sont des récepteurs couplés aux protéines G, induisant ainsi une cascade de signalisation autocrine ou paracrine [1, 3]. La S1P peut également agir de façon intracellulaire par des mécanismes qui restent, pour une large part, à élucider [1, 3]. Dans le cancer, le métabolisme de la S1P est souvent dérégulé, suggérant que la voie shingosine/SphK1/S1P puisse être une cible thérapeutique potentielle [2]. Un anticorps monoclonal neutralisant l’activité de la S1P extracellulaire, le SphingomabTM, a permis de démontrer son importance dans la croissance tumorale et le potentiel métastatique lorsqu’elle est sécrétée par les tumeurs [4, 5] ou le microenvironnement tumoral [6, 23]. (→)
(→) Voir la Synthèse de L. Treps et J. Gavard, page 989 de ce numéro
L’hypoxie, qui correspond à la diminution du taux normal d’oxygène dans un tissu, est retrouvée dans plusieurs conditions physiopathologiques. Dans le cancer, l’hypoxie contribue au développement d’un phénotype agressif et est associée à un mauvais pronostic pour les patients [7, 8]. La formation d’une masse tumorale de volume croissant conduit à un éloignement du vaisseau sanguin le plus proche. L’oxygène nécessaire à la chaîne respiratoire cellulaire s’amenuise donc, conduisant à une hypoxie. Une conséquence majeure de l’hypoxie est la production, par la tumeur, de facteurs angiogéniques comme le VEGF (vascular endothelial growth factor, facteur de croissance de l’endothélium vasculaire) afin de former de nouveaux vaisseaux capables d’approvisionner la tumeur en oxygène et en nutriments [9, 10]. Cette angiogénèse débridée va cependant générer un réseau vasculaire immature caractérisé par des vaisseaux très perméables. Les répercussions de ce phénomène sont multiples : inefficacité à apporter l’oxygène ce qui renforce de fait, l’hypoxie intratumorale ; inefficacité des traitements conventionnels, comme les chimiothérapies, qui ne peuvent atteindre le cœur de la tumeur ; et enfin, promotion de l’échappement des cellules tumorales (les cellules échappent au contrôle du système immunitaire et peuvent coloniser de nouveaux tissus) [11].
D’un point de vue mécanistique, l’hypoxie entraîne la stabilisation des facteurs de transcription HIF (hypoxia inducible factor) dont HIF-1 est le représentant canonique [8, 12]. Ces facteurs sont composés d’une sous-unité HIFα, régulée par le taux en oxygène, et d’une sous-unité HIFβ qui est exprimée de manière constitutive. En condition normale d’oxygénation (normoxie), la protéine HIFα est très instable. Hydroxylée par des prolyl-hydroxylases (PHD), elle est alors reconnue par le suppresseur de tumeur pVHL (protéine de Von Hippel-Lindau), entraînant son ubiquitination et sa dégradation par le protéasome. En condition d’hypoxie, les prolyl-hydroxylases sont inactives. HIFα n’est donc plus dégradé ; il s’accumule dans le cytoplasme, avant de rejoindre le noyau et de s’associer avec son partenaire HIFβ formant ainsi le facteur HIF [12]. Le dimère se fixe alors sur les séquences consensus HRE (hypoxia responsive element) présentes au niveau des promoteurs de plus de 100 gènes cibles impliqués dans la prolifération cellulaire, la survie cellulaire, l’angiogenèse, le métabolisme du glucose et la régulation du pH.
Une relation entre la voie de signalisation SphK1/S1P et les mécanismes d’adaptation à l’hypoxie a récemment été mise en évidence dans le cancer. Nos précédents travaux avaient montré que l’activité de la sphingosine kinase SphK1 était augmentée lors de l’hypoxie et cela, dans de nombreux modèles tumoraux humains (sein, rein, prostate, gliome, poumon) [13]. Nous avions également montré que l’inhibition pharmacologique, par la méthode d’interférence ARN, de la SphK1 entraînait une diminution de son activité jusqu’à 90 % en condition d’hypoxie, résultant en une baisse du taux de HIF-1α et de l’expression de ses gènes cibles [13]. D’un point de vue mécanistique, l’accumulation de HIF-1α dépendante de la S1P repose sur l’activation de la voie de signalisation Akt (protein kinase B [PKB])/GSK3β (glycogen synthase kinase 3β) connue pour réguler la stabilisation de HIF-1α lors d’une hypoxie [14]. En amont, la voie de signalisation PI3K (inositol 1,4,5-trisphosphate 3-kinase)/Akt peut être induite par tous les récepteurs à S1P [15], suggérant que l’activation de la SphK1 en condition d’hypoxie peut être associée à une signalisation autocrine/paracrine de la S1P extracellulaire sécrétée par les cellules hypoxiques.
Nos derniers résultats [16] démontrent que la neutralisation de la S1P extracellulaire, par le SphingomabTM, diminue de façon significative l’accumulation de HIF-1α en conditions d’hypoxie, dans différentes lignées tumorales humaines (prostate, gliome, poumon). L’accumulation de HIF-1α en conditions d’hypoxie est bien la conséquence d’une sécrétion de S1P par les cellules hypoxiques, puisqu’une stratégie d’interférence ARN dirigée contre Spns2 (spinster homolog 2), un transporteur de la S1P, bloque également l’accumulation de HIF-1α en conditions d’hypoxie et que ceci peut être annulé par l’addition de S1P exogène.
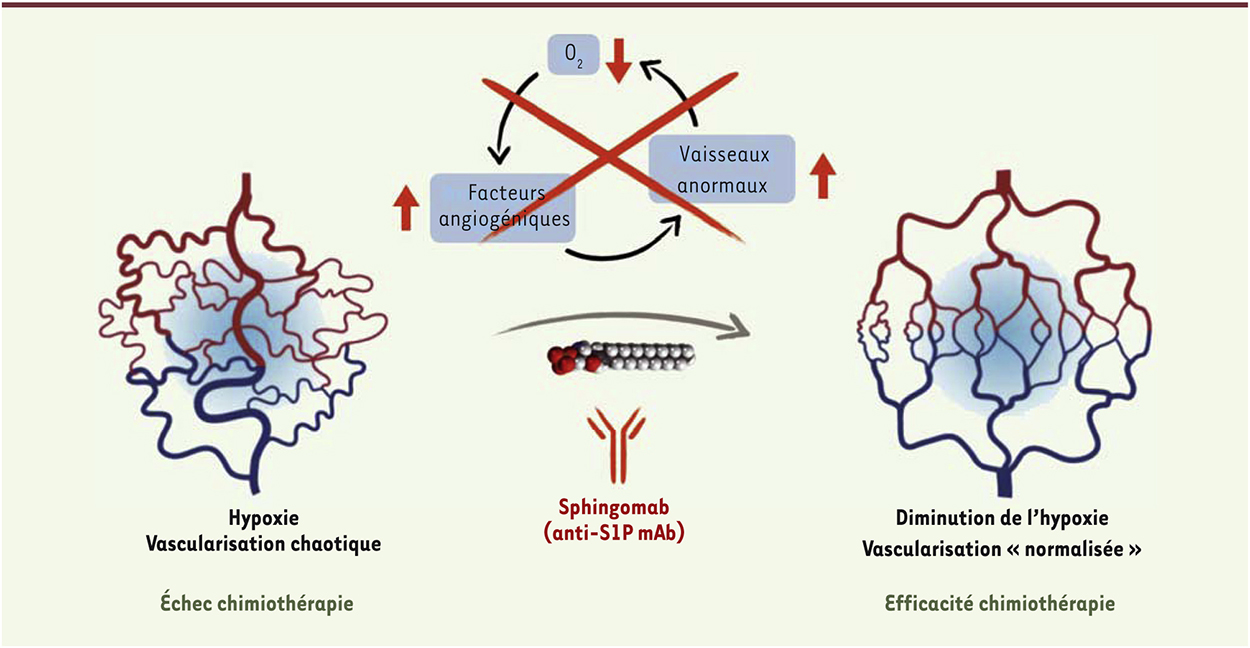
Sur la base de ces résultats obtenus in vitro, nous avons cherché à évaluer l’impact d’un ciblage de S1P en utilisant l’anticorps SphingomabTM au niveau du compartiment tumoral et du compartiment vasculaire, dans un modèle animal de cancer de la prostate. En clinique humaine, ce cancer est considéré comme une tumeur hypoxique et de nombreuses études ont établi une corrélation entre d’une part l’hypoxie, le réseau vasculaire immature ou le taux de VEGF (vascular endothelial growth factor) et d’autre part l’agressivité tumorale, le potentiel métastatique et la survie globale des patients [17, 18]. Le protocole que nous avons utilisé repose sur la xénogreffe orthotopique de cellules tumorales prostatiques (des cellules prélevées au niveau de tumeurs prostatiques chez des patients sont greffées dans la prostate de souris nude immunodéficientes). Cette approche permet d’évaluer l’effet des traitements sur l’histoire naturelle des cancers et d’examiner leur évolution dans un microenvironnement tissulaire et vasculaire proche de ceux rencontrés en physiopathologie humaine. La réponse à l’hypoxie repose sur le microenvironnement vasculaire que les modèles sous-cutanés classiques ne parviennent pas à mimer [19]. Dans notre modèle, l’anticorps anti-S1P inhibe l’hypoxie intra-tumorale (déterminée par l’évaluation de l’expression et de l’activité de HIF-1α et le marquage des tissus au pimonidazole qui est spécifique des tissus hypoxiques). De plus, l’anticorps induit des modifications de l’architecture vasculaire : on observe en effet, grâce à un marquage immunohistochimique, une augmentation de la zone couverte des vaisseaux intra-tumoraux par les péricytes1. En conséquence, l’anticorps améliore la perfusion de la tumeur (mesurée par échographie Doppler) dès 5 jours de traitement.
Le ciblage de la voie de la S1P par le SphingomabTM répond aux critères d’approche non conventionnelle visant à briser le cercle vicieux hypoxie/néoangiogenèse. Le remodelage des vaisseaux tumoraux et l’augmentation de la perfusion vasculaire induits par le SphingomabTM, en quelques jours de traitement (de 5 à 9 jours), suggèrent que cet anticorps permettrait de rendre la tumeur plus sensible aux thérapeutiques conventionnels comme la chimiothérapie. Le concept de « normalisation vasculaire », introduit par Jain et al. [20] et récemment validé en clinique humaine par des stratégies ciblant le VEGF [21, 22], propose que la normalisation des vaisseaux sanguins tumoraux permettrait d’augmenter l’efficacité des traitements en favorisant leur pénétration au sein de la tumeur. L’effet chimiosensibiliant d’un prétraitement avec l’anti-S1P a été ainsi étudié en utilisant différents schémas d’administration en association avec une chimiothérapie utilisant le docétaxel2. De façon très nette, l’effet anti-tumoral maximal vis-à-vis de la tumeur primaire a été observé lorsque l’anti-S1P est administré 5 jours avant la chimiothérapie. La taille de la tumeur est alors divisée par 7 par rapport à celle observée dans le groupe non traité, par 3 par rapport au groupe recevant seulement la chimiothérapie au docétaxel et par 2 par rapport au groupe dans lequel les deux traitements (anti-S1P et docétaxel) ont été administrés en même temps. Notre modèle, dans lequel les cellules tumorales sont identifiables par fluorescence, a également permis d’étudier de façon précise l’effet de ces divers schémas de traitement sur la dissémination métastatique démontrant, de nouveau, le bénéfice qu’apporte l’administration de l’anti-S1P avant la chimiothérapie (le nombre de métastases par animal est en effet divisé par 2).
En conclusion, ces données obtenues dans un modèle animal de cancer de la prostate montrent clairement que l’amélioration de l’architecture vasculaire (Figure 1), également appelée « normalisation vasculaire », induite par le traitement avec le SphingomabTM, permet de sensibiliser très significativement la tumeur à la chimiothérapie de référence (le docétaxel). Ces résultats représentent donc la preuve de concept que la neutralisation par un anticorps spécifique de la S1P en excès dans le microenvironnement tumoral pourrait être applicable chez l’homme. La version humanisée du SphingomabTM, l’ASONEP™, est actuellement en cours d’évaluation clinique dans une étude de phase 2a, pour le cancer du rein réfractaire aux traitements anti-angiogéniques3. Les résultats que nous avons obtenus chez l’animal nous encouragent désormais à évaluer une stratégie fondée sur l’anti-S1P chez l’homme. Grâce à l’utilisation de techniques d’imagerie non invasives qui permettent de mesurer la perfusion vasculaire de la tumeur (DCE-MRI, dynamic contrast-enhanced magnetic resonance imaging) et/ou son degré d’hypoxie (par tomographie par émission de positions [PET-SCAN], couplée à des traceurs sensibles à l’hypoxie), il sera possible de déterminer l’effet du traitement anti-S1P et donc d’identifier parmi les patients, ceux qui pourraient bénéficier d’une association de ce traitement avec une chimiothérapie ou une radiothérapie.
| Figure 1.
Effet de l’anticorps anti-S1P sur l’hypoxie et la vasculature intratumorales. En bloquant le cercle vicieux hypoxie/néoangiogenèse/hypoxie associé à l’échec de la chimiothérapie, l’anticorps anti-S1P favorise une amélioration temporaire de l’architecture vasculaire, ou « normalisation vasculaire », qui permet d’augmenter de façon très significative l’effet de la chimiothérapie. |