| |
| Med Sci (Paris). 2015 November; 31(11): 956–959. Published online 2015 November 17. doi: 10.1051/medsci/20153111006.Une implication des fibres sérotoninergiques qui va au-delà des dyskinésies induites par la L-DOPA Maude Beaudoin-Gobert,1,2 Léon Tremblay,1,2 and Véronique Sgambato-Faure1,2* 1Centre de Neuroscience Cognitive, UMR 5229 CNRS, 67, boulevard Pinel, 69675Bron, France 2Université Claude Bernard Lyon 1, 69100Villeurbanne, France MeSH keywords: Animaux, Modèles animaux de maladie humaine, Dyskinésie due aux médicaments, Humains, Lévodopa, Macaca, Maladie de Parkinson, Neurones sérotonergiques, physiopathologie, effets indésirables, traitement médicamenteux, anatomopathologie, physiologie |
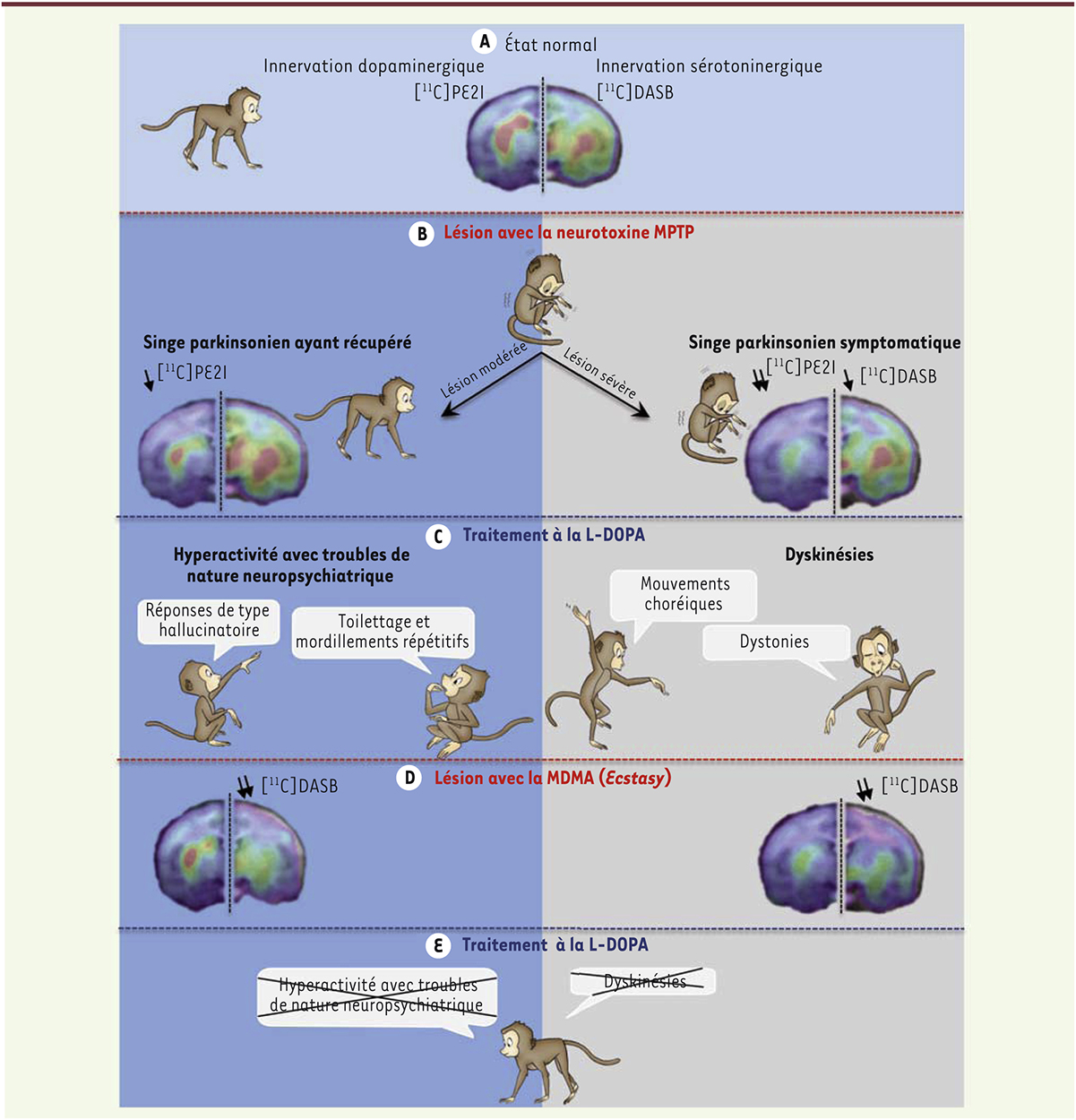
La maladie de Parkinson est une des affections neurodégénératives les plus fréquentes. Elle découle d’une perte progressive et irréversible des neurones dopaminergiques de la substance noire, entraînant une perte de dopamine au niveau du cerveau. Au stade précoce de la maladie, lorsque la perte neuronale commence, les patients parkinsoniens ne présentent pas encore de symptômes moteurs. Avec la progression de la maladie, la perte neuronale s’accroît. Les patients présentent alors des symptômes regroupés sous le terme de triade motrice : une akinésie/bradykinésie (c’est-à-dire une difficulté à initier des mouvements et une lenteur dans leur exécution), une rigidité articulaire et un tremblement au repos. L’administration orale de L-DOPA (L-3,4-dihydroxyphenylalanine), le précurseur naturel de la dopamine, ou d’agonistes dopaminergiques, permet de pallier le manque de dopamine dans le cerveau et de remédier aux symptômes moteurs. Toutefois, ces traitements pharmacologiques induisent à long terme des complications motrices très invalidantes pour les patients parkinsoniens, comme des mouvements anormaux involontaires, appelés dyskinésies [1]. Les patients parkinsoniens peuvent également présenter des complications non motrices, de nature neuropsychiatrique, comme des troubles de l’humeur, des désordres comportementaux ou des hallucinations [2]. À ce jour, il n’existe pas de traitement médicamenteux efficace permettant de lutter contre ces complications motrices et non motrices. La prise en charge des patients parkinsoniens constitue donc un défi thérapeutique majeur puisqu’il est nécessaire de contrecarrer les symptômes parkinsoniens tout en limitant les effets indésirables induits par les traitements médicamenteux eux-mêmes. Bien que la dégénérescence des neurones dopaminergiques soit la caractéristique majeure de la maladie de Parkinson, les traitements mimant les effets de la dopamine ne corrigent pas tous les symptômes parkinsoniens [3]. D’autres systèmes de neuromodulation sont en effet altérés dans le cerveau et sont vraisemblablement impliqués également dans la physiopathologie de la maladie de Parkinson. Ainsi, une attention particulière a été portée ces dernières années sur le système sérotoninergique reposant sur les noyaux du raphé1. En effet, les patients parkinsoniens présentent une altération de la transmission sérotoninergique, en complément de la lésion dopaminergique, qui est corrélée à la sévérité des tremblements et des dyskinésies [4]. Cette altération sérotoninergique paraît aussi liée à l’état de fatigue, à l’état dépressif et à l’état psychotique des patients [4]. Nous avons récemment développé un nouveau modèle animal de la maladie de Parkinson afin d’évaluer précisément l’impact de l’altération sérotoninergique, par rapport à celle du système dopaminergique, sur la symptomatologie parkinsonienne (triade motrice et complications en réponse à la L-DOPA) (Figure 1). Ce modèle consiste en la mise en place d’une lésion du système sérotoninergique chez des animaux préalablement rendus parkinsoniens [5]. Il est en effet possible d’induire des symptômes parkinsoniens chez le singe macaque par l’administration systémique de 1-méthyl-4-phényl-1,2,3,6-tétrahydropyridine (MPTP), une neurotoxine détruisant préférentiellement les neurones dopaminergiques [6]. Nous avons reproduit, dans un premier temps, les effets de l’intoxication au MPTP chez les singes [7]. L’administration aiguë de la toxine induit un parkinsonisme sévère et stable qui est associé à une perte très importante de neurones dopaminergiques. Les animaux traités conservent alors les symptômes parkinsoniens ; ils sont « symptomatiques ». En revanche, l’administration progressive de MPTP provoque un parkinsonisme moins sévère qui s’accompagne d’une perte de neurones dopaminergiques plus modérée. Les singes récupèrent spontanément de leurs symptômes moteurs (ils sont « récupérés ») (Figure 1). Utilisant ce modèle, nous avons montré ensuite que l’administration systémique de la 3,4-méthylène dioxyméthamphétamine (MDMA ou Ecstasy) permet d’induire chez les animaux une lésion cérébrale additionnelle touchant les fibres sérotoninergiques [5] (Figure 1).
 | Figure 1.
État d’innervation des systèmes dopaminergique et sérotoninergique étudié par imagerie par tomographie à émission de positons (TEP) à l’aide de ligands radioactifs spécifiques. Le [11C]PE2I, une molécule qui se fixe au transporteur dopaminergique, révèle ainsi l’intégrité des fibres dopaminergiques (présenté ici systématiquement sur l’hémisphère gauche du cerveau) et le [11C]DASB (3-amino-4-[2-diméthylaminométhylphénylsulfanyl]-benzonitrile), qui se lie au transporteur sérotoninergique, révèle ainsi l’intégrité des fibres sérotoninergiques (présenté ici systématiquement sur l’hémisphère droit du cerveau). A. À l’état normal, les deux systèmes sont intacts. B. Après traitement par le 1-méthyl-4-phényl-1,2,3,6-tétrahydropyridine (MPTP), les singes sévèrement parkinsoniens présentent une forte atteinte dopaminergique ainsi qu’une légère atteinte sérotoninergique. Les singes modérément parkinsoniens récupèrent de leurs symptômes moteurs et présentent une atteinte dopaminergique plus modérée et aucune atteinte sérotoninergique. C. Un traitement chronique par la L-DOPA des singes récupérés intoxiqués par le MPTP induit une hyperactivité comportementale accompagnée de troubles de nature neuropsychiatrique et, chez les singes symptomatiques, des dyskinésies sévères. D. L’administration de la 3,4-méthylène dioxyméthamphétamine (MDMA) induit une lésion sérotoninergique objectivée par la diminution drastique de la fixation du [11C]DASB chez tous les animaux. E. Après lésion par la MDMA, le traitement chronique par la L-DOPA n’induit plus d’effets secondaires. L’effet bénéfique antiparkinsonien du traitement est toutefois conservé. |
|
Quelles sont les conséquences de la lésion sérotoninergique sur la triade motrice et sur les complications induites par la L-DOPA ? Pour la première fois, nous avons pu montrer que la lésion sérotoninergique induite par la MDMA n’a pas d’impact sur le tremblement ou l’akinésie/bradykinésie. En revanche, elle favorise la rigidité que l’on observe chez les patients parkinsoniens [5]. Cette implication du système sérotoninergique dans la rigidité parkinsonienne n’a jamais été rapportée dans la littérature, probablement parce que la rigidité est souvent associée à l’akinésie chez les patients parkinsoniens (sous-type akinéto-rigide) et qu’elles sont reliées à la lésion du système dopaminergique [8, 9]. De plus, la rigidité est un symptôme qui est peu évalué dans les modèles de Parkinson développés chez les singes [6]. Lors de l’évaluation des animaux rendus parkinsoniens, nous avons observé que les animaux développaient, avant la lésion sérotoninergique, des complications après un traitement chronique par la L-DOPA. Les singes « symptomatiques » développaient en effet des dyskinésies, ceux ayant récupéré montrant, eux, une hyperactivité comportementale avec des troubles de nature neuropsychiatrique [5] (Figure 1). Ces troubles consistent en une agitation, des réponses de type hallucinatoire, ainsi que du toilettage et du mordillement répétitifs, et des stéréotypies. Ils rappellent les phases maniaques, les hallucinations, les comportements obsessionnels et compulsifs, que peuvent présenter les patients parkinsoniens sous traitement dopaminergique [2]. De façon intéressante, la lésion des fibres sérotoninergiques par la MDMA a permis la diminution drastique, voire l’abolition complète, des dyskinésies chez les singes macaques « symptomatiques », mais également l’abolition des troubles comportementaux des singes « récupérés » [5] (Figure 1). |
Cette étude permet une avancée majeure dans la compréhension de la physiopathologie de la maladie de Parkinson. Elle démontre que la lésion des fibres sérotoninergiques induite par la MDMA modifie l’expression de la rigidité et abolit à la fois les complications motrices et non motrices qui sont induites par une lévodopathérapie (c’est-à-dire fondée sur la L-DOPA) dans le modèle de la maladie de Parkinson chez le singe macaque. Ces résultats sont en accord avec l’hypothèse selon laquelle, dans la maladie de Parkinson, les fibres sérotoninergiques seraient soumises à une plasticité anormale [4]. Elles seraient ainsi capables de capter la L-DOPA et de la transformer en dopamine, la libérant de manière incontrôlée dans des régions motrices et produisant des dyskinésies. Dans notre étude, la lésion sérotoninergique abolirait cette libération incontrôlée de dopamine. Nos résultats montrent également que les fibres sérotoninergiques jouent un rôle significatif dans l’apparition des symptômes non moteurs induits par la L-DOPA. La plasticité aberrante des fibres sérotoninergiques pourrait donc prendre place dans des régions non motrices [5]. Ainsi, elles pourraient avoir un rôle dans les troubles du mouvement mais également dans les désordres comportementaux que l’on observe. Il serait donc particulièrement intéressant d’étudier le lien possible existant entre une altération précoce du système sérotoninergique et l’expression (voire la sévérité) des symptômes non moteurs comme la dépression, l’apathie ou l’anxiété que l’on observe chez les patients parkinsoniens. Si les fibres sérotoninergiques sont ainsi lésées, cela permettrait d’expliquer pourquoi certains traitements comme les antidépresseurs (qui sont des inhibiteurs de la recapture de la sérotonine agissant sur les fibres sérotoninergiques) perdent de leur efficacité chez les patients. Enfin, il faut noter que la MDMA (ou Ecstasy) est une drogue dont nous avons confirmé le potentiel neurotoxique chez le primate non humain [5] comme cela a déjà été montré chez l’homme [10]. Les patients parkinsoniens ne pourront donc pas être traités par la 3,4-méthylène dioxyméthamphétamine (MDMA) pour combattre leurs dyskinésies au risque de les rendre encore plus dépressifs, apathiques ou anxieux. Néanmoins, l’utilisation d’agents pharmacologiques agissant sur les récepteurs sérotoninergiques présents sur d’autres neurones, pourrait contrebalancer les conséquences fonctionnelles de l’altération de ces fibres sérotoninergiques. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Le travail présenté ici a été soutenu par la Fondation de France (201234497 et 00016818), la Fondation pour la Recherche Médicale (DEQ20110421326) et l’Agence Nationale de la Recherche (ANR-09-MNPS-018). Nous remercions Prisca Beaudoin pour sa participation au graphisme de la Figure 1.
|
Footnotes |
1.
Obeso JA, Olanow CW, Nutt JG. Levodopa motor complications in Parkinson’s disease . Trends Neurosci. 2000; ; 23 : :S2.–S7. 2.
Chaudhuri KR, Schapira AHV. Non-motor symptoms of Parkinson’s disease: dopaminergic pathophysiology and treatment . Lancet Neurol. 2009; ; 8 : :464.–474. 3.
Barone P. Neurotransmission in Parkinson’s disease: beyond dopamine . Eur J Neurol. 2010; ; 17 : :364.–376. 4.
Politis M, Niccolini F. Serotonin in Parkinson’s disease . Behav Brain Res. 2015; ; 277 : :136.–145. 5.
Beaudoin-Gobert M, Epinat J, Météreau E, et al. Behavioral impact of a double dopaminergic and serotonergic lesion in the non-human primate . Brain. 2015; ; 138 : :2632.–2647. 6.
Porras G, Li Q, Bezard E. Modeling Parkinson’s disease in primates: the MPTP model . Cold Spring Harb Perspect Med. 2012; ; 2 : :a009308.. 7.
Mounayar S, Boulet S, Tandé D, et al. A new model to study compensatory mechanisms in MPTP-treated monkeys exhibiting recovery . Brain. 2007; ; 130 : :2898.–2914. 8.
Jellinger KA. Post-mortem studies in Parkinson’s disease: is it possible to detect brain areas for specific symptoms? J Neural Transm. 1999; ; 56 : :1.–29. 9.
Politis M. Neuroimaging in Parkinson disease: from research setting to clinical practice . Nat Rev Neurol. 2014; ; 10 : :708.–722. 10.
De Win MM, Jager G, Booij J, et al. Neurotoxic effects of ecstasy on the thalamus . Br J Psychiatry. 2008; ; 193 : :289.–296. |