| |
| Med Sci (Paris). 2015 November; 31(11): 953–956. Published online 2015 November 17. doi: 10.1051/medsci/20153111005.Le drainage lymphatique cérébral Implication dans la tolérance immunitaire Antoine Louveau1* 1Research group of Jonathan Kipnis, center for brain, immunology and glia, neuroscience department, university of Virginia, 409 Lane Road, 22903Charlottesville, États-Unis MeSH keywords: Transport biologique, Encéphale, Liquide cérébrospinal, Rejet du greffon, Humains, Système lymphatique, Vaisseaux lymphatiques, cytologie, immunologie, métabolisme, physiologie |
La tolérance immunitaire du cerveau Un organe, ou un tissu, bénéficie d’un privilège immun lorsqu’une greffe de tissu dans cet organe est ignorée, ou lentement rejetée, par le système immunitaire de l’hôte. Lorsqu’au début des années 1900, Medawar et d’autres transplantèrent des tumeurs, des tissus fœtaux mais aussi des biopsies de peau dans le parenchyme cérébral de lapin, ils constatèrent le lent rejet de ces tissus étrangers, en comparaison de greffes similaires réalisées dans l’abdomen de l’animal, rejetées beaucoup plus rapidement. De ces premières expériences, a découlé le concept que le cerveau et le système nerveux central (SNC) en général sont des organes immunologiquement privilégiés où les réponses immunitaires sont lentes ou inexistantes [1, 13] (→).
(→) Voir la Synthèse de J. Renaud et al., page 979 de ce numéro
Les raisons invoquées pour cette particularité sont multiples, notamment de par la présence de la barrière hémato-encéphalique, l’absence de cellules présentatrices d’antigènes au sein du parenchyme cérébral, mais également l’absence d’un réseau lymphatique. La barrière hémato-encéphalique est constituée de la combinaison des jonctions serrées des cellules endothéliales, de la lame basale de ces dernières, ainsi que des pieds astrocytaires. Elle forme ainsi une barrière qui limite l’accès des pathogènes, des cellules, ainsi que de certaines molécules plasmatiques, au parenchyme cérébral [2, 3]. Cependant, des expériences réalisées par Medawar lui-même montrèrent que, lorsque la greffe de peau au niveau du cerveau était précédée d’une greffe provenant d’un même donneur, dans l’abdomen, alors la greffe intracérébrale était rejetée aussi rapidement qu’une autre greffe. Ceci montrait que lorsqu’elles étaient activées en périphérie, les cellules immunitaires, responsables du rejet, étaient capables de franchir la barrière hémato-encéphalique, d’infiltrer le parenchyme cérébral et d’induire le rejet de la greffe [1], relativisant ainsi le rôle de la barrière dans la tolérance immunitaire cérébrale. Afin qu’une réponse immunitaire soit initiée, les allo-antigènes de la greffe doivent être drainés, et les cellules dendritiques doivent migrer vers les ganglions pour activer le système immunitaire. Dans les organes périphériques, cette fonction est assurée par le système lymphatique, un réseau vasculaire connectant les tissus périphériques aux ganglions. L’absence (supposée) d’un tel système au niveau du cerveau, est apparue comme une raison majeure pour expliquer la tolérance immunitaire que l’on observe dans cet organe. |
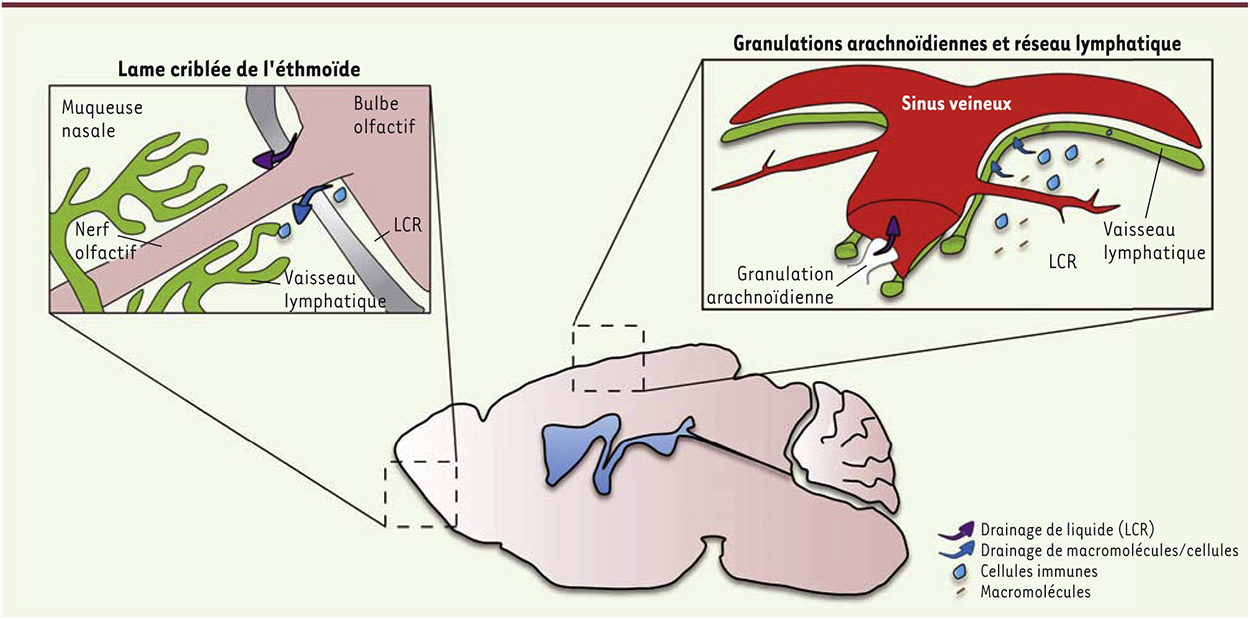
Le drainage du liquide céphalorachidien Dans les organes périphériques, le liquide interstitiel est recyclé par le système lymphatique. Il empêche ainsi l’accumulation de substances toxiques (métabolites cellulaires ou débris issus de cellules nécrotiques). Contrairement aux autres organes, le système nerveux central, en plus de présenter un liquide interstitiel circulant au sein du parenchyme cérébral, baigne dans le liquide céphalorachidien (LCR) qui permet la circulation de neurotransmetteurs et de cytokines, mais aussi l’élimination des déchets provenant du parenchyme. Le LCR est produit par les cellules épithéliales des plexus choroïdes. Il circule des ventricules vers l’espace sous-arachnoïdien situé dans les méninges qui, composées de trois membranes (la pie-mère, l’arachnoïde et la dure-mère), entourent et protègent le cerveau et la moelle épinière. Les preuves d’un lien direct entre le LCR et les ganglions cervicaux profonds ne sont pas nouvelles. Elles découlent d’études originales, réalisées principalement sur de gros mammifères, chez lesquels l’excision des ganglions cervicaux, ou la ligature des vaisseaux lymphatiques du cou, engendre des troubles neuropathologiques (œdèmes des ventricules latéraux, hydrocéphalie, augmentation de la pression intracrânienne, augmentation de l’espace péricapillaire, ou encore des signes de dégénérescence axonale) [4]. Cependant, la ou les voie(s) empruntée(s) par le LCR pour rejoindre les ganglions cervicaux sont encore un sujet de débat. La pression du LCR se doit d’être maintenue constante afin d’assurer le maintien des fonctions cérébrales. L’injection de molécules marquées dans le LCR a permis de mettre en évidence différentes voies de sortie du système nerveux central [5, 6]. Le LCR peut ainsi rejoindre directement le réseau veineux méningé situé dans la dure-mère via les granulations arachnoïdiennes. Cependant, ce système semble permettre principalement le maintien de la pression intracrânienne plutôt qu’être une voie de connexion vers les ganglions cervicaux (Figure 1). Il a été mis en évidence, chez un grand nombre d’espèces animales, un passage du LCR de l’espace sous-arachnoïdien vers le réseau lymphatique de la muqueuse nasale (via la plaque cribriforme de l’ethmoïde1) (Figure 1). Avant la (re)découverte du réseau lymphatique méningé, cette voie était considérée comme l’unique connexion entre le LCR et les ganglions cervicaux profonds, et également comme l’unique voie empruntée par les cellules immunitaires pour sortir du SNC.
 | Figure 1.
Voies de drainage du liquide céphalorachidien et de ces constituants. Alors que le fluide du liquide céphalorachidien est recyclé via les granulations arachnoïdiennes vers le réseau veineux de la dure-mère, mais aussi le long des nerfs olfactifs pour rejoindre la muqueuse nasale, ces constituants (macromolécules et cellules immunitaires) utilisent le réseau lymphatique des méninges et le réseau lymphatique de la muqueuse nasale pour rejoindre les ganglions cervicaux. |
|
Évidence d’un réseau lymphatique cérébral Au contraire du parenchyme cérébral qui est virtuellement dépourvu de cellules immunitaires (hormis la microglie, mais les cellules microgliales ne sont pas circulantes), les méninges en possèdent de nombreuses, y compris en conditions physiologiques. La présence dans les méninges de ces cellules, et plus spécifiquement de lymphocytes T, est importante pour le maintien des fonctions cérébrales [7]. Le compartiment T, à défaut d’être statique, est dynamique, suggérant une constante recirculation des lymphocytes T entre les méninges et les ganglions cervicaux profonds. Pendant longtemps, le chemin parcouru par les cellules immunitaires provenant des méninges pour rejoindre les ganglions cervicaux profonds était non conventionnel. Les cellules immunitaires étaient supposées utiliser les mêmes voies que celles empruntées par le LCR pour quitter le système nerveux central (SNC). Ainsi, puisque le SNC apparaissait dépourvu de système lymphatique, la seule voie utilisable par les cellules immunitaires était la voie de la plaque cribriforme. Par cette voie, les cellules immunitaires devaient sortir du SNC et rejoindre le réseau lymphatique de la muqueuse nasale puis les ganglions [8, 9]. Cependant, des travaux récents ont conduit à l’observation d’un réseau lymphatique conventionnel et fonctionnel au sein même du SNC [10-12], confirmant des hypothèses et des observations réalisées auparavant mais ignorées de la communauté scientifique. L’utilisation de techniques modernes (microscopie confocale et intravitale et souris transgéniques fluorescentes) associée au développement, chez la souris, de nouvelles méthodes de dissection des méninges, ont en effet permis de mettre en évidence la présence, le long des sinus veineux des méninges, de vaisseaux exprimant tous les marqueurs moléculaires des vaisseaux lymphatiques périphériques. Ils apparaissent cependant moins développés que ceux classiquement observés dans le diaphragme ou le derme, et possèdent peu de valves, suggérant des caractéristiques particulières pour ces vaisseaux méningés en relation avec leur localisation et leur environnement. D’un point de vue fonctionnel, les vaisseaux lymphatiques méningés semblent capables de drainer les macromolécules contenues dans le LCR vers les ganglions cervicaux profonds. L’obstruction chirurgicale de ces vaisseaux provoque une diminution du passage des macromolécules du LCR dans les ganglions cervicaux, suggérant une connexion directe entre les vaisseaux lymphatiques méningés et les ganglions cervicaux. Il est important de noter que des cellules immunitaires (lymphocytes T et B, mais aussi cellules dendritiques) ont été observées dans des vaisseaux lymphatiques méningés en conditions physiologiques, suggérant que ces derniers représentent une voie importante de recirculation pour ces cellules. Le rôle respectif des voies conventionnelles (vaisseaux lymphatiques méningés) et non-conventionnelles (plaque cribriforme), dans la circulation des cellules immunitaires en conditions physiologiques et pathologiques, devra cependant être étudié afin de mieux apprécier leur contribution respective. |
Conclusions et perspectives L’ensemble des données obtenues, pour certaines il y a plus de 20 ans, et pour d’autres issues de récents développements, ont démontré la présence d’un réseau lymphatique conventionnel et fonctionnel au sein du SNC, capable de drainer les macromolécules du parenchyme cérébral (via le LCR), mais aussi les cellules immunitaires des méninges vers les ganglions cervicaux. Ces données ne remettent pourtant pas en cause les observations initiales de Medawar. Les greffes effectuées au sein du parenchyme cérébral sont, en effet, toujours rejetées plus lentement que les autres greffes. Les raisons de cette tolérance immunitaire doivent cependant être réévaluées : au lieu d’être considérée comme un phénomène passif lié à l’ignorance du cerveau par le système immunitaire, la tolérance immunitaire pourrait reposer, en fait, sur un processus actif impliquant l’éducation du système immunitaire et le réseau lymphatique méningé. Les prochaines années devraient voir l’émergence de nouveaux travaux sur les relations entre le système nerveux central et le système immunitaire en conditions physiologiques et pathologiques, et ainsi permettre d’ouvrir de nouvelles voies dans la compréhension, mais aussi le développement d’approches thérapeutiques novatrices pour les maladies neurologiques dans lesquelles le système immunitaire tient un rôle majeur. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Medawar PB. Immunity to homologous grafted skin; the fate of skin homografts transplanted to the brain, to subcutaneous tissue, and to the anterior chamber of the eye . Br J Exp Pathol. 1948; ; 29 : :58.–69. 2.
Engelhardt B, Ransohoff RM. Capture, crawl, cross: the T cell code to breach the blood-brain barriers . Trends Immunol. 2012; ; 33 : :579.–589. 3.
Bentivoglio M, Kristensson K. Tryps and trips: cell trafficking across the 100-year-old blood-brain barrier . Trends Neurosci. 2014; ; 37 : :325.–333. 4.
Földi M, Csanda E, Obál F, et al. Uber wirkungen der unterbindung der lymphgefasse und lymphknoten des halses auf das zentralnervensystem im tierversuch . Z Gesamte Exp Med. 1963; ; 137 : :483.–510. 5.
Weller RO, Galea I, Carare RO, Minagar A. Pathophysiology of the lymphatic drainage of the central nervous system: implications for pathogenesis and therapy of multiple sclerosis . Pathophysiology. 2010; ; 17 : :295.–306. 6.
Laman JD, Weller RO. Drainage of cells and soluble antigen from the CNS to regional lymph nodes . J Neuroimmune Pharmacol. 2013; ; 8 : :840.–856. 7.
Kipnis J, Gadani S, Derecki NC. Pro-cognitive properties of T cells . Nat Rev Immunol. 2012; ; 12 : :663.–669. 8.
Goldmann J, Kwidzinski E, Brandt C, et al. T cells traffic from brain to cervical lymph nodes via the cribroid plate and the nasal mucosa . J Leukoc Biol. 2006; ; 80 : :797.–801. 9.
Kaminski M, Bechmann I, Pohland M, et al. Migration of monocytes after intracerebral injection at entorhinal cortex lesion site . J Leukoc Biol. 2012; ; 92 : :31.–39. 10.
Andres KH, von During M, Muszynski K, Schmidt RF. Nerve fibres and their terminals of the dura mater encephali of the rat . Anat Embryol (Berl). 1987; ; 175 : :289.–301. 11.
Louveau A, Smirnov I, Keyes TJ, et al. Structural and functional features of central nervous system lymphatic vessels . Nature. 2015; ; 523 : :337.–341. 12.
Aspelund A, Antila S, Proulx ST, et al. A dural lymphatic vascular system that drains brain interstitial fluid and macromolecules . J Exp Med. 2015; ; 212 : :991.–999. 13.
Renaud J, Thérien HM, Plouffe M, Martinoli MG. La neuro-inflammation : Dr Jekyll ou Mr Hyde ? . Med Sci (Paris). 2015; ; 31 : :979.–988. |