| |
| Med Sci (Paris). 2015 November; 31(11): 945–947. Published online 2015 November 17. doi: 10.1051/medsci/20153111002.Un nouveau concept Le mycobiome pulmonaire Linh Nguyen1* and Laurence Delhaes** 1Centre d’immunologie et d’infectiologie de Lille (BDEEP), Inserm U1019, CNRS UMR 8204, Institut Pasteur de Lille, université de Lille Nord de France, 1, rue du Professeur Calmette, 59019Lille Cedex, France 2Laboratoire de parasitologie-mycologie, CHRU de Lille, faculté de médecine, universitéde Lille 2, Lille, France 3adresse actuelle : service de parasitologie-mycologie, CHU de Bordeaux, université de Bordeaux, France MeSH keywords: Asthme, Maladie chronique, Mucoviscidose, Dysbiose, Champignons, Humains, Poumon, Microbiote, Maladies de l'appareil respiratoire, Traitements en cours d'évaluation, microbiologie, génétique, physiologie, anatomopathologie, thérapie, tendances |
Introduction et fondement du concept de mycobiome pulmonaire Alors que le microbiome bactérien et son rôle en médecine sont largement étudiés, peu d’études ont porté sur la composante fongique (mycobiote et mycobiome)1 des communautés polymicrobiennes humaines [17, 18] (→).
(→) Voir la Nouvelle de F. Brégeon et J.M. Rolain, et la Synthèse de C. Andréjak et L. Delhaes, pages 947 et 971 de ce numéro
Quelques études se sont intéressées au mycobiote digestif ou cutané [1, 2], très peu ont abordé le mycobiote pulmonaire [3–7]. Pourtant, plusieurs éléments démontrent l’importance de la flore fongique dans les pathologies respiratoires chroniques telles que la broncho-pneumopathie chronique obstructive (BPCO), l’asthme ou la mucoviscidose : (1) les spores (ou conidies) de champignons sont de petite taille (2 à 10 µm), très facilement inhalées. Notre appareil respiratoire est donc exposé quotidiennement à des milliers de spores (un adulte respirant environ 15 m3 d’air par jour contenant de 102 à 105 spores [8]) ; (2) la pertinence clinique d’une colonisation fongique, ou d’une sensibilisation telle que l’aspergillose broncho-pulmonaire allergique (ABPA), a été largement démontrée dans la mucoviscidose et l’asthme. Jusqu’à présent, l’étude de la colonisation fongique a porté sur les espèces capables de croître en condition standard de culture telles qu’Aspergillus, Candida, et à un degré moindre Scedosporium et Exophiala. Ces différents agents fongiques sont susceptibles d’augmenter la mortalité et la morbidité des patients [8–10] ; (3) les traitements antibiotiques pourraient faciliter le développement des infections fongiques pulmonaires chez ces patients. De même, l’utilisation de traitements immunosuppresseurs (corticostéroïdes au long cours ou autres) favorise le développement d’infections fongiques invasives et graves, en particulier dans un contexte de transplantation, mais également sur fond de pathologie chronique telle que la BPCO où des cas d’aspergillose semi-invasive ont été rapportés [11–13] ; (4) enfin, les champignons sont capables d’interagir notamment avec des bactéries [14]. Ils peuvent aussi former des biofilms et induire une résistance aux traitements anti-infectieux. Le concept de mycobiome (incluant le mycobiome pulmonaire) représente aujourd’hui un nouveau champ de recherche en pleine expansion, que les techniques de séquençage haut-débit rendent plus accessible [1, 2, 15]. Son étroite corrélation avec les pathologies pulmonaires et la réponse immune locale, ainsi qu’avec les mycobiomes des autres sites corporels, commencent à être analysés [1, 2]. |
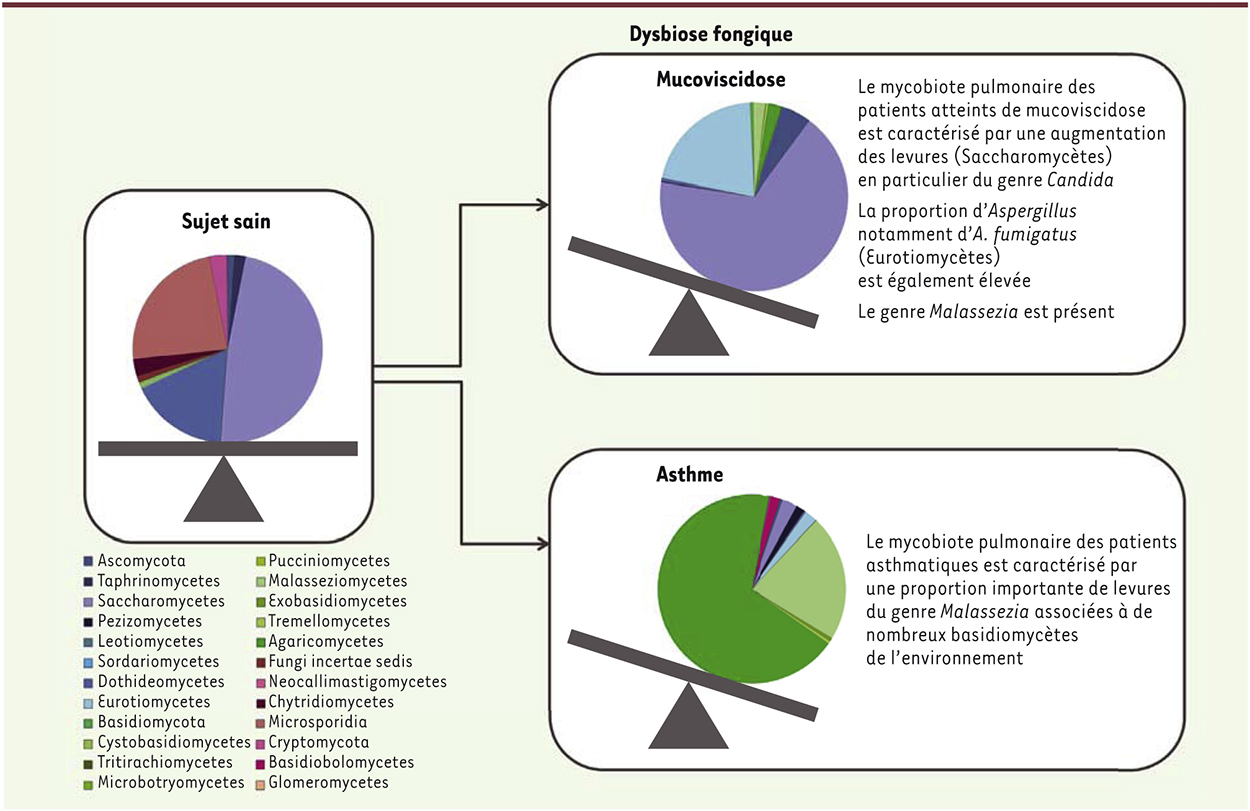
Du concept à l’établissement du mycobiote pulmonaire sain et son corollaire, le mycobiote dysbiotique Aujourd’hui, le microbiote pulmonaire est considéré comme une communauté polymicrobienne composée de bactéries, de virus et phages, mais aussi de micromycètes. Cependant, la dynamique spatiale et temporelle de cette communauté fongique reste peu étudiée et mal connue, tout comme ses conséquences éventuelles sur la progression de la pathologie respiratoire ou sur la prise en charge thérapeutique [2]. À ce jour, quelques études ont analysé et identifié le mycobiote pulmonaire du sujet sain et/ou les profils de mycobiote modifié (ou dysbiose) caractérisant un contexte pathologique spécifique (asthme, mucoviscidose et transplantation pulmonaire). En utilisant les approches de séquençage à haut débit, toutes ces études ont mis en évidence une flore fongique beaucoup plus riche que celle identifiée par méthode conventionnelle (culture et/ou PCR ciblant un pathogène) [3–7]. En effet, ces techniques offrent la possibilité théorique d’identifier toutes les espèces fongiques présentes (y compris celles réfractaires à la culture comme Pneumocystis jirovecii) et de générer des données détaillées, précises et sans a priori sur cette communauté microbienne [3–7]. Chez les sujets sains [1, 2, 4, 6], le mycobiote pulmonaire comporte de nombreux champignons issus de l’environnement dont des Aspergillus, des Cladosporium, des Penicillium et beaucoup de levures (Figure 1). Sa composition est proche de celle du mycobiote buccal [1, 2, 4]. Chez les patients atteints de mucoviscidose, les mêmes genres ont été identifiés : Candida, en particulier Candida albicans, Aspergillus, Penicillium, Cryptococcus et Eurotium (qui appartiennent à la classe des Ascomycètes et correspondent notamment à des formes sexuées de certaines espèces d’Aspergillus) prédominent (Figure 1) [4, 5]. Les caractéristiques écologiques de ce mycobiote (diversité et richesse des espèces fongiques) semblent corrélées à l’évolution clinique des patients : un statut clinique peu favorable est en effet associé à une moins grande diversité et richesse fongique [4, 5]. De façon surprenante, les espèces du genre Malassezia ont été isolées en grande quantité chez ces patients [5, 7]. L’espèce Malassezia pachydermatis, responsable de troubles allergiques, a notamment été isolée chez les patients asthmatiques au cours d’une étude cas-témoins [6] (Figure 1). Le genre Malassezia est également présent au sein du mycobiote cutané (son habitat naturel), de la cavité buccale et de la muqueuse naso-sinusale de patients présentant une sinusite chronique [1, 2].
 | Figure 1.
Mycobiote dysbiotique au cours des pathologies respiratoires chroniques (d’après [ 5– 7]). |
Ces premières études, très encourageantes, montrent que le mycobiote pulmonaire diffère d’un individu à un autre, et qu’il évolue dans le temps, en fonction du contexte clinique. Sur le plan descriptif, la mise en évidence des espèces du genre Candida et Malassezia est à noter. En effet, les Candida ont déjà été associés à une dégradation de la fonction respiratoire. La présence de Malassezia dans les sphères oto-rhino-laryngologique et respiratoire laissent à penser que ce genre pourrait avoir un rôle important dans la stabilité de ces écosystèmes. |
Perspectives : vers une intégration du mycobiome pulmonaire dans l’étude et la prise en charge des maladies respiratoires chroniques Même si des améliorations méthodologiques et une plus grande standardisation restent à faire, les approches de séquençage haut-débit représentent aujourd’hui une stratégie novatrice et prometteuse, tant sur le plan méthodologique que conceptuel, en modifiant notre façon d’appréhender la pathologie pulmonaire. Mieux connaître la communauté fongique pulmonaire et son écologie, la comparer avec celle de la communauté bactérienne, permettra de mieux analyser les synergies potentielles entre microorganismes. De nombreuses interactions intra-, inter-espèces, et même inter-règnes (micromycètes-bactéries) ont été démontrées directement et indirectement [2, 14]. Dans ce contexte, les approches dites de « omique », d’abord essentiellement descriptives, vont être une aide précieuse pour identifier toute interaction potentiellement clé dans le maintien du microbiome pulmonaire du sujet sain ou, à l’inverse, associée à une dysbiose et une pathologie respiratoire [16]. Ces approches doivent donc désormais participer à la compréhension des différents phénomènes physiopathologiques impliqués dans les pathologies respiratoires chroniques. En intégrant la dimension écologique, elles devraient nous permettre d’appréhender différemment une altération de la fonction pulmonaire, ainsi que l’impact du traitement anti-infectieux sur l’écosystème polymicrobien respiratoire. En conclusion, de notre biodiversité microbienne naît notre spécificité et singularité ; l’ensemble des microorganismes, incluant bactéries, virus et micromycètes, joue un rôle dans le maintien d’un système respiratoire optimal. À l’inverse, un déséquilibre, ou dysbiose, de cette flore polymicrobienne signe une évolution pathologique. De ce nouveau paradigme, combinant l’étude des microorganismes qui nous colonisent aux concepts écologiques, est né un enthousiasme scientifique légitime, qui a déjà commencé à révolutionner notre conception de nombreuses pathologies humaines, mais qui doit maintenant prendre en compte les microorganismes non bactériens, en particulier fongiques, et intégrer l’appareil pulmonaire comme un nouveau site d’étude du microbiome. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Underhill DM, Iliev ID The mycobiota: interactions between commensal fungi and the host immune system . Nat Rev Immunol. 2014; ; 14 : :405.–416. 2.
Marsland BJ, Gollwitzer ES Host-microorganism interactions in lung diseases . Nat Rev Immunol. 2014; ; 14 : :827.–835. 3.
Charlson ES, Bittinger K, Chen J, et al. Assessing bacterial populations in the lung by replicate analysis of samples from the upper and lower respiratory tracts . PLoS One. 2012; ; 7 : :e42786.. 4.
Charlson ES, Diamond JM, Bittinger K, et al. Lung-enriched organisms and aberrant bacterial and fungal respiratory microbiota after lung transplant . Am J Respir Crit Care Med. 2012; ; 186 : :536.–545. 5.
Delhaes L, Monchy S, Fréalle E, et al. The airway microbiota in cystic fibrosis: a complex fungal and bacterial community . Implications for therapeutic management. PLoS One. 2012; ; 7 : :e36313.. 6.
Van Woerden HC, Gregory C, Brown R, et al. Differences in fungi present in induced sputum samples from asthma patients and non-atopic controls: a community based case control study . BMC Infect Dis. 2013; ; 13 : :69.. 7.
Willger SD, Grim SL, Dolben EL, et al. Characterization and quantification of the fungal microbiome in serial samples from individuals with cystic fibrosis . Microbiome. 2014; ; 2 : :40.. 8.
Denning DW, Pashley C, Hartl D, et al. Fungal allergy in asthma: state of the art and research needs . Clin Transl Allergy. 2014; ; 4 : :14.. 9.
Paugam A, Baixench MT, Demazes-Dufeu N, et al. Characteristics and consequences of airway colonization by filamentous fungi in 201 adult patients with cystic fibrosis in France . Med Mycol. 2010; ; 48 : ((suppl 1)) :S32.–S36. 10.
Burgel PR, Baixench MT, Amsellem M, et al. High prevalence of azole-resistant Aspergillus fumigatus in adults with cystic fibrosis exposed to itraconazole . Antimicrob Agents Chemother. 2012; ; 56 : :869.–874. 11.
Rabin AS, Givertz MM, Couper GS, et al. Risk factors for invasive fungal disease in heart transplant recipients . J Heart Lung Transplant. 2015; ; 34 : :227.–232. 12.
Bitar D, Lortholary O, Le Strat Y, et al. Population-based analysis of invasive fungal infections, France, 2001–2010 . Emerg Infect Dis. 2014; ; 20 : :1149.–1155. 13.
Kosmidis C, Denning DW The clinical spectrum of pulmonary aspergillosis . Thorax. 2015; ; 70 : :270.–277. 14.
Peleg AY, Hogan DA, Mylonakis E Medically important bacterial: fungal interactions . Nat Rev Microbiol. 2010; ; 8 : :340.–349. 15.
Huffnagle GB, Noverr MC The emerging world of the fungal microbiome . Trends Microbiol. 2013; ; 21 : :334.–341. 16.
Audebert C, Hot D, Lemoine Y, Caboche S Le séquençage haut-débit : vers un diagnostic basé sur la séquence complète de l’agent infectieux . Med Sci (Paris). 2014; ; 30 : :1144.–1151. 17.
Brégeon F, Rolain JM
Le résistome pulmonaire. Med Sci (Paris). 2015; ; 31 : :947.–950. 18.
Andréjak C, Delhaes L Le microbiome pulmonaire en 2015 . Med Sci (Paris). 2015; ; 31 : :971.–978. |