Les lymphocytes T régulateurs (Treg) sont des lymphocytes T CD4+ immunosuppresseurs, indispensables au maintien de la tolérance immunitaire [1]. Les Treg exercent néanmoins un rôle délétère dans le cancer et les maladies infectieuses, en inhibant des réponses immunitaires bénéfiques. Réduire transitoirement le nombre ou la fonction des Treg représente une approche prometteuse d’immunothérapie, qui n’a pourtant connu que peu de succès jusqu’ici, et ce, pour deux raisons principales [11].
La première découle de l’absence de marqueur protéique permettant d’étudier et de cibler ces cellules sans ambiguïté chez l’homme. Si le facteur de transcription FOXP3 (forkhead box P3) est exprimé exclusivement par les Treg chez la souris, chez l’homme, il est aussi exprimé dans de nombreux lymphocytes non régulateurs activés. D’autre part, les protéines abondamment présentes à la surface des Treg, parfois utilisées comme marqueurs de ces cellules, sont également présentes sur les lymphocytes T non régulateurs activés. C’est le cas des protéines CD251, CTLA (cytotoxic T-lymphocyte-associated protein)-4, GITR (glucocorticoid-induced TNFR family related gene) et OX40 (CD134, tumor necrosis factor receptor superfamily member 4 [TNFRSF4]), par exemple. Des anticorps monoclonaux (Acm) qui reconnaissent ces protéines ne ciblent donc pas seulement les Treg, mais également les lymphocytes T activés, ce qui complique l’interprétation de leurs effets sur la modulation des réponses immunes.
La seconde provient de l’existence, chez la souris en tout cas, de divers mécanismes d’immunosuppression par les Treg, comme la production de cytokines immunosuppressives, la diminution de la capacité des cellules présentatrices d’antigènes à stimuler les lymphocytes T, le transfert d’AMP cyclique à travers les jonctions communicantes2, ou encore la production d’adénosine. L’importance d’un mécanisme particulier semble dépendre du contexte et du type de réponse immunitaire à supprimer. Lequel de ces mécanismes, ou d’autres encore non identifiés, joue un rôle prépondérant chez l’homme n’est pas connu.
Pour étudier les mécanismes d’immunosuppression par les Treg humains, nous avons dérivé des clones de Treg, afin de contourner la difficulté inhérente à l’isolement répété de ces cellules sanguines rares, difficilement identifiables, et présentant une fonction suppressive peu reproductible in vitro. Un clone est défini comme Treg s’il possède une marque épigénétique stable, qui ne s’établit que dans les Treg complètement différenciés chez l’homme et chez la souris. Cette marque correspond à la déméthylation d’une région régulatrice du gène FOXP3 [1, 2]. Nos clones Treg expriment FOXP3, sont suppresseurs in vitro, et se sont révélés une source de cellules remarquablement stables et pures pour étudier la fonction immunosuppressive des Treg humains. L’analyse de leur profil transcriptionnel a montré qu’en réponse à une stimulation du récepteur T, les Treg humains, mais pas les autres types de lymphocytes T, produisent la forme active du TGF-β1 (transforming growth factor-β1) [2]. Les souris Tgfb1-/- souffrent d’un syndrome auto-immunitaire létal. Il semblait donc raisonnable de postuler que la production de cette cytokine par les Treg contribue à leur fonction suppressive. Cependant, la suppression par les Treg requiert des contacts cellulaires, ce qui suggère plutôt un mécanisme impliquant des protéines membranaires. Mais nous avons ensuite observé que l’induction d’un signal dépendant du TGF-β1 dans des lymphocytes T en présence de Treg requérait également des contacts cellulaires, indiquant que le TGF-β1 actif est produit à proximité de la surface des Treg [2]. Ces observations nous ont conduits à examiner en détails les mécanismes d’activation du TGF-β1 par les Treg humains. En effet, la plupart des cellules produisent des formes inactives du TGF-β1 mais seul un petit nombre sont capables d’activer la cytokine, via des mécanismes très contrôlés qui varient d’un type cellulaire à l’autre [3].
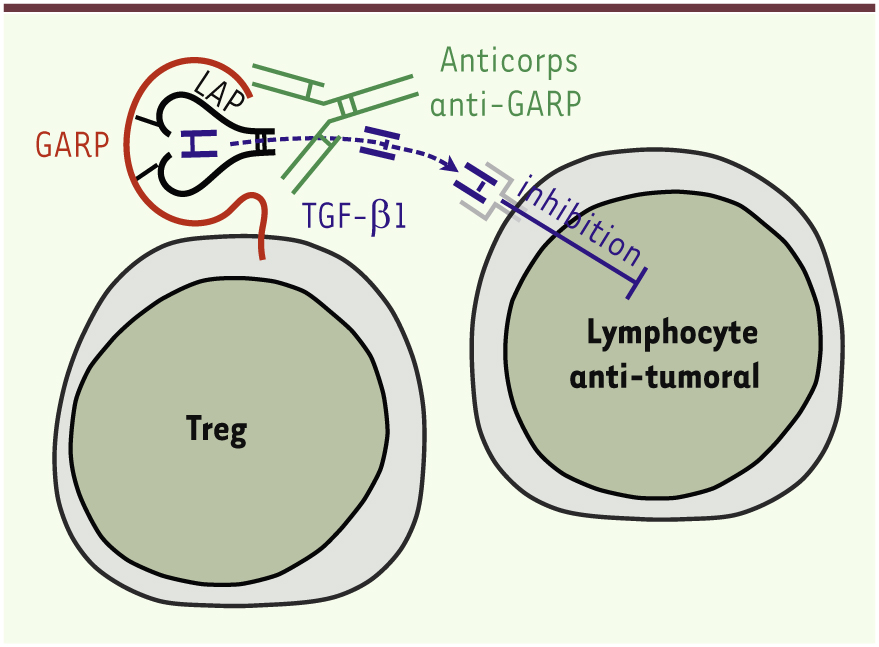
Toutes les cellules immunitaires produisent le précurseur du TGF-β1, le proTGF-β1 qui est clivé pour générer le TGF-β1 latent dont le fragment carboxy-terminal, correspondant au TGF-β1 mature, reste lié de manière non covalente au fragment amino-terminal appelé LAP (latency associated peptide). Le TGF-β1 latent est inactif parce que le LAP empêche la liaison du TGF-β1 mature à son récepteur (Figure 1). Une étape supplémentaire est en effet nécessaire pour libérer le TGF-β1 mature du LAP. Avec d’autres équipes, nous avons montré que les Treg stimulés, mais pas les autres types de lymphocytes T, présentent le TGF-β1 latent à leur surface grâce à sa liaison à une protéine transmembranaire appelée GARP (glycoprotein A repetitions predominant) [4, 5]. Nous avons postulé, et ensuite démontré, que GARP contribuait à la production de TGF-β1 actif par les Treg. Nous avons obtenu 31 nouveaux anticorps anti-GARP, dont 2 se sont avérés capables d’inhiber la production de TGF-β1 actif par les Treg humains. Ces deux anticorps reconnaissent un épitope conformationnel qui requiert les acides aminés situés en position 137-139 au sein des complexes GARP/TGF-β1 (GARP137-139). Les autres anticorps, qui ne bloquent pas l’activation du TGF-β1, reconnaissent d’autres épitopes. Nous avons mesuré l’activité de ces anticorps anti-GARP bloquants chez des souris immunodéficientes, greffées avec des PBMC (cellules mononucléées isolées du sang périphérique humain). Ces souris développent une maladie du greffon contre l’hôte (en anglais, graft-versus-host disease, GVHD) provoquée par l’activité des lymphocytes T humains greffés contre les tissus de la souris receveuse. Le co-transfert de Treg autologues3 humains permet d’atténuer la GVHD, et, inversement, les anticorps anti-GARP bloquants abolissent cette protection. Les anticorps n’agissent pas en éliminant les Treg : le nombre de Treg humains n’est en effet pas diminué dans les souris traitées avec les anticorps anti-GARP bloquants. De plus, un anticorps présentant une mutation qui abolit sa capacité de se lier aux récepteurs Fc, conserve une activité totale. Nos résultats indiquent donc : (i) que la production de TGF-β1 actif via GARP contribue à la fonction suppressive des Treg humains in vivo et (ii) que des anticorps anti-GARP peuvent inhiber cette immunosuppression in vivo, sans éliminer les Treg [6].
| Figure 1.
Mode d’action des anticorps anti-GARP. Le TGF-β1 actif libéré des complexes GARP/TGF-β1 à la surface des Treg inhibe les lymphocytes T à proximité. Des anticorps anti-GARP peuvent bloquer la production de TGF-β1 actif par les Treg, et donc réduire l’activité immunosuppressive de ces derniers in vivo. |
La notion que le TGF-β1 contribue, ne serait-ce que partiellement, à l’immunosuppression exercée par les Treg, est loin d’être acceptée, notamment parce que les Treg de souris Tgfb1-/- ne montrent pas d’anomalie de leur fonction suppressive in vitro [7]. Plusieurs études suggèrent néanmoins que le TGF-β1 produit par les Treg supprime l’autoimmunité in vivo [8, 9]. Il est possible d’autre part que les Treg humains puissent supprimer les réponses immunes via des mécanismes qui seraient distincts de ceux utilisés par les Treg murins.
Quels avantages les anticorps anti-GARP pourraient-ils apporter à l’immunothérapie du cancer ?
D’une part, il convient de noter qu’aucun des anticorps immunostimulants actuellement disponibles en clinique, n’agit en inhibant la fonction immunosuppressive des Treg. Les anticorps anti-CTLA-4 pourraient intervenir en partie en éliminant les Treg dans les tumeurs. Ce mode d’action a été démontré chez la souris [10], et pourrait aussi jouer un rôle chez les patients chez lesquels les anticorps anti-CTLA-4 provoquent des effets secondaires sévères de nature auto-immunitaire. Il est donc tentant de spéculer que l’administration d’anticorps anti-GARP, qui inhibent transitoirement la fonction des Treg sans les éliminer physiquement, serait moins toxique que l’administration d’anticorps anti-CTLA-4.
D’autre part, les anticorps anti-GARP ne devraient pas affecter la production de TGF-β1 actif par les cellules autres que des Treg. Ceci pourrait être avantageux par rapport à une inhibition globale qui serait obtenue avec des anticorps anti-TGF-β1, ou des inhibiteurs de l’activité kinase des récepteurs du TGF-β. Une telle inhibition de l’activité du TGF-β1, qui est produit par tous les types cellulaires, pose le problème du risque d’effets secondaires sévères, comme la stimulation de la croissance de lésions pré-néoplasiques, puisque le TGF-β1 exerce de puissants effets cytostatiques sur les cellules précancéreuses. Les anticorps anti-GARP devraient permettre une inhibition sélective de l’activité du TGF-β1 dans les cellules immunitaires supprimées par les Treg.