| |
| Med Sci (Paris). 2015 October; 31(10): 826–828. Published online 2015 October 19. doi: 10.1051/medsci/20153110004.Le Viagra® fait durcir Plasmodium : une nouvelle voie pour bloquer la transmission du paludisme ? Catherine Lavazec1,2,3,4,5* and Bernina Naissant1,2,3,4 1Inserm, U1016, Institut Cochin, 22, rue Méchain, Paris, France 2Cnrs, UMR8104, Paris, France 3Université Paris Descartes, Sorbonne Paris Cité, Paris, France 4Laboratoire d’excellence GR-Ex, Paris, France 5Institut Pasteur, Paris, France MeSH keywords: Adulte, Animaux, Anopheles, Membrane cellulaire, Enfant, Femelle, Humains, Étapes du cycle de vie, Paludisme à Plasmodium falciparum, Mâle, Fluidité membranaire, Plasmodium falciparum, Grossesse, Citrate de sildénafil, parasitologie, effets des médicaments et substances chimiques, prévention et contrôle, transmission, physiologie, pharmacologie |
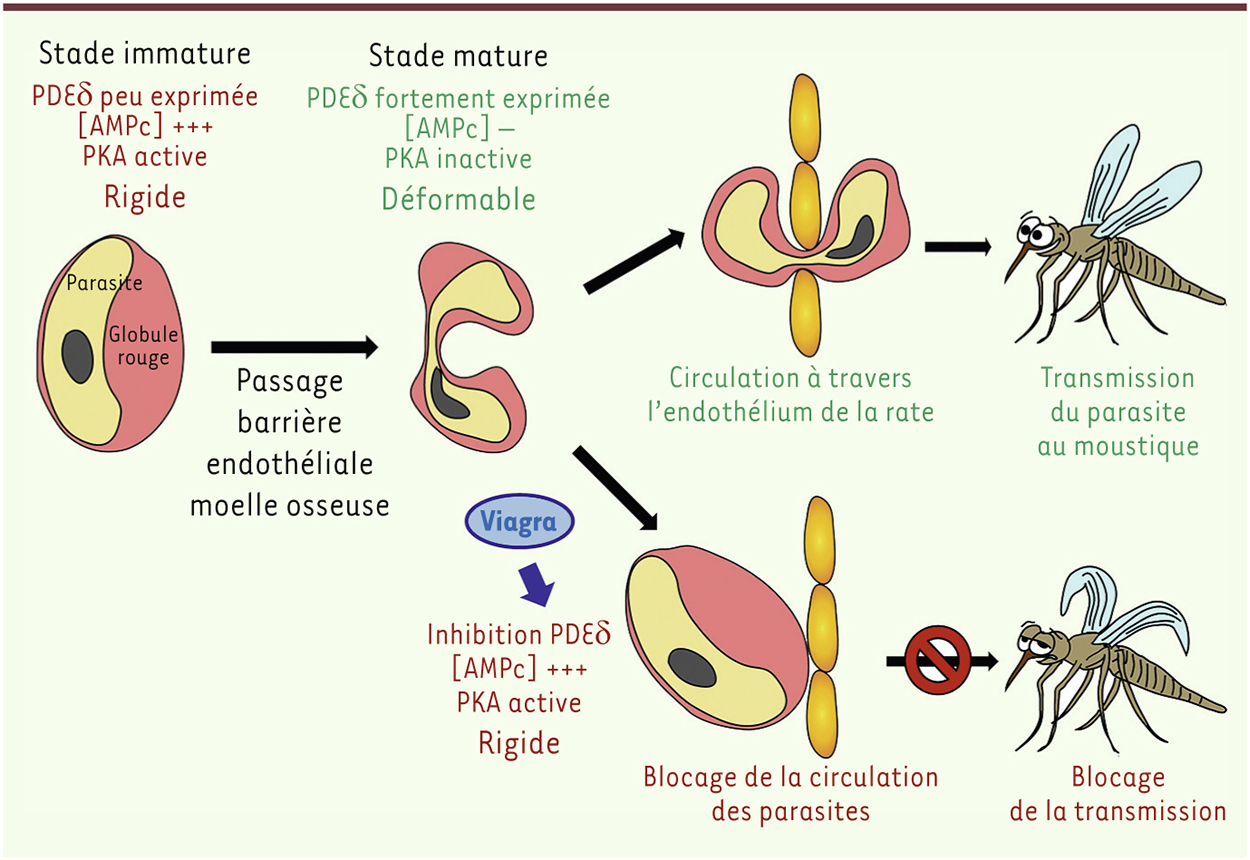
Développement et transmission de Plasmodium falciparumLe paludisme est une parasitose causée par le parasite Plasmodium, qui touche chaque année plus de 200 millions de personnes dans le monde. Parmi les parasites qui infectent l’homme, Plasmodium falciparum est responsable de plus 600 000 décès notamment chez les enfants et les femmes enceintes. Le cycle de développement de P. falciparum est complexe et nécessite deux hôtes : un moustique femelle Anopheles et l’homme. Lors d’une piqûre, le moustique inocule des parasites qui envahissent les cellules hépatiques puis les érythrocytes. Les parasites peuvent alors suivre deux voies de développement distinctes dans l’érythrocyte : soit ils réalisent une multiplication asexuée cyclique, soit ils se différencient en parasites sexués appelés gamétocytes. Les traitements contre le paludisme ciblent les formes asexuées du parasite qui sont responsables des symptômes chez l’homme. Les formes sexuées, transmises de l’homme au moustique lors d’une piqûre, ne sont traditionnellement pas considérées comme des cibles thérapeutiques pertinentes. Toutefois, l’éradication de cette maladie nécessite le développement de nouveaux types de traitements destinés à bloquer la transmission de l’homme vers le moustique. La maturation des gamétocytes nécessite 10 jours et est divisée en 5 stades morphologiques. Durant cette période, les érythrocytes infectés par les gamétocytes (EIG) immatures (stades I – IV), indétectables dans la circulation sanguine, sont séquestrés dans la moelle osseuse par des mécanismes encore inconnus [1, 2]. à la fin de la maturation, les gamétocytes matures (stade V) sont libérés dans la circulation sanguine où ils persistent plusieurs jours [3]. Les EIG matures sont ainsi accessibles aux moustiques assurant la transmission du parasite. La capacité de traverser aisément l’endothélium de la rate et d’éviter la filtration splénique dépend des propriétés mécaniques des EIG matures acquises lors du passage du stade IV au stade V. Les EIG matures sont en effet extrêmement déformables, contrairement aux EIG immatures, dont la rigidité pourrait leur permettre de rester séquestrés dans la moelle osseuse par rétention mécanique [4]. Le changement de déformabilité des EIG est, par conséquent, un phénomène clé pour leur transmission. Modifier la filtrabilité des EIG matures pourrait être un nouveau moyen d’empêcher leur circulation à travers la rate et, par conséquent, de bloquer la transmission du parasite. |
Rigidité des gamétocytes immatures et rôle de la voie de signalisation de l’AMP cyclique Le passage du stade IV (rigide) au stade V (déformable) est lié en partie à la dépolymérisation du réseau de microtubules dans le parasite [5] ainsi qu’à la dissociation des protéines parasitaires STEVOR (subtelomeric variable open reading frame), à la membrane du globule rouge infecté [4]. Nous avons tout d’abord cherché à étudier la voie de signalisation et les processus moléculaires impliqués dans le changement de déformabilité. Dans les globules rouges non infectés, la protéine kinase dépendante de l’AMP cyclique (PKA) contribue à la régulation des propriétés mécaniques de leurs membranes [6]. Durant le développement asexué du parasite, la PKA du parasite est impliquée dans différents processus, mais le rôle de cette kinase au cours du développement des gamétocytes reste incertain. Afin de déterminer si l’activité de la protéine PKA contribue à la rigidité des EIG immatures, nous avons utilisé une méthode de filtration à travers un réseau de microsphères en métal mimant la géométrie des fentes inter-endothéliales de la rate [7]. En mesurant leur taux de rétention, ce modèle in vitro de filtration splénique permet de déterminer la filtrabilité des EIG. Ainsi, nous avons constaté qu’un traitement des EIG immatures rigides avec des inhibiteurs de la PKA induit une diminution de leur taux de rétention, et donc une augmentation de leur déformabilité [8]. Il apparaît également que les protéines membranaires des EIG immatures sont plus phosphorylées que celles des EIG matures. Sachant que l’activité de la PKA dépend de la concentration de l’adénosine monophosphate cyclique (AMPc) cellulaire, nous avons réalisé un dosage de l’AMPc dans les EIG. Une chute de la concentration de l’AMPc dans les EIG matures, qui pourrait empêcher la PKA de phosphoryler ses substrats, a pu être mise en évidence. Ainsi, l’incubation des EIG matures avec un analogue de l’AMPc se substituant à ce dernier dans la cellule, entraîne une augmentation du taux de rétention des EIG matures. Ce résultat montre donc que la chute de la concentration d’AMPc contribue à la déformabilité des EIG matures (Figure 1).
 | Figure 1.
Régulation de la déformabilité des érythrocytes infectés par les gamétocytes. La déformabilité des érythrocytes parasités, facilitée quand la PDE δ est fortement exprimée et la voie de l’AMP cyclique est inhibée, leur permet de circuler librement à travers la rate et de rester accessibles aux moustiques dans la circulation sanguine (en haut). L’action du Viagra augmente la rigidité des érythrocytes parasités en inhibant la PDE δ, empêchant leur passage à travers l’endothélium de la rate et éliminant les parasites de la circulation sanguine (en bas). |
|
Altération de la déformabilité des gamétocytes matures par des inhibiteurs de phosphodiestérases Les enzymes responsables de la dégradation de l’AMPc dans la cellule sont appelées phosphodiestérases (PDE). Nous avons analysé le rôle que ces enzymes pourraient jouer dans la régulation de la déformabilité des EIG. Parmi les quatre PDE exprimées par P. falciparum, seule la PDE delta (PDE δ) est présente dans les EIG matures. L’inactivation du gène PDE δ de P. falciparum provoque une augmentation de la concentration d’AMPc et une réduction de déformabilité dans les EIG matures transgéniques. La PDE δ de P. falciparum semble donc être impliquée dans le déclenchement du changement de déformabilité observé au stade V. Afin de confirmer ce résultat, nous avons testé divers inhibiteurs de PDE dans le but de modifier la concentration d’AMPc cellulaire. Le zaprinast, un inhibiteur de la PDE-5 spécifique de la guanosine monophosphate cyclique (GMPc) chez les mammifères, est également connu pour augmenter la concentration d’AMPc cellulaire dans les érythrocytes humains [9] et pour inhiber l’activité phosphodiestérase chez P. falciparum [10]. Le traitement des EIG matures avec cet inhibiteur augmente la concentration d’AMPc et induit une augmentation de leur rétention sur les microbilles. Ceci démontre que modifier la concentration d’AMPc en utilisant des agents pharmacologiques peut altérer la déformabilité et la filtrabilité des EIG matures. Nous avons également testé l’effet du sildénafil citrate, autre inhibiteur de PDE plus communément utilisé en pharmacologie et connu sous son nom commercial de Viagra. Lorsque les stades V sont incubés avec cet inhibiteur, la concentration d’AMPc cellulaire augmente et les EIG deviennent plus rigides, et ce proportionnellement à la concentration de sildénafil utilisée pour l‘incubation. On constate ainsi qu’à la dose habituellement administrée pour le dysfonctionnement érectile, cette molécule présente également le potentiel d’augmenter la rigidité des formes sexuées du parasite, et par conséquent de diminuer la filtrabilité des cellules infectées (Figure 1). |
La régulation du mécanisme de changement de déformabilité des EIG, qui leur permet de persister dans la circulation sanguine, dépend de la concentration en AMPc dans la cellule. Elle peut donc être altérée par des traitements pharmacologiques. L’utilisation d’inhibiteurs de PDE tels que le sildénafil citrate modifie la filtrabilité des EIG matures et pourrait ainsi empêcher leur persistance dans la circulation sanguine et leur transmission au moustique. Au-delà de la coïncidence amusante qu’est la découverte de la capacité du Viagra à rendre rigides les formes sexuées de Plasmodium, nos résultats apportent la preuve de concept in vitro de la faisabilité d’une nouvelle approche pour bloquer la propagation du paludisme dans la population. La prochaine étape consistera à démontrer in vivo l’efficacité des inhibiteurs de PDE pour éliminer les EIG de la circulation sanguine. Après modification préalable du principe actif du sildénafil citrate pour limiter son effet érectile, ou en testant des molécules similaires dépourvues de cet effet secondaire, l’utilisation d’inhibiteurs de PDE adaptés pourrait déboucher sur un traitement efficace contre la transmission du parasite. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Aguilar R, Magallon-Tejada A, Achtman AH, et al. Molecular evidence for the localization of Plasmodium falciparum immature gametocytes in bone marrow . Blood. 2014; ; 123 : :959.–966. 2.
Joice R, Nilsson SK, Montgomery J, et al. . Plasmodium falciparum transmission stages accumulate in the human bone marrow . Sci Transl Med. 2014; 6: :244re245.. 3.
Bousema T, Drakeley C. Epidemiology and infectivity of Plasmodium falciparum and Plasmodium vivax gametocytes in relation to malaria control and elimination . Clin Microbiol Rev. 2011; ; 24 : :377.–410. 4.
Tiburcio M, Niang M, Deplaine G, et al. A switch in infected erythrocyte deformability at the maturation and blood circulation of Plasmodium falciparum transmission stages . Blood. 2012; ; 119 : :e172.–e180. 5.
Sinden RE. Gametocytogenesis of Plasmodium falciparum in vitro: an electron microscopic study . Parasitology. 1982; ; 84 : :1.–11. 6.
Mohandas N, Gallagher PG. Red cell membrane: past, present, and future . Blood. 2008; ; 112 : :3939.–3948. 7.
Lavazec C, Deplaine G, Safeukui I, et al. Microsphiltration: a microsphere matrix to explore erythrocyte deformability . Methods Mol Biol. 2013; ; 923 : :291.–297. 8.
Ramdani G, Naissant B, Thompson E, et al. cAMP-signalling regulates gametocyte-infected erythrocyte deformability required for malaria parasite transmission . PLoS Pathog. 2015; ; 11 : :e1004815.. 9.
Knebel SM, Elrick MM, Bowles EA, et al. Synergistic effects of prostacyclin analogs and phosphodiesterase inhibitors on cyclic adenosine 3’,5’ monophosphate accumulation and adenosine 3’5’ triphosphate release from human erythrocytes . Exp Biol Med. 2013; ; 238 : :1069.–1074. 10.
Wentzinger L, Bopp S, Tenor H, et al. Cyclic nucleotide-specific phosphodiesterases of Plasmodium falciparum: PfPDEalpha, a non-essential cGMP-specific PDE that is an integral membrane protein . Int J Parasitol. 2008; ; 38 : :1625.–1637. |