| |
| Med Sci (Paris). 2015 August; 31(8-9): 717–719. Published online 2015 September 4. doi: 10.1051/medsci/20153108005.Les lymphocytes MAIT dans le diabète de type 2 et l’obésité Isabelle Magalhaes1,2,3* and Agnès Lehuen1,2,3,4** 1Inserm U1016, Institut Cochin, 22, rue Méchain, 75014Paris, France 2CNRS, UMR8104, Paris, France 3Laboratoire d’excellence INFLAMEX, Université Paris Descartes, Sorbonne Paris Cité, France 4Assistance Publique-Hôpitaux de Paris, département de diabétologie, hôpital Cochin, 27, rue du faubourg Saint-Jacques, 75014Paris, France MeSH keywords: Diabète de type 2, Microbiome gastro-intestinal, Humains, Obésité, Lymphocytes T, immunologie, physiologie |
Le diabète de type 2 (DT2) représente la forme la plus fréquente de diabète (90 à 95 % des cas de diabète) et est, dans la grande majorité des cas, associé à un excès de poids ou à l’obésité. Le DT2 se caractérise par une hyperglycémie chronique liée à une production insuffisante d’insuline par les cellules β pancréatiques, ainsi qu’à une résistance à l’insuline des tissus insulino-sensibles (foie, muscles et tissus adipeux). L’interaction entre gènes et facteurs environnementaux joue un rôle déterminant dans le développement du DT2, mais les changements de mode de vie (plus sédentaires) et d’alimentation sont considérés comme des facteurs déterminants dans l’augmentation actuelle de la prévalence du DT2. De nombreuses études ont montré l’implication du système immunitaire et de l’inflammation chronique dans la progression et la sévérité des troubles métaboliques observés chez les patients obèses et DT2 [1, 2]. En effet, les médiateurs de l’inflammation sont augmentés dans le sang et le tissu adipeux des patients obèses. De nombreuses cellules immunitaires sont normalement présentes dans le tissu adipeux, mais des études conduites avec des modèles murins ont démontré que l’obésité modifie l’équilibre cellulaire au niveau de ce tissu. L’obésité conduit à l’accumulation de macrophages pro-inflammatoires dans le tissu adipeux où ces cellules jouent un rôle clé dans le déclenchement de l’inflammation chronique [3, 4]. L’environnement pro-inflammatoire dans le tissu adipeux obèse entraîne alors l’activation de cellules immunitaires, mais également l’inhibition des effets de l’insuline sur les adipocytes, résultant en une résistance à l’insuline1. |
Lymphocytes iNKT et lymphocytes MAIT Les lymphocytes T non conventionnels iNKT (invariant natural killer T cells) sont présents en grand nombre dans le tissu adipeux, que ce soit chez l’homme ou la souris. Cependant, chez les patients obèses, la fréquence des lymphocytes iNKT dans le tissu adipeux omental diminue significativement [5]. Des expériences effectuées avec des modèles murins suggèrent que les lymphocytes iNKT ont une fonction régulatrice anti-inflammatoire dans le tissu adipeux [11]. La diminution des lymphocytes iNKT au cours de l’obésité contribuerait à la perte de l’homéostasie dans le tissu adipeux. Les lymphocytes MAIT (mucosal associated T cells), décrits pour la première fois en 1999 par l’équipe d’Olivier Lantz, représentent une autre population de lymphocytes T non conventionnels [6]. Chez l’homme, la fréquence de ces cellules varie de 1 à 10 % des lymphocytes T du sang circulant. Les lymphocytes MAIT expriment un récepteur T (TCR) semi-invariant - la chaîne TCR Vα7.2-Jα33 invariante s’associant à un nombre restreint de chaînes TCRβ -, qui reconnaît spécifiquement des intermédiaires du métabolisme de la vitamine B2. Ces molécules sont produites par certaines bactéries et levures et sont présentées aux MAIT par MR1, molécule non polymorphe apparentée aux classes 1 du complexe majeur d’histocompatibilité. Les lymphocytes MAIT ont des capacités cytotoxiques et peuvent sécréter, une fois activés, des cytokines inflammatoires telles que l’IFN-γ (interféron), le TNF-α (tumor necrosis factor), et l’IL-17 (interleukine 17). Comme les lymphocytes T conventionnels, les lymphocytes MAIT se développent dans le thymus, mais dépendent, pour leur différenciation et leur expansion périphérique, des lymphocytes B et du microbiote intestinal [7]. Des études récentes ont montré que le microbiote intestinal est modifié chez les patients diabétiques et obèses [8]. Nous avons donc émis l’hypothèse selon laquelle ces changements du microbiote intestinal pouvaient avoir un impact sur les lymphocytes MAIT. Dans l’étude que nous avons récemment publiée dans le Journal of Clinical Investigation, notre équipe, en collaboration avec celle de Karine Clément (Institut de cardiométabolisme et nutrition, Paris) s’est donc intéressée aux lymphocytes MAIT chez des patients atteints de DT2 et des patients sévèrement obèses, dont l’indice de masse corporelle est supérieur à 35 [9]. |
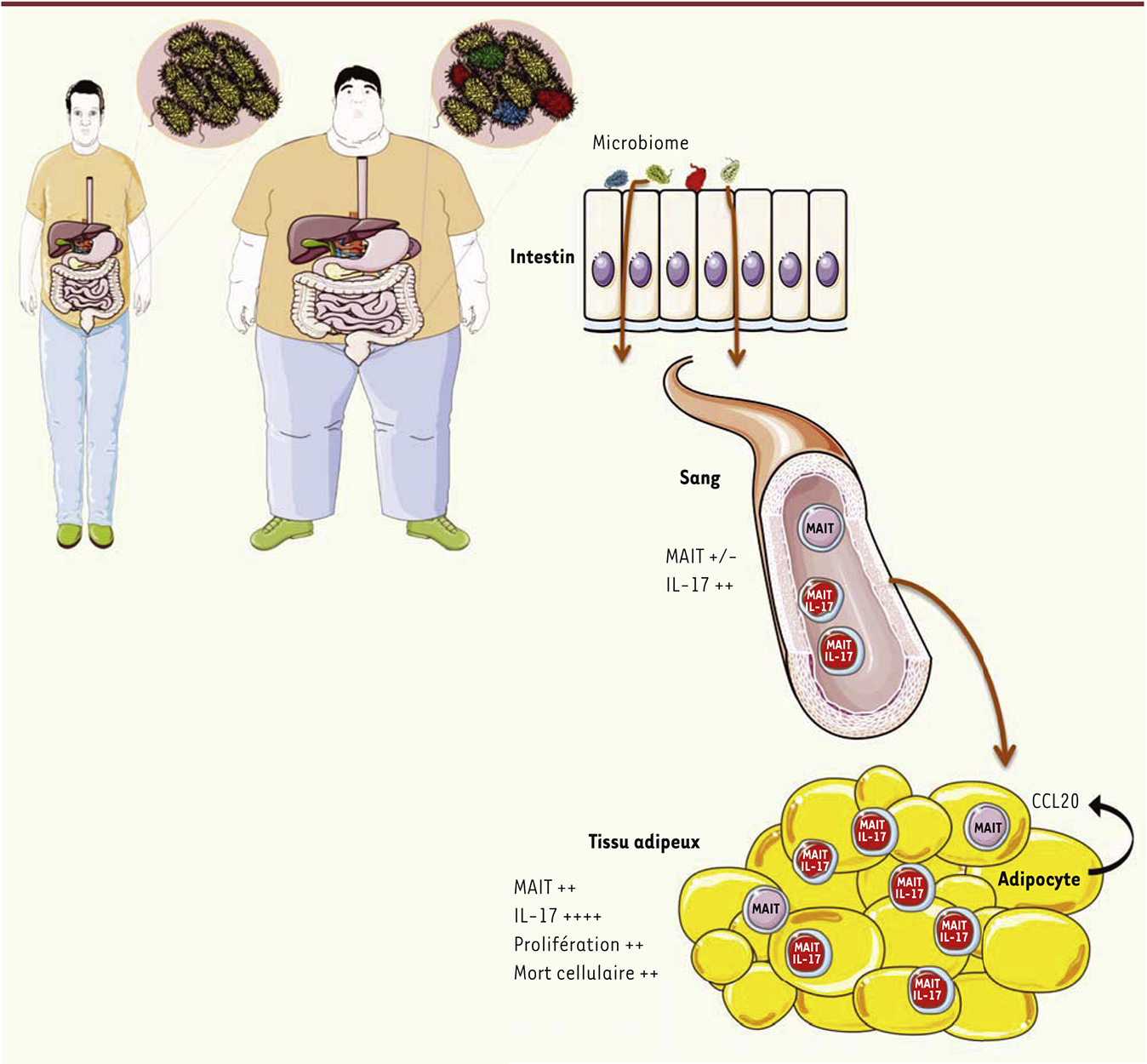
Diminution des lymphocytes MAIT chez les patients obèses et atteints de DT2 Nous avons tout d’abord analysé par cytométrie de flux la fréquence des lymphocytes MAIT dans le sang circulant des patients. Comparée à celle des sujets contrôles, la fréquence des lymphocytes MAIT est fortement diminuée chez les patients DT2 et obèses, et ce particulièrement chez les patients sévèrement obèses. En effet, la fréquence des lymphocytes MAIT est négativement associée à l‘indice de masse corporelle, et, chez 17 % des patients sévèrement obèses analysés, nous n’avons pas détecté de lymphocytes MAIT circulants. Une fréquence diminuée de lymphocytes MAIT circulants a été décrite dans différentes cohortes de patients (atteints de tuberculose, ou infectées par le VIH par exemple), mais notre étude est la première à décrire la disparition des lymphocytes MAIT circulants chez des patients. Par ailleurs, chez les patients obèses et diabétiques, la fréquence des lymphocytes iNKT circulants était diminuée comme cela a été décrit précédemment, alors que celle des autres populations lymphocytaires analysées (les cellules T γδ, les T régulatrices, et les T CD4+ et CD8+ conventionnelles) ne diffère pas des fréquences observées chez les sujets contrôles. Concomitante à leur diminution de fréquence chez les patients étudiés, la fréquence de lymphocytes MAIT produisant (en réponse à une stimulation non spécifique) des cytokines pro-inflammatoires telles que l’IL-2, le granzyme B et l’IL-17 était augmentée. La stimulation in vitro des lymphocytes MAIT via leur TCR par un ligand spécifique [10] a confirmé que chez les patients DT2, ceux-ci présentaient un défaut d’activation et de production d’IFN-γ et de TNF-α, mais une capacité accrue de production d’IL-17. La forte diminution des lymphocytes MAIT circulants suggère que ces cellules meurent in situ et/ou migrent vers d’autres tissus. Nous avons donc analysé le tissu adipeux viscéral. Contrairement à ce qui a été observé dans le sang, dans le tissu adipeux, la fréquence des lymphocytes MAIT ne diffère pas entre patients et sujets contrôles. Nous avons en effet pu détecter, chez des patients obèses ayant peu ou pas de lymphocytes MAIT circulants, une fréquence de lymphocytes MAIT plus élevée dans le tissu adipeux que dans le sang. Par ailleurs, la comparaison de l’expression de certains marqueurs - marqueur d’activation CD25, de prolifération Ki67 et anti-apoptotique Bcl-2 - par des lymphocytes MAIT isolés à partir soit du sang ou du tissu adipeux, montre que chez les patients obèses, les lymphocytes MAIT sont préférentiellement activés dans le tissu adipeux, où ils sont également plus susceptibles à l’apoptose. De plus, dans le tissu adipeux de patients obèses, la fréquence de lymphocytes MAIT produisant de l’IL-17 est plus élevée que dans le tissu adipeux de sujets contrôles ; la sécrétion d’IL-17 y est supérieure à celle des lymphocytes MAIT du sang, comme chez les sujets contrôles, mais l’ordre de grandeur est bien plus important (Figure 1).
 | Figure 1.
Anomalies des lymphocytes MAIT chez les patients obèses et DT2. Nous émettons l’hypothèse selon laquelle les changements de la flore microbienne intestinale chez les patients obèses et DT2 contribuent à l’activation des lymphocytes MAIT. La fréquence des lymphocytes MAIT est diminuée dans le sang des patients obèses et DT2 par rapport à des sujets contrôles, tandis que dans le tissu adipeux obèse, la fréquence des lymphocytes MAIT produisant de l’IL-17 est fortement augmentée. L’inflammation présente au niveau du tissu adipeux obèse, ainsi que la production de CCL20 par les adipocytes, pourraient participer au recrutement des lymphocytes MAIT. DT2 : diabétique de type 2. |
Nous avons finalement analysé longitudinalement les lymphocytes MAIT chez des patients sévèrement obèses, dont 25 % étaient également atteints de DT2, ayant subi une chirurgie bariatrique2. Comme attendu, une perte de poids ainsi qu’une amélioration des paramètres métaboliques (dont l’hémoglobine glyquée) ont été observées dès 3 mois après l’intervention. De façon notable, dès 3 mois après l’intervention, la fréquence des lymphocytes MAIT circulants est dix fois supérieure à celle mesurée en pré-opératoire (valeur médiane de 0,6 % contre 0,06 %). Cette augmentation s’accentue à 6 puis 12 mois après la chirurgie bariatrique. De surcroît, 12 mois après l’intervention, la production d’IL-2 et de granzyme B par les lymphocytes MAIT est comparable à celle des lymphocytes MAIT de sujets contrôles, alors que la production d’IL-17 demeure élevée. Les mécanismes responsables de la diminution/disparition des lymphocytes MAIT circulants ne sont pas encore élucidés. L’inflammation présente dans le tissu adipeux chez les obèses, associée à une production accrue par les adipocytes de la chimiokine CCL20, se liant au récepteur CCR6 exprimé fortement par les lymphocytes MAIT, pourrait induire leur recrutement dans ce tissu. Par ailleurs, l’impact des modifications du microbiote intestinal sur les lymphocytes MAIT est particulièrement intéressant, et des études complémentaires vont permettre d’établir s’il existe un lien entre la présence de certaines souches bactériennes et des anomalies des lymphocytes MAIT chez les patients obèses et diabétiques. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous remercions l’ANR-11-IDEX-0005-02 Laboratoire d’excellence INFLAMEX, ANR-2014 OBEMAIT, la Fondation pour la recherche médicale n° DEQ20140329520 pour leur soutien financier et Servier pour l’iconographie.
|
Footnotes |
1.
Lumeng CN, Saltiel AR. Inflammatory links between obesity and metabolic disease . J Clin Invest. 2011; ; 121 : :2111.–2117. 2.
Donath MY, Shoelson SE. Type 2 diabetes as an inflammatory disease . Nat Rev Immunol. 2011; ; 11 : :98.–107. 3.
Weisberg SP, McCann D, Desai M, et al. Obesity is associated with macrophage accumulation in adipose tissue . J Clin Invest. 2003; ; 112 : :1796.–1808. 4.
Xu H, Barnes GT, Yang Q, et al. Chronic inflammation in fat plays a crucial role in the development of obesity-related insulin resistance . J Clin Invest. 2003; ; 112 : :1821.–1830. 5.
Lynch L, O’Shea D, Winter DC, et al. Invariant NKT cells and CD1d+ cells amass in human omentum and are depleted in patients with cancer and obesity . Eur J Immunol. 2009; ; 39 : :1893.–1901. 6.
Tilloy F, Treiner E, Park SH, et al. An invariant T cell receptor alpha chain defines a novel TAP-independent major histocompatibility complex class Ib-restricted alpha/beta T cell subpopulation in mammals . J Exp Med. 1999; ; 189 : :1907.–1921. 7.
Le Bourhis L, Guerri L, Dusseaux M, et al. Mucosal-associated invariant T cells: unconventional development and function . Trends Immunol. 2011; ; 32 : :212.–218. 8.
Tilg H, Moschen AR. Microbiota and diabetes: an evolving relationship . Gut. 2014; ; 63 : :1513.–1521. 9.
Magalhaes I, Pingris K, Poitou C, et al. Mucosal-associated invariant T cell alterations in obese and type 2 diabetic patients . J Clin Invest. 2015; ; 125 : :1752.–1762. 10.
Soudais C, Samassa F, Sarkis M, et al. In vitro and in vivo analysis of the Gram-negative bacteria-derived riboflavin precursor derivatives activating mouse MAIT cells . J Immunol. 2015; ; 194 : :4641.–4649. 11.
Ghazarian L, Simoni Y, Pingris K, et al. Rôle régulateur des lymphocytes NKT dans la prévention du diabète de type 1 . Med Sci (Paris). 2013; ; 29 : :722.–728. |