| |
| Med Sci (Paris). 2015 June; 31(6-7): 691–695. Published online 2015 July 7. doi: 10.1051/medsci/20153106025.Chroniques génomiques - Thérapie génique germinale, le retour ? Bertrand Jordan1,2* 1UMR 7268 ADÉS, Aix-Marseille, Université/EFS/CNRS, Espace éthique méditerranéen, hospital d’adultes la Timone, 264, rue Saint-Pierre, 13385Marseille Cedex 05, France 2CoReBio PACA, case 901, parc scientifique de Luminy, 13288Marseille Cedex 09, France MeSH keywords: Éthique de la recherche, Thérapie génétique, Cellules germinales, Mutation germinale, Humains, Recherche sur les cellules souches, éthique, méthodes, tendances, cytologie, physiologie, génétique |

Après avoir suscité, dans les années 1990, une flambée de commentaires, de prises de position et avoir été formellement prohibée par la loi dans de nombreuses nations, la question de la thérapie génique germinale avait cessé d’être évoquée. La raison en était simple : indépendamment de toute considération éthique, il était clair qu’une telle manipulation était techniquement hors de portée. On avait bien, au fil des années, réussi à mettre au point une méthode de construction de souris génétiquement modifiées, mais celle-ci était si complexe, lente et inefficace, que le passage à l’humain semblait exclu. Pourtant, on reparle aujourd’hui de cette possibilité, souvent rebaptisée Germline genome editing (sans doute pour souligner sa précision) en évoquant son emploi pour éliminer des maladies génétiques ainsi que pour d’éventuelles améliorations (enhancement) de notre patrimoine génétique. S’agit-il d’un buzz médiatique sans grand fondement, ou assiste-t-on au contraire à une avancée technique fondamentale avec son cortège de conséquences parfois inattendues ? L’objectif de cette chronique est de faire le point sur ce qui est aujourd’hui envisageable, d’évaluer les débuts de réalisation et de présenter les prises de position que l’émergence de cette question a provoquées. |
C’est bien un saut qualitatif qui a eu lieu au niveau technique, avec la découverte du système CRISPR-cas9 qui permet de modifier un génome très facilement et de manière ciblée [1, 2]. Par rapport aux procédés précédents comme les nucléases à doigts de zinc ou les TALEN, le gros avantage est que le ciblage est assuré par une séquence d’ARN homologue au locus visé (l’ARN guide appelé sgARN), et non par une protéine. Par ailleurs, le système présente une bonne efficacité, pouvant aller jusqu’à 100 %, et sa spécificité, sur laquelle on avait quelques inquiétudes, s’avère très bonne moyennant quelques précautions [3]. Au total, on dispose d’un système très souple, facilement modulable via la séquence de l’ARN, et qui se prête à de très nombreuses applications [1, 2]. Il est largement employé afin de créer des modèles animaux pour différentes pathologies, mais il change aussi la donne pour la thérapie génique (somatique) : la possibilité de réparer le gène altéré est enfin ouverte. C’est un changement important : jusqu’ici, dans la quasi-totalité des cas, la thérapie génique apportait un exemplaire fonctionnel du gène altéré ; selon les vecteurs employés, celui-ci s’intégrait ou non dans l’ADN du patient, mais en tous cas il ne remplaçait pas le gène défectueux, n’était pas soumis au même environnement et aux mêmes éléments de régulation – d’où une expression souvent insuffisante, transitoire ou aberrante, et, bien sûr, l’impossibilité de corriger une mutation dominante. Une réelle réparation des gènes devient possible [4] ; elle a déjà été démontrée dans certains cas [5]. Bien entendu, en pratique, il faut que les cellules à réparer soient accessibles, qu’elles puissent être prélevées, modifiées, puis réintroduites chez le patient, mais cela couvre déjà un certain nombre de cas de figure en thérapie génique. On peut donc s’attendre à ce que les quelques succès récemment enregistrés dans ce secteur se multiplient grâce aux nouvelles possibilités offertes par le système CrispR-cas9. |
Et la thérapie germinale ? De plus, rien n’empêche maintenant, sur le plan technique, d’envisager une thérapie génique germinale, une correction du défaut génétique au niveau de l’embryon, et concernant toutes les cellules (y compris ovules ou spermatozoïdes) de l’organisme qui en résulte. Il suffit d’injecter les composants du système, l’ARN messager Cas9 et l’ARN guide (sgARN), dans le zygote (œuf fertilisé)… C’est ce qui a été fait pour induire une modification germinale chez le macaque, et a abouti à l’obtention de deux animaux ayant intégré la modification introduite dans tous les tissus examinés [6]. Ces résultats sont encore incomplets, la transmission à la descendance n’a pu encore être testée, et beaucoup des grossesses induites ne sont pas arrivées à terme ; néanmoins, vu la rapidité des progrès méthodologiques, on peut considérer que la modification de la lignée germinale humaine devient une possibilité très vraisemblable à court terme. Cela d’autant plus que la technique continue à progresser en précision et en efficacité [7]. Du coup certains – notamment en Extrême-Orient – considèrent cette évolution comme acquise1 et envisagent ses conditions d’application [8]. En réalité – l’argument n’est pas nouveau – les cas de figure où une thérapie génique germinale présenterait un réel intérêt médical sont exceptionnels. Il est rare que, parmi la dizaine d’embryons obtenus après une fécondation in vitro, certains ne soient pas indemnes : en moyenne, un quart d’entre eux, par exemple, pour une mutation récessive présente à l’état hétérozygote chez les deux parents. Il est alors bien plus simple et plus sûr de recourir au diagnostic préimplantatoire, pratiqué sur une ou deux cellules prélevées sur chaque embryon, et de n’implanter que les embryons ne contenant pas le gène muté. Seuls quelques cas très particuliers justifieraient une intervention germinale : une affection récessive pour laquelle les deux parents seraient homozygotes (mais auraient-ils alors la capacité d’être parents ?), ou une maladie autosomique dominante pour laquelle l’un des parents serait homozygote. On conviendra que ces cas doivent être extrêmement rares et ne justifient pas une discussion très approfondie… En fait, ce qui se cache derrière cette thérapie germinale tout à fait exceptionnelle (car très rarement justifiée), c’est sans aucun doute l’hypothèse de l’amélioration génétique (enhancement). Amélioration qui peut viser à diminuer le risque de maladies graves (auquel cas elle apparaît justifiée à la moitié des citoyens étatsuniens2) ou à augmenter la taille, l’intelligence ou d’autres caractéristiques « désirables ». Notons que le système CRISPR a déjà été employé pour inactiver le gène CCR5 dans des cellules et les rendre ainsi résistantes à l’infection par le VIH (virus de l’immunodéficience humaine) [9] ; l’extrapolation à un embryon est facile à imaginer… On évoque ainsi, dans les milieux transhumanistes, des variants de gènes associés à une solidité osseuse accrue, à un risque très diminué d’attaque cardiaque ou à une forte protection contre la maladie d’Alzheimer [10] : l’idée serait de pratiquer une sorte de médecine préventive en modifiant les gènes correspondants chez l’embryon pour leur faire acquérir une séquence plus favorable. On voit bien sûr tous les problèmes éthiques et sociétaux que poseraient de telles manipulations. Ils ont été largement discutés il y a une vingtaine d’années, mais dans un contexte où leur réalisation était impossible et même quasiment inimaginable : il était alors facile d’obtenir un consensus pour les condamner. Aujourd’hui, les conditions ont changé… |
On aimerait savoir précisément quels travaux sont actuellement menés dans ce domaine – et bien sûr, il est fort difficile d’obtenir des informations fiables. Des rumeurs [10] font état de travaux menés pour modifier (« éditer ») l’ADN d’embryons humains, notamment en Chine, avec des articles qui seraient actuellement en cours de revue pour publication. Des entreprises comme Editas (http://editasmedicine.com/), OvaScience (http://www.ovascience.com/) ou encore Caribou Biosciences (www.cariboubio.com) s’y intéressent de près avec, pour la dernière, une devise qui en dit long : Engineering any genome, at any site, in any way : tout un programme, en effet ! Ces firmes mettent en avant leurs travaux sur l’édition de gènes dans une optique de thérapie somatique – mais s’intéressent de très près à l’intervention au niveau germinal. Permettons-nous un peu de science-fiction : on imagine facilement le retentissement d’un article qui rapporterait la correction d’une mutation dans le gène BRCA1 chez des embryons humains portant cette mutation… Bien entendu, il s’agirait d’embryons « surnuméraires » qui ne seraient pas réimplantés ; on se contenterait de les laisser se diviser quelques jours in vitro avant de les détruire pour analyser toutes leurs cellules. Les auteurs éviteraient ainsi d’enfreindre trop ouvertement la législation (ils auraient choisi d’opérer dans une des nations les plus permissives de ce point de vue), mais le prolongement de leurs travaux vers la thérapie génique germinale et l’amélioration génétique humaine serait plus qu’évident. L’enjeu médiatique est si fort, les barrières techniques si limitées, qu’une telle tentative est devenue extrêmement probable. Notons qu’à l’heure actuelle la modification de la lignée germinale humaine n’est formellement interdite que dans certaines nations : la
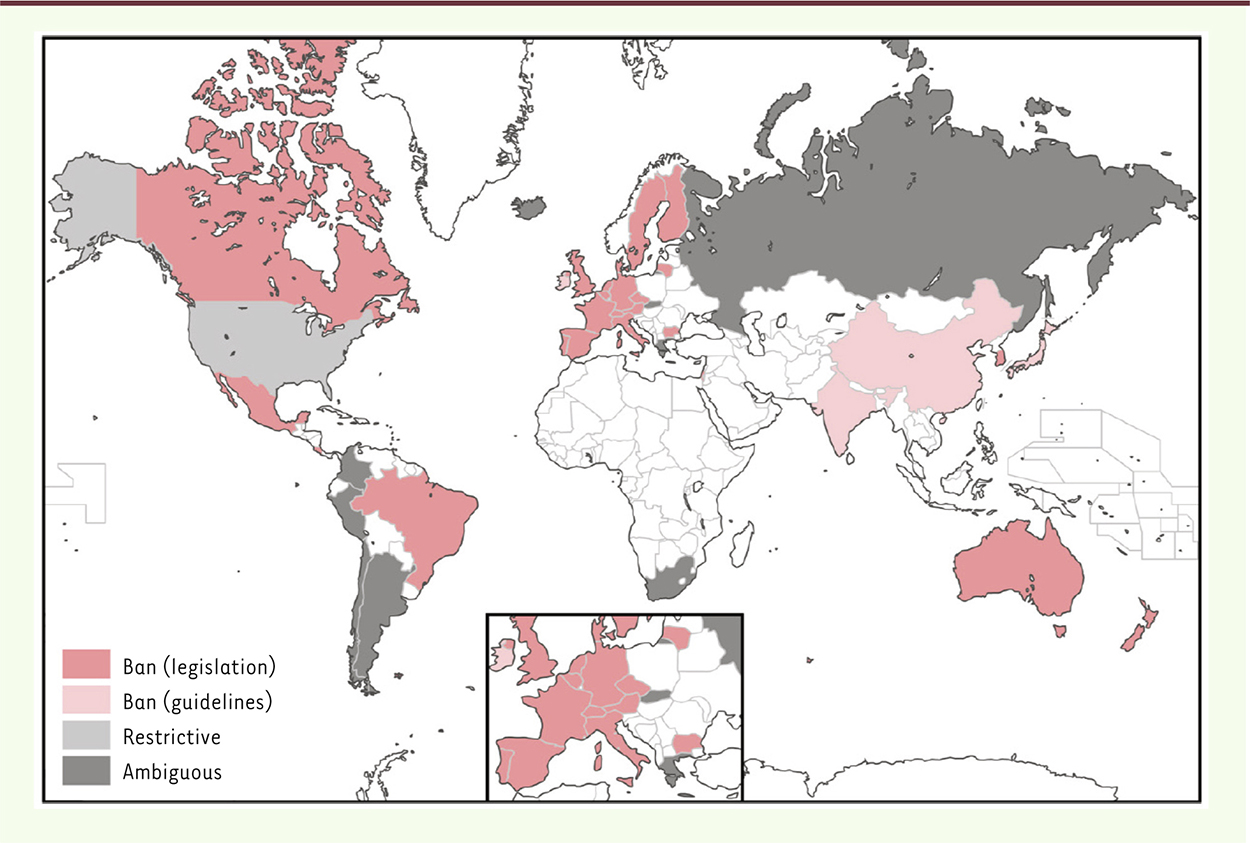
Figure 1
, extraite de l’article [8] illustre cette situation.
 | Figure 1.
Législations concernant la modification de la lignée germinale dans le monde (extrait de l’article [ 8] , Open Access/Creative Commons). Seules les nations apparaissant en rose foncé interdisent formellement (par voie législative) un tel procédé. Les nations en blanc sont celles pour lesquelles les informations n’ont pu être obtenues (© 2014 Araki and Ishii, Creative Commons). |
|
Germline Genome editing : derniers développements Comme on pouvait le prévoir, la première publication rapportant une modification du génome d’embryons humains n’a pas tardé : elle émane, comme attendu, de chercheurs chinois et est parue le 18 avril 2015 dans une revue d’audience limitée [1]. Afin de circonscrire les implications éthiques de leur travail, les auteurs ont utilisé des embryons non viables (des zygotes comportant trois pronucléus) incapables de se développer après réimplantation. Ils ont employé la technique CRISPR/Cas9 (avec un ARN guide adapté et testé sur des lignées cellulaires) pour tenter de modifier le gène de la β-globine (HBB), dans l’optique d’une éventuelle thérapie génique (germinale) de la β-thalassémie. Les résultats ne sont pas à la hauteur de leurs espérances : sur une centaine d’embryons injectés, seuls quatre ont présenté une réparation du gène HBB conforme à l’oligonucléotide introduit ; sept ont été réparés selon la séquence du gène endogène HBD – ce qui n’est pas du tout le but recherché. De plus une recherche assez sommaire (limitée à l’exome) des éventuelles modifications en dehors de la cible visée a détecté plusieurs de ces off-target effects. Et, enfin, les quelques embryons « édités » se sont révélés être des mosaïques, ne portant la modification voulue que dans une partie des cellules. Ces résultats montrent donc que le genome editing d’embryons humains est nettement plus difficile qu’on ne pouvait le penser (le craindre ?) au vu des succès obtenus dans d’autres systèmes. Cela peut relativiser un peu les inquiétudes dont je me suis fait l’écho dans cette chronique – mais n’oublions pas que la technique est très largement employée dans nombre de laboratoires, qu’elle est en constante amélioration et que ce qui est encore difficile aujourd’hui ne le sera plus demain ou après-demain. Il reste donc urgent, et divers éditoriaux s’en sont fait l’écho, de prendre des mesures pour éviter des applications sauvages du système CRISPR/Cas9 en clinique humaine. Le NIH (national institutes of health) a rappelé qu’il ne financera aucune recherche en ce sens [2], et un sommet international organisé par l’Académie des Sciences et l’Académie de Médecine des États-Unis est prévu pour cet automne [3]. Espérons qu’il donnera lieu à une discussion approfondie et à des conclusions claires… RÉFÉRENCES
|
|
Ces enjeux n’ont naturellement pas échappé aux scientifiques impliqués, et ont suscité plusieurs prises de position. L’International Society for Stem Cell Research (ISSCR) a publié le 19 mars son appel à un moratoire sur toute tentative d’application clinique touchant à la lignée germinale (attempts at clinical application of nuclear genome editing of the human germ line), tout en soutenant la recherche. Elle conclut ainsi : The ISSCR also calls for broad public and international dialogue on the capabilities and limitations of these technologies and on the implications of their application to the human germ line [11]. C’est donc une position assez ouverte, qui n’exclut pas catégoriquement, dans le futur, d’éventuelles applications à la lignée germinale. Le même jour est paru dans la revue Science un texte signé par dix-huit universitaires de premier plan (dont David Baltimore et Paul Berg), écrit à la suite d’un « Forum de bioéthique » tenu à Napa (Californie) le 24 janvier 2015 et consacré à cette question [12]. Intitulé A prudent path forward for genomic engineering and germline gene modification, ce texte défend une position analogue : pas d’application clinique (actuellement, et peut-être pour toujours), mais une recherche « transparente » sur l’évaluation et l’amélioration de la technologie, accompagnée de discussions approfondies sur son éventuelle utilisation clinique au niveau germinal. Notons que certains signataires étaient déjà présents à Asilomar, en 1975, que d’autres ont participé à la découverte du système CRISPR-cas9, et que tous sont universitaires. Une troisième prise de position (il y en aura certainement d’autres…) est parue le 26 mars dans la revue Nature [13]. Intitulée Don’t edit the human germ line, elle présente deux particularités intéressantes : elle émane d’acteurs du secteur privé (notamment de l’entreprise Sangamo Biosciences [Richmond, Californie]), et elle préconise un moratoire englobant la recherche sur l’édition du génome dans les cellules germinales, ce que ne font pas les deux précédentes, qui se limitent à condamner les applications cliniques. Pour ces signataires, il est important d’insister sur la différence entre les applications sur cellules somatiques (dans une optique notamment de thérapie génique somatique) et celles qui toucheraient les cellules germinales. Leur objectif semble être à la fois de barrer la route à des recherches trop facilement applicables à la modification du patrimoine génétique humain, et d’éviter qu’une réaction négative globale du public ne rende plus difficile les applications à la thérapie génique somatique – qui semblent en effet potentiellement très positives et à portée de main. |
Cette affaire illustre un fois de plus le caractère imprévisible des évolutions techniques. Bien entendu, tout ce qui est impossible aujourd’hui ne deviendra pas nécessairement réalisable dans l’avenir ; mais nous ne sommes pas à l’abri de surprises (comme cela a été le cas avec Dolly pour le clonage reproductif, considéré jusque-là comme impossible chez les mammifères). Il ne faut donc pas évacuer la réflexion éthique sur un procédé sous prétexte que celui-ci serait définitivement impraticable. La réflexion sur la thérapie génique germinale a bien eu lieu dans les années 1990, mais le contexte a tellement changé qu’il va falloir la reprendre et l’approfondir. Le débat portera bien sûr sur les conditions éventuelles de la réalisation d’une telle intervention en toute sécurité, en excluant notamment des modifications non planifiées se produisant en dehors du site visé (off target effects) [3], mais il faudra aussi, et surtout, traiter la question de fond qui se pose maintenant de manière réaliste : admettons-nous des interventions visant à modifier le patrimoine génétique humain, et si oui lesquelles, dans quelles conditions ? Comme je l’ai indiqué plus haut, les indications proprement thérapeutiques sont quasiment inexistantes. Mais des actions visant à réduire le risque d’une maladie donnée grâce à l’introduction d’un allèle protecteur3 sont tout à fait envisageables : leurs promoteurs pourront les présenter comme un acte de médecine préventive, et nous entraîner ainsi sur la pente glissante (slippery slope) qui mène à l’amélioration génétique proprement dite. De multiples facteurs incitent à prendre cette perspective bien plus au sérieux que les annonces « bidon » du prophète Raël sur un prétendu clonage humain il y a une douzaine d’années : la technique CRISPR-cas9 est dès à présent presque assez performante pour permettre d’envisager des applications cliniques, sa mise en œuvre ne demande pas de moyens techniques extraordinaires, elle est très largement pratiquée depuis deux ou trois ans et en constante amélioration, et de nombreux laboratoires extrême-orientaux l’utilisent dans un contexte où la législation et les mentalités sont nettement plus permissives qu’en Occident par rapport à ce type d’intervention. N’oublions pas les entreprises déjà citées qui lorgnent déjà – sans trop le dire – sur ce nouveau marché… Voilà le nouveau paysage tel qu’on peut l’appréhender aujourd’hui. Appréhender est bien le terme qui convient, car la perspective d’une intervention sur la lignée germinale humaine est proche, et nous sommes loin d’avoir les idées claires sur ce que nous voulons en faire. Afin de bien comprendre les tendances auxquelles il va falloir faire face, on peut recommander la (re) lecture d’un livre paru il y a plus de dix ans : Redesigning humans, our inevitable genetic future, par Gregory Stock [14], et aussi celle d’un blog tout récent [15] présentant une analyse qui se dit équilibrée… mais qui est tout de même bien imprégnée de pragmatisme nord-américain. A travers ces études qui se veulent objectives et réalistes, on peut facilement entrevoir un monde dans lequel le libre jeu du marché permettrait aux super-riches d’améliorer le patrimoine génétique de leur descendance, et d’ajouter ainsi aux considérables inégalités économiques actuelles un privilège génétique transmissible aux générations suivantes. Est-ce bien là l’avenir que nous souhaitons pour l’humanité ? |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Gilgenkrantz H. La révolution des CRISPR est en marche . Med Sci (Paris). 2014; ; 30 : :1066.–1069. 2.
Hsu PD, Lander ES, Zhang F. Development and applications of CRISPR-Cas9 for genome engineering . Cell. 2014; ; 157 : :1262.–1278. 3.
Sternberg SH, Redding S, Jinek M, et al. DNA interrogation by the CRISPR RNA-guided endonuclease Cas9 . Nature. 2014; ; 507 : :62.–67. 4.
Xiao-Jie L, Hui-Ying X, Zun-Ping K, et al. CRISPR-Cas9: a new and promising player in gene therapy . J Med Genet. 2015; ; 52 : :289.–296. 5.
Schwank G, Koo BK, Sasselli V, et al. Functional repair of CFTR by CRISPR/Cas9 . Cell Stem Cell. 2013; ; 13 : :653.–658. 6.
Niu Y, Shen B, Cui Y, et al. Generation of genemodified cynomolgus monkey via Cas9/RNA-mediated gene targeting in one-cell embryos . Cell. 2014; ; 156 : :836.–843. 7.
Chu VT, Weber T, Wefers B, et al. Increasing the efficiency of homology-directed repair for CRISPR-Cas9-induced precise gene editing in mammalian cells . Nat Biotechnol. 2015; ; 33 : :543.–548. 8.
Araki M, Ishii T. International regulatory landscape and integration of corrective genome editing into in vitro fertilization . Reprod Biol Endocrinol. 2014; ; 12 : :108.. 9.
Wang W, Ye C, Liu J, et al. CCR5 gene disruption via lentiviral vectors expressing Cas9 and single guided RNA renders cells resistant to HIV-1 infection . PLoS One. 2014; ; 9 : :e115987.. 12.
Baltimore BD, Berg P, Botchan M, et al. Biotechnology. A prudent path forward for genomic engineering and germline gene modification . Science. 2015; ; 348 : :36.–38. 13.
Lanphier E, Urnov F, Haecker SE, et al. Don’t edit the human germ line . Nature. 2015; ; 519 : :410.-411. 14.
Stock G.. Redesigning humans, our inevitable genetic future . Boston-New York: : Houghton Mifflin Co; , 2002. |